茶叶中咖啡因分子结构上甲基的电子效应
杨惠良,武永巨,辛广勤,范新亚,何天香,刘 静
(德州学院,山东德州 253023)
甲基作为供电子基,早已为人们所熟悉,然而对甲基具有供电子效应的内在原因以及这种效应对化学反应的影响认识往往不够深刻,甚至有些模糊。长期以来,几乎所有化学文献都是把甲基只作为供电基进行阐述,因而在人们思想中形成了一种牢固的认识,即甲基只是一个供电子基,现在看来这个结论是不全面的。
甲基是供电子基还是吸电子基,早在上世纪四十年代国外科学家们就开始了讨论和研究,我国许多著名的化学工作者也紧随其后,对这个问题进行了多方面的研究,他们认为:甲基既可以作为供电子基,也可以作为吸电子基,由甲基的分子内结构和所处的体系来决定。因为内外因素可以左右甲基的供电或吸电的电性行为。随着科学的发展,近代物理化学和分子轨道理论的成功运用,新技术、新方法、新手段层出不穷,人们对甲基的电子效应也有了比较明确的认识。
一般认为,在甲基中碳原子进行了sp2杂化,并与甲基上的三个氢原子形成三个s-sp3σ键,另一个sp3杂化轨道以基的形式连接分子内的另一部分。这种特殊的结构,各原子之间都有相互作用,电子的运动符合量子力学规律,使甲基中既存在σ电子引起的静电诱导效应和π电子引起的共轭效应。甲基的电子效应是诱导效应和共轭效应共同作用的结果。这种作用是比较微弱的,当分子内其他基团的电子效应大于甲基的电子效应时,甲基的电子效应似乎可以忽略不计,此时甲基所表现出来的供电或吸电性实际上是由其他因素产生的,这也正是人们对甲基的供电性或吸电性行为模糊不清的原因所在。
1 甲基作为供电子基和吸电子基的变动
在化学文献中,一般认为醇的相对酸性为:
CH3OH>CH3CH2OH>(CH3)2CHOH>(CH3)3COH
其原因是由于甲基的供电效应使得氧原子上电子云密度增加,H和O结合得较牢固,氧氢键难以断裂,且a-C上所连甲基越多,供电效应越强,氧氢键越难断裂,即酸性越弱。这个结论及解释的正确性是毋庸置疑的。只是前提条件为液相。
但是,1969年,Brauman等人运用气相离子回旋共振谱对醇和胺的相对酸性进行了研究。在气相的离子回旋共振谱中,观察到醇的酸性和碱性次序(在气相环境下,完全排除了溶剂化效应的影响,所反应出的完全是分子的内在性质)均为:
(CH3)3COH>(CH3)2CHOH>CH3CH2OH>CH3OH
与液相中的情况正相反,即醇的酸、碱性均随分子中a-C上甲基的增多而增大。
在同样条件下测得胺的酸、碱性也是随分子中氮原子上甲基的增加而增大。

综上所述,甲基不但具有供电效应,而且也具有吸电效应。究竟是供电还是吸电,要根据甲基所处的体系和甲基所在化合物所处的外部环境不同而发生变动。当与甲基直接相连的原子或基团的电负性大于甲基时,甲基为供电基;当与甲基直接相连的原子或基团的电负性小于甲基时,甲基为吸电基。这是对甲基电子效应的全面认识。
2 甲基的供电形式
甲基作为供电基时,其供电作用主要有两种形式,即诱导效应和共轭(超共轭)效应。
2.1 诱导效应
在有机化合物分子中,由于电负性不同的基团(原子或原子团)的影响,使整个分子中的成键电子云密度向某一方向偏移,使分子发生极化,产生诱导效应。
当甲基与电负性较大的原子或基团相连时,其供电特性通过诱导效应实现。它们之间形成的电子对偏向电负性大的一侧的共价键。受到吸电子基的诱导,表现出供电子效应。
如,CH3→CF3,CH3→NO2,CH3→SO3H 等。
当甲基与SP2、SP杂化的碳原子相连时也呈现正诱导效应。

这是因为不同的杂化状态,其电负性不同,S轨道成份所占比例越大,电负性越大。可见,甲基与不饱和碳连接时,呈现出供电子的诱导效应。
实验测得sp、sp2、sp3杂化状态下的电负性如下:杂化状态:CspCsp2Csp3
电负性:2.75 2.62 2.50.
由此可见,三种杂化轨道的电负性大小顺序为:
sp>sp2>sp3
所以,我们可以得出结论:S轨道成份所占比例越大,电负性越大。
2.2 超共轭效应
甲基上的C原子与极小的H原子结合,由于电子云的屏蔽效力很小,这些σ电子比较容易与临近的π电子(或p电子)发生电子的离域作用,产生超共轭效应。
超共轭效应是一种比π-π共轭和p-π共轭弱得多的电子效应,视其电子转移作用可分为σ-p超共轭、σ-π超共轭和σ-σ超共轭等几种种情况,其中,以σ-p 超共轭、σ-π超共轭最为常见。
2.2.1 σ-π超共轭效应
以丙烯为例描述如下:
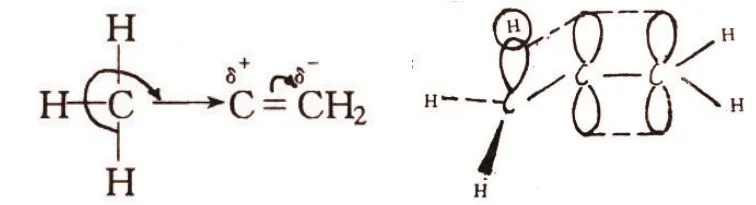
图1
甲基上碳原子与氢原子结合,对电子云的屏蔽效应很小,因而C-H键的σ成键轨道容易与相邻的π轨道发生一定程度的重叠(共轭),引起σ电子和π电子发生一定程度的离域作用,即σ-π超共轭效应。结果使烯键电子云密度增大,同时造成π电子云极化。此外,当甲基与炔基、芳环、羰基直接相连时,都存在σ-π超共轭效应。
2.2.2 σ-p 超共轭效应
σ-p超共轭效应常见于碳正离子和碳游离基中。在碳正离子和碳游离基中,碳原子以SP2杂化,三个杂化轨道分别与三个原子或基团形成三个σ键,三个σ键和碳原子在同一平面上,剩余的p轨道垂直于该平面,对于碳正离子该轨道空着,对于碳游离基该轨道上有一个电子,两者都有接受电子的能力。当甲基直接与上述基团相连时,同时存在诱导效应(Csp→Csp2)和σ-p超共轭效应,即甲基上碳氢键的σ成键电子离域到空的(碳正离子)或单电子的(碳游离基)P轨道上,使体系能量降低。上述σ-p 超共轭效应可以描绘成图2。
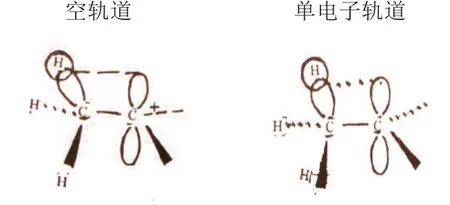
图2
无论是σ-p 超共轭效应还是σ-π超共轭效应,对甲基来说都是给电子的,参与超共轭的碳氢键越多,超共轭效应越强。
需要明确的是,只有a-碳氢键(直接与重键碳或碳正离子、碳自由基相连的碳原子上的碳氢键),才能产生有效的超共轭作用。甲基的诱导效应和超共轭效应往往同时存在,通常超共轭效应的影响大于诱导效应。
黄嘌呤、咖啡因的结构式:

从结构式可以看出,黄嘌呤母核上的氮原子由于受到羰基及其他氮原子吸电子效应的影响,电子云密度降低,而甲基和黄嘌呤母核有存在超共轭效应,综合分析,我们可以得出结论:受电子效应的影响,若氮原子上有氢原子则易解离而显酸性,氮上的氢原子被甲基取代而导致产生的衍生物之间的酸碱性不同。茶叶中的茶碱和可可豆碱均为二个甲基的取代物,仍可与氢氧化钠或硝酸银分别生成钠盐或银盐,而咖啡因因为三个甲基取代不显酸性,无上述反应。

