甘露醇兼养三角褐指藻生产多不饱和脂肪酸和岩藻黄质
丁晓婷, 王丽娟, 范 勇, 张培玉, 李福利
(1. 青岛大学 环境科学与工程学院, 青岛 266071; 2. 中国科学院 青岛生物能源与过程研究所, 青岛 266101)
三角褐指藻(Phaeodactylumtricornutum)是属于硅藻门(Bacillariophyta)的海洋微藻。细胞中EPA(Eicosapentaenoic acid,二十碳五烯酸)含量能达到油脂的20%以上[1]。EPA是含5个双键的多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA),积极补充EPA对婴儿大脑发育及成人心血管系统疾病的防治具有很好的效果[2]。另外,作为模式硅藻,三角褐指藻中富含FCP复合体(Fucoxanthin-chlorophyll a/c protein,岩藻黄素-叶绿素a/c蛋白复合体),岩藻黄质含量在15.42~16.51 mg/g之间[3-4]。岩藻黄质(Fucoxanthin,Fx),又称岩藻黄素或褐藻素,为偏极性类胡萝卜素[5]。服用岩藻黄质能加快新陈代谢,调节3-羟甲戊二酰辅酶A还原酶和酰基辅酶A的活性[6]。岩藻黄质可以抑制肝脏中脂肪的积累,降低磷脂磷酸水解酶的活性,并通过刺激线粒体解偶联蛋白在白色脂肪组织中的表达从而起到减肥作用[7]。
自20世纪80年代后,微藻养殖开始在全世界推广开来[8-11],其产品应用于健康食品、化妆品、医药产业、高档饲料等领域。在微藻的培养过程中,其营养方式具有多样性,大多数微藻采用光合自养(Phetoautotrophy)方式,也有许多微藻具有利用有机碳进行兼养(Mixotrophy)和异养(Heterotrophy)生长的能力[12]。自养培养在生长中后期会受光照限制,而兼养和异养能够部分消除光照限制[13],为微藻高密度培养提供了一条有效途径。选择一种适合兼养利用的碳源,是决定兼养生长速度和经济性高于其他培养方式的最关键因素。另外,在培养过程中,常规有机碳源面临着培养过程易污染,有机碳源利用率低使得培养成本高等问题,限制了大规模培养技术的发展。使用甘油、乙酸钠和葡萄糖作为兼养碳源,对三角褐指藻利用多种有机碳源进行兼养培养的过程进行分析,培养生物量分别达到自养的1.60、1.28和1.21倍[13]。进一步提高兼养效率,寻找在常规培养环境中杂菌不易利用的有机碳源以及改善培养基和细胞状态的活性添加剂,提高兼养碳源利用率,是我们探索的方向。
甘露醇(Mannitol)是褐藻的主要积累物质之一,是海洋中含量最为丰富的一类单糖物质[14]。其能通过磷酸转移酶(phosphotransferase system,PTS system)转运到细胞内,经过甘露醇磷酸脱氢酶(Mannitol-1-phosphate dehydrogenases)转化为6-磷酸果糖,进入碳代谢途径,因此可以被选作在兼养培养过程中作为有机碳源进行添加。鉴于此作者针对三角褐指藻兼养过程,提供一种利用甘露醇兼养三角褐指藻生产多不饱和脂肪酸和岩藻黄质的方法,旨在提高三角褐指藻生产率。
1 材料与方法
1.1 藻种与基础培养条件
三角褐指藻,购自中国海洋大学微藻种质库,编号MACC/B228。
培养条件:使用优化的f/2培养基[15],温度25 ℃,光照80 μmol photons/m2·s,光周期为16 h光照、8 h黑暗。自养培养2 d后,加入不同浓度的甘露醇及茶多酚,培养至第10天,测定细胞的生长曲线,用于分析最佳兼养碳源浓度和活性添加剂的浓度。
在使用最佳添加浓度进行培养的基础上,调整培养条件用于岩藻黄质和EPA产量分析评价。在培养过程中每2 d检测和计算甘露醇和茶多酚的利用情况,并补加甘露醇与茶多酚至初始浓度继续培养至第10天,测定三角褐指藻的岩藻黄质浓度和EPA含量。
1.2 主要实验药品
甘露醇和茶多酚购自山东西唐生物科技有限公司,普通市售产品,食品级;海盐购自青岛海之盐水族科技有限公司,普通市售产品;岩藻黄质标准品购自Sigma-Aldrich公司;EPA标准品购自上海安谱(ANPEL)实验科技股份有限公司。
1.3 检测方法
1.3.1 岩藻黄质的测定
三角褐指藻藻细胞(细胞干重约为50~60 mg)在4000 r/min速度下离心收集,重悬在乙醇中进行色素提取,45 ℃保温2 h,每0.5 h震荡1次,通过高速离心将提取的色素与藻渣分离。岩藻黄质含量的测定使用高效液相色谱仪检测系统(Primaide,Hitachi),选择反相C18色谱柱(2.7 μm,100×4.6 mm)。检测波长445 nm,进样量5 μL。流动相为乙腈和水,流速1 mL/min。乙腈比例在8 min内由80%升至100%, 维持这个比例洗脱3 min。使用岩藻黄质标准曲线进行定量。
1.3.2 EPA的测定
三角褐指藻藻细胞(细胞干重约为50~60 mg)在4000 r/min速度下离心收集。加入6 mL氯仿-甲醇溶液(2∶1,V/V),37 ℃摇床中震荡1 h,随后加入2 mL KCL(0.9%)充分震荡。5000 r/min离心5 min,分离油层并用氮吹仪吹干后得到藻油。加入1.5 mL正己烷使藻油能够完全溶解,之后加入4.5 mL 2% 硫酸-甲醇(正己烷∶硫酸-甲醇=1∶3,V/V),85 ℃甲酯化反应3 h。用于气相色谱(GC)分析脂肪酸甲酯组成[12, 16]。
利用安捷伦7890A气相色谱进行分析,色谱柱为HP-5(30 m×320 μm×0.25 μm)。进样口温度:250 ℃;进样体积:1 μL;升温程序设置:120 ℃维持5 min,随后3.5 ℃/min升至240 ℃,保持10 min。
1.3.3 甘露醇的测定
使用2 g/L甘露醇培养三角褐指藻的过程中,将5 mL藻液在12 000 r/min速度下离心,收集上清培养液,根据样品浓度稀释,使用安捷伦高效液相色谱仪示差检测器检测系统(Agilent 1260),选择Bio-RAD Aminex HPX-87H色谱柱(300 mm×7.8 mm),进样量为10 μL,柱温箱55 ℃,流动相为5 mol/L H2SO4,流速为0.5 mL/min,等强度洗脱30 min。
1.3.4 茶多酚的测定
使用2 g/L甘露醇和0.2 g/L茶多酚培养,在培养过程中,对茶多酚含量进行分析。将5 mL三角褐指藻在12 000 r/min速度下离心,收集上清,根据样品浓度稀释,使用高效液相色谱仪检测系统(Primaide,Hitachi),选择反相C18色谱柱(2.7 μm,100×4.6 mm)。检测波长为280 nm,进样量为10 μL,流动相为甲醇∶水=24∶76,流速为1 mL/min,等强度洗脱30 min。
2 结果与分析
2.1 不同浓度甘露醇条件下三角褐指藻的生长
不同浓度甘露醇作为外加有机碳源的条件下,生长情况如图1-A所示,甘露醇浓度在2~10 g/L的范围内,最大生物量均超过对照,各组之间无显著差异(P>0.05)。甘露醇浓度为0.5~1 g/L时,达不到促进兼养培养的效果。而甘露醇浓度为15 g/L时,可能抑制了三角褐指藻的生长。因此在培养过程中,基于培养成本的考虑,可以选取2 g/L甘露醇浓度作为最佳的培养浓度。
2.2 通过添加茶多酚促进三角褐指藻利用甘露醇进行兼养生长
茶多酚是一种水溶性抗氧化剂,在本研究组的前期研究中,发现茶多酚可促进产神经酸微藻Mychonastesafer的生长[17]。因此,在本实验中,在2 g/L的甘露醇作为有机碳源的条件下,使用不同浓度梯度的茶多酚作为抗氧化物质,改善细胞状态,提高三角褐指藻的兼养速率。结果(图1-B)显示:当茶多酚浓度在0.1~2 g/L的范围内,生长速率均超过对照。茶多酚浓度达到5 g/L时,开始影响三角褐指藻的正常生长。培养至第10 d时,最大生物量稍低于图1-A中只加甘露醇获得的最大生物量,这可能由于两次独立实验接种时的种子液活性有所差异。但多次重复实验结果表明,同一实验批次中与不加茶多酚的对照组相比,其差异性显著。因此三角褐指藻在甘露醇浓度为2 g/L的条件下,选取添加0.2 g/L茶多酚时以获得最大生物量。

A中CT为对照组不添加甘露醇;B为在添加2 g/L甘露醇作为有机碳源的基础下,不同浓度茶多酚条件下的生长曲线;CT为对照组不添加茶多酚
2.3 兼养培养三角褐指藻过程中甘露醇与茶多酚的利用
以2 g/L甘露醇,0.2 g/L茶多酚为添加浓度,对三角褐指藻进行培养,同光合自养生长组和只加甘露醇的对照组进行比较。在培养过程中,测定培养液中的剩余甘露醇与茶多酚的量。结果(图2-A)显示,培养2 d后,甘露醇具有不同的利用水平,添加茶多酚的实验组利用率为50%,而未添加茶多酚的对照组,利用率仅为20%,说明茶多酚能够促进甘露醇的利用;液相色谱结果(图2-B)显示,儿茶素类化合物,主要包括儿茶素(EC)、没食子儿茶素(EGC)、儿茶素没食子酸酯(ECG)和没食子儿茶素没食子酸酯(EGCG)等物质,含量逐步减少,说明茶多酚的主要活性成分参与了细胞的生理活动,或者在培养过程中存在降解过程。分析结果显示单位时间内(2 d),添加茶多酚的实验组,甘露醇利用率稳定在39%~48%,而仅添加甘露醇的实验组,其利用率稳定在22%~30%之间;茶多酚的主要成分被利用或者降解完全。因此,基于以上检测分析得到的结果,每2 d补加甘露醇和茶多酚至初始浓度。培养至第10天,测定EPA与岩藻黄质的含量。
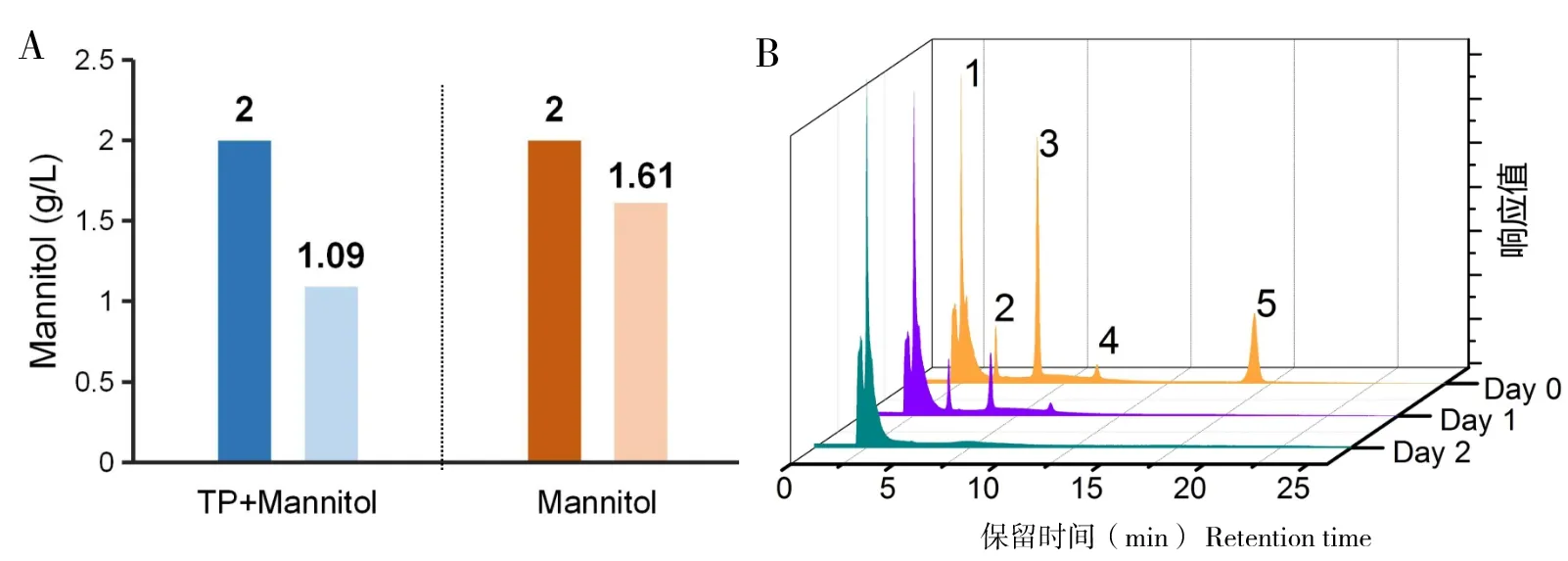
A为培养2 d后的甘露醇的利用情况,TP:茶多酚;B为使用HPLC分析茶多酚主要成分,1:表没食子酸儿茶素;2:右旋儿茶素;3:表没食子儿茶素没食子酸酯;4:表儿茶素;5:表儿茶素没食子酸酯
由图3可知,添加甘露醇的2个实验组,三角褐指藻岩藻黄质和EPA含量都要高于光合自养对照组;在进一步添加茶多酚的情况下,岩藻黄质和EPA的含量分别比仅添加甘露醇的实验组高出30%和6%,说明茶多酚的添加能够有效地促进三角褐指藻的兼养效率,达到提高岩藻黄质和多不饱和脂肪酸产量的目的。

A为岩藻黄质含量;B为EPA在总油脂中的含量,TP:茶多酚
2.4 比较甘露醇和甘油作为有机碳源培养三角褐指藻的差异
在方法1.1的基础上,使用不同有机碳源对三角褐指藻进行兼养培养,分别以2 g/L的甘油或者甘露醇作为初始外加有机碳源,并添加0.2 g/L茶多酚,培养过程中仅在培养的第2天添加一次有机碳源。
结果(图4)表明,使用甘油作为碳源,在添加茶多酚的情况下也具有较好的兼养效果。在培养至第10天时,生物量和岩藻黄质的含量分别比光合自养高出26%和53%,而以甘露醇为碳源时,生物量和岩藻黄质的含量分别比光合自养高出63%和90%。这说明在添加茶多酚的情况下,甘油和甘露醇作为有机碳源都能用于三角褐指藻的兼养培养,其中甘露醇的培养效果更好。

A为生长曲线;B为岩藻黄质含量。Control:光合自养组;TP:茶多酚
3 讨论与结论
甘露醇是海洋环境中的主要碳水化合物之一,在海洋中分布广泛。三角褐指藻作为海洋微藻,能够适应甘露醇的渗透压力,并具有利用甘露醇的关键代谢途径和基因(甘露醇-1-磷酸脱氢酶;XP_002182129.1;Mannitol-1-phosphate dehydrogenases),通过实验发现,甘露醇同甘油作为碳源相比,能够有效提高三角褐指藻的兼养生长速度和产量(提高了30%),使得甘露醇可以作为一种有效的兼养碳源。并且在相同培养条件下,含甘露醇的培养体系不易被环境中的杂菌污染,在短期的兼养培养周期中,不会因为菌的污染而造成培养过程的失败。另外还发现添加茶多酚的培养体系具有很好的环境抗逆效果。茶多酚的分子作用机理目前还不清楚,但在Xu[17]等的工作中,表征了通过添加植物生长因子及茶多酚,微藻细胞内活性氧水平下降,PSII受到氧化损伤程度低,因此修复组装受损PSII光合系统的CP43蛋白表达下调。因此,我们推测,在三角褐指藻中,其具有相似的作用机理,进一步优化兼养培养体系的辅因子添加,提高碳源利用率和经济效益,是我们今后需要进一步尝试改进的方面。

