NH4HCO3水热处理对氧化铝孔结构与表面性质的影响
季洪海 刘璐 凌凤香 王少军 张会成
中国石化大连(抚顺)石油化工研究院
活性氧化铝作为一种多孔性材料,因其优异的物化特性而作为催化剂或载体被广泛应用[1-2]。氧化铝载体的孔结构及表面性质不仅影响负载活性组分的分散度,还与催化剂的活性、选择性、催化剂寿命等密切相关[3]。随着原油重质化的日趋严重[4-5],传统的小孔氧化铝已无法满足生产要求,人们越来越重视介孔和大孔活性氧化铝的生产。Figueiredo[6]认为NH4HCO3对氧化铝载体孔径分布有重要作用。Trimm等[7]认为NH4HCO3和Al(OH)3在一定条件下发生晶化反应,生成NH4Al(OH)2CO3晶体,在随后的焙烧过程中发生分解并放出气体,从而达到扩孔的目的。杨清河等[8]在NaAlO2溶液和CO2低温成胶的沉淀中加入一定量的NH4HCO3,控制一定的时间、温度和压力,可得到大孔氧化铝。熊莹等[9]对商用拟薄水铝石进行铵盐水热处理,制得孔径集中分布在介孔范围内的氧化铝。曾令有等[10]以NH4HCO3为原料,对拟薄水铝水热处理,成功合成了碳酸铝铵,并制备了γ-Al2O3载体和催化剂。
研究发现,目前对同一氧化铝制备过程中不同阶段物料(即成胶形成的氢氧化铝沉淀,干燥后形成的水合氧化铝,焙烧后形成的氧化铝)进行NH4HCO3水热处理的对比研究未见报道,处理后氧化铝的孔结构及表面性质变化规律尚不清楚。本研究对硫酸铝-偏铝酸钠法制备氧化铝过程中形成的氢氧化铝沉淀滤饼、干燥后的水合氧化铝及焙烧后的氧化铝进行NH4HCO3水热处理,对比研究NH4HCO3水热处理对氧化铝的孔道结构与表面性质的影响。硫酸铝-偏铝酸钠法制备氧化铝流程如图1所示。

1 实验部分
1.1 原料与试剂
硫酸铝,分析纯,天津市大茂化学试剂厂生产;偏铝酸钠,化学纯,天津市光复精细化工研究所生产;碳酸氢铵,分析纯,天津市致远化学试剂有限公司生产。
1.2 氧化铝制备
配制硫酸铝和偏铝酸钠溶液,硫酸铝溶液浓度为8 g/100 mL(以Al2O3计),偏铝酸钠溶液浓度为17 g/100 mL(以Al2O3计),采用并流成胶的方式向反应罐中逐滴加入硫酸铝和偏铝酸钠溶液,硫酸铝溶液滴加速度为1 L/h,偏铝酸钠溶液滴加速度为1.2 L/h,控制反应pH值为8.5左右,形成的沉淀于90 ℃老化1 h,得到的沉淀经洗涤、过滤得到滤饼L,滤饼于120 ℃干燥6 h得到水合氧化铝S,水合氧化铝于600 ℃焙烧4 h得到氧化铝Y。
1.3 氧化铝水热处理
分别称取上述氧化铝制备过程中的滤饼L 23 g、水合氧化铝S 14 g、氧化铝Y 10 g置于200 mL聚四氟乙烯内衬中,加入150 mL摩尔浓度为2 mol/L的碳酸氢铵溶液,磁力搅拌20 min,置于水热反应釜中,密封后于140 ℃水热处理6 h,水热处理后的物料经洗涤、过滤,过滤物于120 ℃干燥6 h分别制得氧化铝前体样品HTL-120、HTS-120及HTY-120,氧化铝前体样品于600 ℃焙烧4 h分别制得氧化铝样品HTL-600、HTS-600及HTY-600。
1.4 样品表征
采用日本理学D/max2500型X射线衍射仪对样品物相结构进行XRD表征;采用美国热电公司Nicolet-6700傅里叶红外光谱仪对样品进行FT-IR表征,配MCT/A检测器;在自制抽真空系统(包括抽真空系统、温控系统和石英红外吸收池等),采用石英弹簧重量吸附法测定样品表面酸性质,真空系统抽至1×10-2Pa,加热到500 ℃恒温1 h,净化样品,除去覆盖在样品表面上的吸附物和水等,然后在继续抽真空的条件下降到室温,通入吡啶吸附,再分别升温至160 ℃、250 ℃、350 ℃、450 ℃恒温1 h,测定吡啶吸附量,计算样品的表面酸性质。通过160 ℃时,样品的吡啶吸附量计算的酸量为总酸量,160 ℃时酸量与250 ℃时酸量差值为弱酸量,250 ℃时酸量与350 ℃时酸量差值为中强酸量,350 ℃时酸量与450 ℃时酸量差值为强酸量;采用日本JEOL公司JSM-7500F型场发射扫描电子显微镜对试样的表面形貌进行SEM表征;采用美国麦克公司ASAP-2420型物理吸附仪对试样孔结构进行N2吸附-脱附表征。
2 结果与讨论
2.1 水热处理条件对样品孔结构影响
2.1.1水热处理温度对样品孔结构影响
试验中考察了水热处理温度对滤饼(L)、水合氧化铝(S)及氧化铝(Y)孔结构的影响,水热处理温度分别为120 ℃、140 ℃、160 ℃、180 ℃,处理时间为4 h,处理后物料经120 ℃干燥6 h, 600 ℃焙烧4 h分别制得氧化铝样品,样品的孔结构如图2所示。从图2可以看出,随着水热处理温度的升高,样品比表面积和孔容呈先增加后降低的趋势。这可能是由于水热处理温度较低时氧化铝晶粒二次结晶不完整、水热处理温度过高时氧化铝晶粒过度生长引起的。

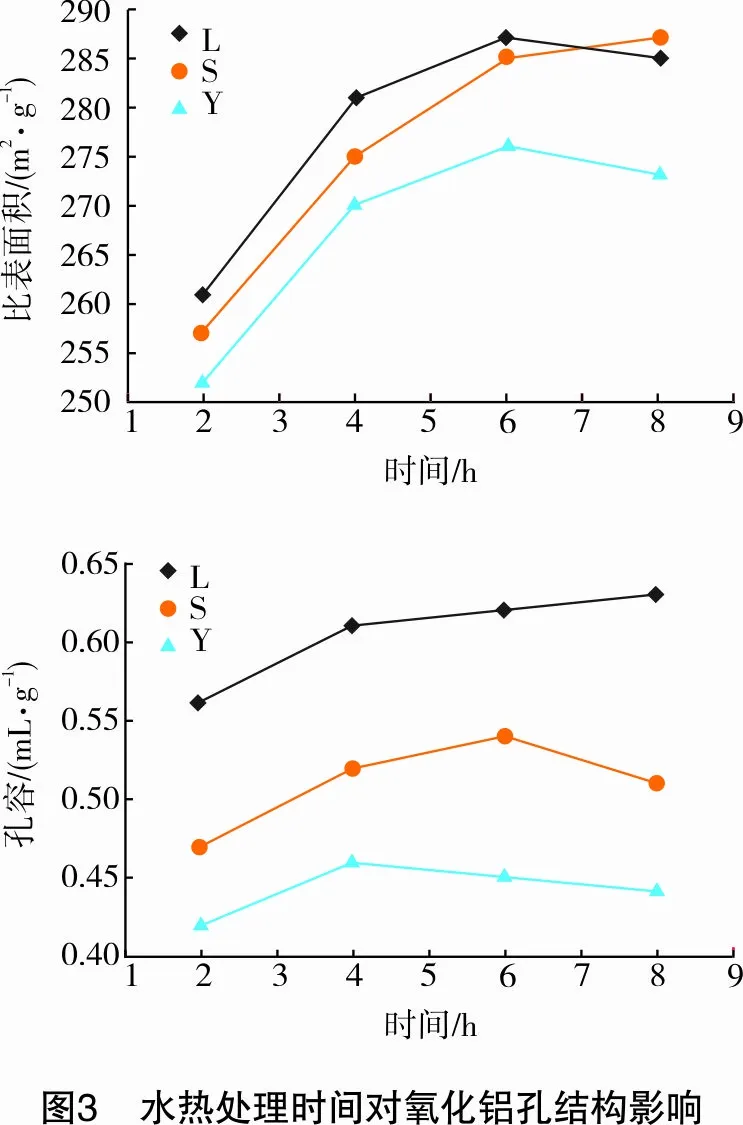
2.1.2水热处理时间对样品孔结构影响
水热处理时间对滤饼(L)、水合氧化铝(S)及氧化铝(Y)孔结构的影响如图3所示,实验中在水热温度140 ℃条件下对样品分别处理2 h、4 h、6 h、8 h。从图3可以看出,当水热处理时间低于6 h时,随着水热处理时间的增加,样品的比表面积和孔容逐渐增大,当处理时间大于6 h时,样品的比表面积和孔容增加幅度不明显,有的出现了降低趋势,这可能是由于在水热晶化条件下,氧化铝晶粒随着时间的增加逐渐晶化完整,当水热处理时间过长时,氧化铝晶粒由于过度生长而遭到破坏。
2.2 样品物化性质与结构表征
研究发现,当水热处理温度为140 ℃、水热处理时间为4 h时,样品具有较高的比表面积和孔容。因此,选择在该条件下对样品进行水热处理,并研究了样品结构及表面性质的变化。
2.2.1XRD表征
应用XRD分析了水热处理后干燥样品及焙烧样品的物相结构,表征结果如图4所示。从图4(a)可以看出,样品S在2θ为14.0°、18.7°、20.3°、27.8°、28.2°、38.4°、40.5°、49.3°、53.1°、63.8°、65.0°附近分别出现了较强的衍射峰,与标准物质卡片(JCPDS No.71-0114、JCPDS No.49-0133)比对,确定2θ为18.7°、20.3°、27.8°、40.5°、53.1°、63.8°附近特征峰为Al(OH)3的特征衍射峰,而2θ为14.0°、28.2°、38.4°、49.3°、53.1°、65.0°附近特征峰为AlO(OH)的特征衍射峰,这说明合成的样品为Al(OH)3和AlO(OH)的混合相。HTL-120和HTS-120样品在2θ为14.0°、15.2°、18.7°、20.3°、21.8°、26.0°、26.9°、27.8°、28.2°、30.8°、34.9°、38.4°、40.5°、44.6°、45.5°、49.3°、53.1°、63.8°、65.0°、67.2°附近分别出现了较强的衍射峰,与标准物质卡片(JCPDS No.71-1314)比对,确定2θ为15.2°、21.8°、26.0°、26.9°、30.8°、34.9°、44.6°、45.5°、67.2°附近的衍射峰为NH4Al(OH)2CO3的特征衍射峰,这说明滤饼及水合氧化铝经NH4HCO3溶液水热处理后形成的物质为NH4Al(OH)2CO3、Al(OH)3和AlO(OH)的混合物。HTY-120样品在2θ为15.2°、21.8°、26.0°、26.9°、30.8°、34.9°、44.6°、45.5°、67.2°附近出现较强的衍射峰,与标准物质卡片(JCPDS No.71-1314)比对,确定该物质为NH4Al(OH)2CO3,未见其他杂相存在,这说明氧化铝经NH4HCO3溶液水热处理后完全转变为NH4Al(OH)2CO3。HTL-600、HTS-600、HTY-600及Y样品在2θ为37.6°、45.8°、60.9°、67.0°附近出现特征衍射峰,与标准物质卡片(JCPDS No.79-1558)比对,确定该物质为γ-Al2O3,衍射峰中没有杂峰出现,说明焙烧时NH4Al(OH)2CO3、Al(OH)3和AlO(OH)完全转化为γ-Al2O3。

2.2.2孔结构表征
焙烧后样品的N2吸附-脱附曲线如图5(a)所示。从图5(a)可以看出,4种氧化铝具有Ⅳ型吸附等温线特征[11],在相对压力p/p0<0.5时,等温线斜率较小且吸附-脱附曲线基本重合,说明样品的孔径分布比较集中,同时小尺寸孔的数量相对较少。p/p0>0.5 时,等温线斜率急剧上升且吸附-脱附曲线出现较大的分离,吸附-脱附等温线表现为明显的H3型回滞环,回滞环等温线没有明显的饱和吸附平台。样品的孔结构数据如表1所列。从表1可以看出,Y样品的比表面积为310 m2/g,孔容为0.63 mL/g,平均孔径为8 nm。而滤饼、水合氧化及氧化铝经NH4HCO3水热处理后比表面积变化较小,孔容有不同程度的降低,其中滤饼孔容降低最小,水合氧化铝次之,氧化铝降低幅度最大。从图5(b)孔分布曲线看,水热处理后样品的可几孔径增加,由原来的5 nm左右升高至7~8 nm,样品HTL-600和HTS-600大于10 nm的孔道含量增加,而样品HTY-600大于20 nm的孔道含量增加更明显。


表1 氧化铝孔结构比表面积/(m2·g-1)孔容/(mL·g-1)平均孔径/nm可几孔径/nmY3100.6385HTL-6002870.6298HTS-6002850.5487HTY-6002760.4876
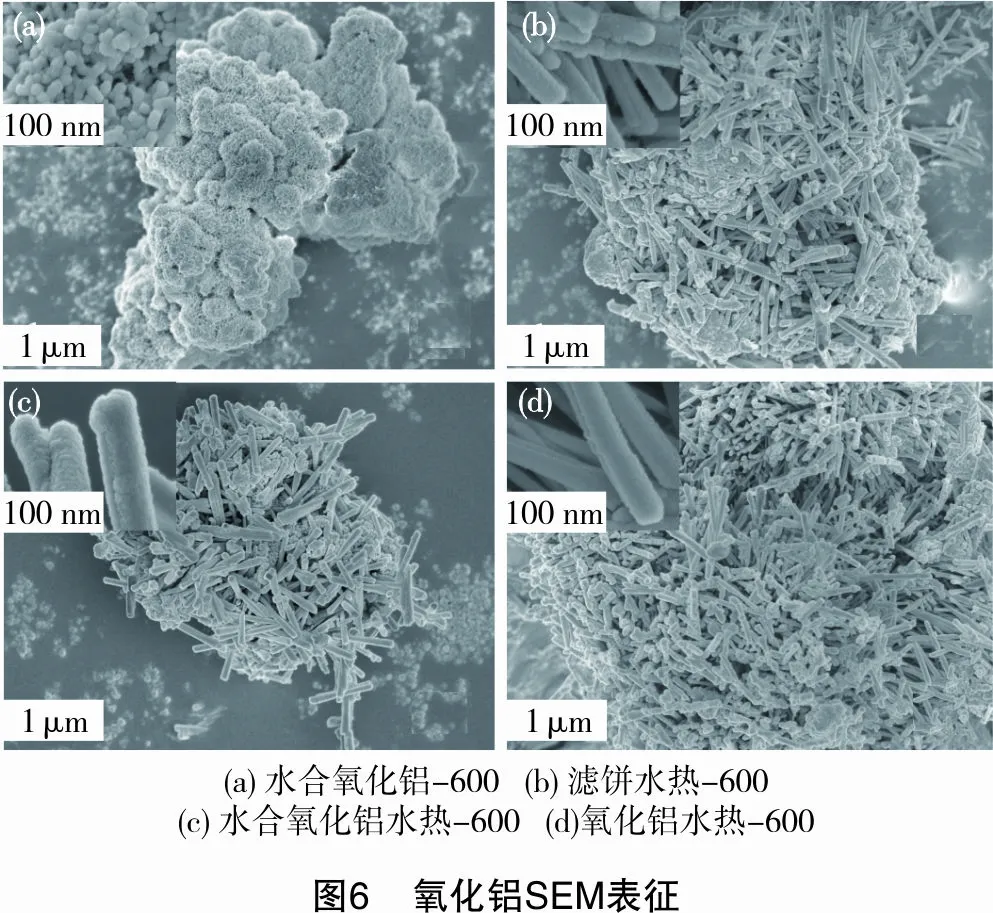
2.2.3SEM表征
氧化铝的扫描电镜表征如图6所示。从图6(a)可以看出,样品Y形貌为由蠕虫状粒子堆积而成的微米级团簇体,蠕虫状粒子由直径为50~100 nm的球形粒子构成。样品HTL-600和样品HTS-600由直径为50 nm左右、长3~10 μm的棒状氧化铝单体相互交叉构成,棒状氧化铝单体粒径均匀,表面光滑,在棒状氧化铝之间有少量球形氧化铝粒子存在,该棒状氧化铝由前体中NH4Al(OH)2CO3转变而成。而样品HTY-600几乎全部由直径为50 nm左右、长3~10 μm的棒状氧化铝单体堆积而成。
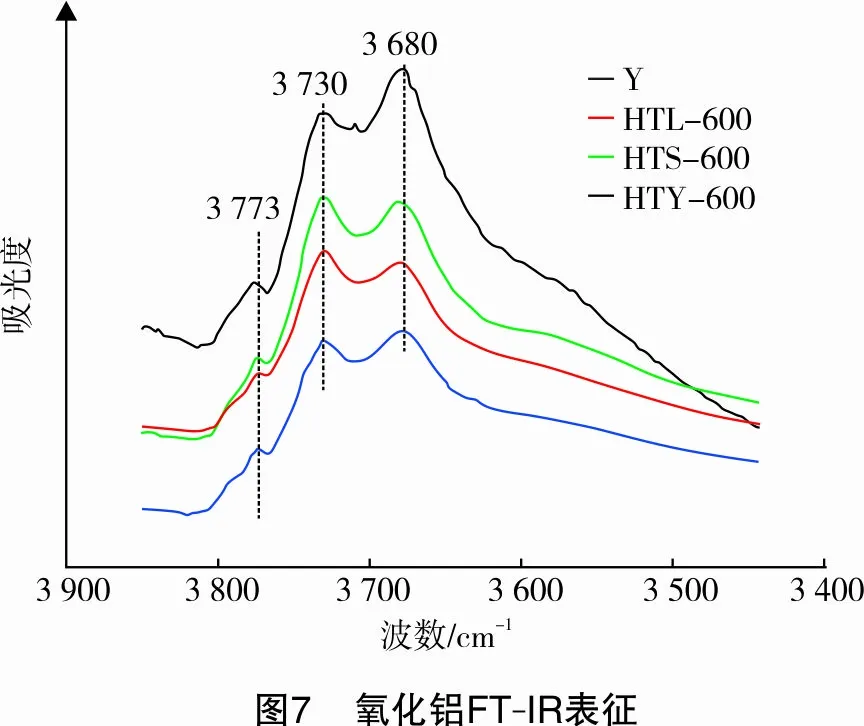
2.2.4FT-IR表征
氧化铝表面羟基结构如图7所示。从图7可以看出,4种氧化铝样品都具有3个羟基特征吸收峰,分别位于3 773 cm-1、3 730 cm-1、3 680 cm-1,其中3 773 cm-1和3 730 cm-1处的吸收峰分别归属于γ-氧化铝(111)晶面HO-μ3-AlⅥ和HO-μ2-AlⅥ吸收峰[12],而3 680 cm-1处的吸收峰归属于γ-氧化铝(110)晶面HO-μ2-AlⅥ吸收峰。但从羟基峰相对强度来看,Y氧化铝样品3 773 cm-1处羟基特征峰最弱,3 730 cm-1处特征峰次之,3 680 cm-1特征峰最强。HTL-600、HTS-600、HTY-600 3个氧化铝样品 3 773 cm-1处羟基特征峰强度变化较小,而3 730 cm-1处羟基特征峰强度增加,3 680 cm-1处羟基特征峰强度降低。氧化铝载体表面羟基类型和强度与载体表面晶面特性有关,经NH4HCO3溶液水热处理后焙烧制得的氧化铝表面羟基结构的变化与棒状结构氧化铝的生成有关,由于棒状结构氧化铝的生成使γ-氧化铝(111)晶面HO-μ2-AlⅥ吸收峰强度增加。
2.2.5吡啶吸附FT-IR表征
氧化铝表面酸量及酸强度分布可影响相应催化剂的抗积炭和抗烧结能力[13-14],4种氧化铝的吡啶吸附-脱附FT-IR谱图表征如图8所示。从图8可以看出,4种氧化铝样品在1 450 cm-1、1 490 cm-1、1 576 cm-1及1 620 cm-1处出现了L酸性特征峰[12,15],而在1 540 cm-1处未出现B酸特征峰[15],说明这4种氧化铝以L酸为主,不含有B酸。通过吡啶吸附-脱附测量样品的酸量及酸分布,酸分布结果如表2所列。从表2可以看出,氧化铝样品Y具有较高的总酸含量,且从酸强度分布看,该氧化铝弱酸含量较高。当样品经NH4HCO3水热处理后制备的氧化铝总酸含量降低,其中氧化铝样品HTL-600总酸含量降低最明显,从酸强度分布看,样品经NH4HCO3水热处理后弱酸和中强酸含量都出现降低趋势。

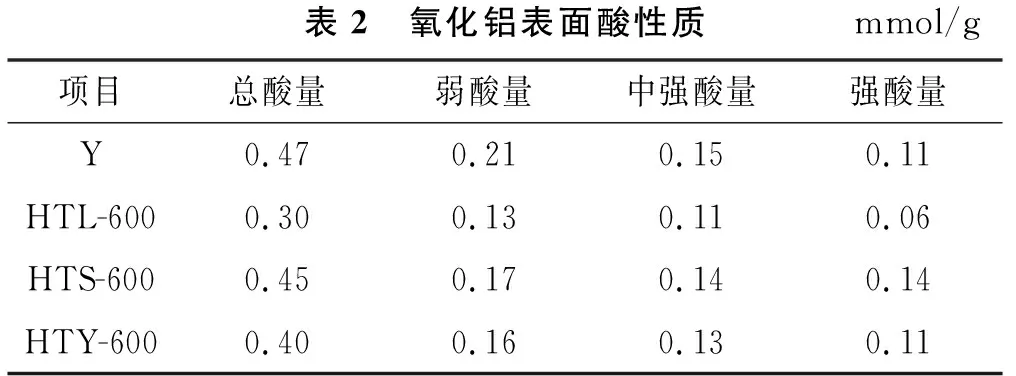
表2 氧化铝表面酸性质mmol/g项目总酸量弱酸量中强酸量强酸量Y0.470.210.150.11HTL-6000.300.130.110.06HTS-6000.450.170.140.14HTY-6000.400.160.130.11
3 结论
(1) 氧化铝制备过程中,不同阶段物料经NH4HCO3水热处理后得到的氧化铝与未经处理的氧化铝相比,其比表面积变化较小,孔容出现不同程度的降低,可几孔径提高。对滤饼进行NH4HCO3水热处理,可在小幅度降低氧化铝比表面积和孔容的情况下提高氧化铝可几孔径;而氧化铝进行NH4HCO3水热处理时,孔容降低幅度最大,大于20 nm的孔道相对含量最高。
(2) NH4HCO3水热处理可调节氧化铝表面酸性质及羟基结构,从而使氧化铝表面的总酸、弱酸及中强酸含量降低,波数为3 680 cm-1处羟基特征峰强度减弱,而波数为3 730 cm-1处羟基特征峰强度增强。
(3) 不同阶段物料经NH4HCO3水热处理后在氧化铝前体中形成NH4Al(OH)2CO3,焙烧后NH4Al(OH)2CO3转变成微米级棒状氧化铝,形成的微米级棒状氧化铝改变了氧化铝的微观结构,最终影响氧化铝孔结构及表面性质。
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

