富电子LMOF对有机农药的检测机理研究
狄玲,陈放,付荣荣,杨辰,邢杨,王晓宁
(辽宁石油化工大学化学化工与环境学部,辽宁抚顺113001)
引 言
现代农业生产很大程度上依赖农药以控制农作物昆虫、真菌、细菌及杂草等[1-2]。农药的大量施用显著地提高了农作物产量,但随着施用范围和施用量不断提高,大量的农药进入土壤、水体、大气,并对生态环境及人类健康构成危害[3-4]。基于此,农药分析检测成为了分析化学及环境检测等领域的重要研究课题[5-8]。目前利用气相色谱及高效液相色谱等检测技术可实现对环境样品中的残留农药的检测[9-12],但这些检测方法存在样品制备烦琐、耗时长、检测成本高、仪器便携性差等弊端[13]。因此,开发快速、经济、高效的有机农药检测技术是既有基础科研意义又具实际应用价值的研究课题[14]。
荧光检测法具有高灵敏度和高选择性等优点,在分子检测及荧光传感等研究领域有着广泛的应用,其核心是利用理化性质优异的荧光探针完成对分析物的定量检测[15-16]。作为性能优异的荧光探针,发光金属有机骨架(luminescent metal-organic frameworks,LMOFs)的合成简便,而且骨架结构、体系电荷及孔径可调控,能满足不同尺寸分析物分子的吸附及检测[17-22]。基于LMOFs 的荧光检测技术利用分析物与LMOFs 的相互作用引起后者发光性质变化的原理实现对分析物的检测。荧光强度或发射波长的变化与LMOFs 及分析物之间的电荷转移及能量转移密切相关,这种检测技术具有操作简便、响应速度快、灵敏度高等显著优势[23-28]。
富电子LMOFs 孔道无穿插结构、孔径灵活可控,近年来受到广泛关注[29-30]。过渡金属Zn(Ⅱ)离子构筑的LMOFs 通常具有丰富的配位构型及优异的发光性能[31-32]。本文以1 例Zn(Ⅱ)离子构筑的富电子LMOF (LMOF-a)作为荧光探针检测有机农药除草醚(nitrofen, NF)、氟乐灵(trifluralin, TFL)、百菌清(chlorothalonil,CTL)及2,6-二氯-4-硝基苯胺(DCN),通过密度泛函理论(density functional theory,DFT)计算有机配体及农药分子的前沿轨道能级、考察电子云分布,并结合光谱性质研究检测机理、计算检测效率及最低检测限,为开发新型有机农药检测技术提供实验及理论依据。
1 实验部分
1.1 试剂与仪器
三聚氯氰、2-氨基对苯二甲酸、4-氨基苯甲酸、氢氧化钠、盐酸、碳酸氢钠、丙酮、N,N-二甲基甲酰胺(DMF)、六水合硝酸锌Zn(NO3)2·6H2O 均为分析纯试剂,购于国药试剂公司;有机农药CTL、NF、TFL及DCN为分析纯试剂,购于阿拉丁试剂公司。
SMART APEX II CCD X 射线单晶衍射仪,200(2)K,钼靶Mo-Kα射线(λ=0.071073 nm),德国Bruker公司,SMART 及SAINT 程序收集衍射数据;SU8010场发射扫描电子显微镜,日本日立公司;D8 Advance PXRD 衍射仪,最大输出功率3 kW,扫描2θ为3°~50°,德国Bruker 公司;Cary G9800A 荧光光谱仪,安捷伦仪器公司,激发及发射狭缝宽度分别为10 nm 及5 nm。DFT 计算采用高性能计算化学服务平台(双路XEON E5-2686 v4,18×2 核心)。构型绘制及波函数分析GaussView 6、Multiwfn 3.6、VMD 1.9.3;DFT计算Gaussian 16 A03;泛函和基组分别为B3LYP及6-31G**。
1.2 样品制备与检测
1.2.1 LMOF-a 的合成 (1)有机配体的合成[33]:将2-氨基对苯二甲酸(5.0 mmol, 0.90 g)、NaHCO3(5.0 mmol,0.42 g)以及NaOH(10.0 mmol,0.40 g)溶于去离子水(50 ml);将三聚氯氰(2.5 mmol,0.46 g)溶于丙酮(40 ml);5°C 下将上述配制的水及丙酮溶液混合均匀,并将所得混合溶液于50°C 下搅拌反应6 h。反应液经过滤、乙醇洗涤并干燥后得中间产物(1.28 g),白色粉末,产率91.4%。将中间产物(5 mmol,2.81 g)及NaOH (20 mmol, 0.80 g)溶于去离子水(80 ml);再将4-氨基苯甲酸(5.0 mmol,0.69 g)及NaHCO3(5.0 mmol, 0.42 g)溶于上述水溶液,回流反应20 h。反应液经过滤、乙醇洗涤并酸化后,得有机配体[2.28 g, 图1(a)],为黄色粉末,产率79.6%。1H NMR(400 MHz,DMSO) δ 13.02 (s,5H)、10.81 (s,2H,)、8.09(d, 2H, J = 3.6 Hz)、7.90 (d, 4H, J = 7.8 Hz)、7.59 (d,2H, J = 3.6 Hz)、3.35 (s, 3H)。13C NMR (101 MHz,DMSO) δ 168.9、167.2、167.0、165.1、164.3、144.3、140.8、136.1、132.2、130.2、123.9、118.0。高分辨质谱(EI源):理论值574.1084,实测值574.1069。
(2) LMOF-a,(Me2NH2)[Zn2(L)]·3.5DMF 的合成:将有机配体(2.0 mmol, 11.5 mg)及Zn(NO3)2·6H2O(0.02 mmol,5.9 mg)溶于DMF/H2O (2.5 ml,体积比5∶1)混合溶剂,搅拌5 min 后将溶液转移至耐压瓶(30 ml)中,于115°C下反应24 h。将反应液冷却至室温,过滤后得到LMOF-a (12.4 mg),无色多面体单晶[图1(b)],产率61.8%。元素分析理论值[%(atom)]:C 46.14, H 4.58, N 14.68;实测值[%(atom)]:C 45.82, H 4.50,N 14.89。晶胞参数[26]:a=16.7533(3),b=17.1585(3),c=21.5052(5);α=90°,β=90°,γ=90°。
1.2.2 悬浊液的制备 将LMOF-a 于55°C 真空干燥2 h,去除客体分子,随后于室温下研磨成细粉备用;取10.0 mg LMOF-a 细粉加入10 ml 的DMF 中,超声处理5 h 后,静置1 h,重复操作3 次,形成均一稳定的悬浊液。经检验,LMOF-a 悬浊液的发光强度在0.5 h 内未见明显下降,具有可靠的稳定性,满足荧光检测要求。
1.2.3 荧光检测方法 取2.0 ml上述悬浊液加入荧光比色皿并测定初始荧光强度,随后向比色皿中加入相应浓度的有机农药,测定相应的荧光强度。激发波长为360 nm,激发/发射狭缝宽度为10/5 nm。
2 结果与讨论
2.1 晶体结构、多晶粉末衍射及红外光谱

图2为LMOF-a的PXRD 谱图、红外光谱及有机配体的红外光谱。如图2(a)所示,LMOF-a 的理论及实测PXRD 谱图衍射峰位置相符且具有尖锐的出峰峰形,表明LMOF-a具有良好纯度及结晶性。如图2(b)所示,LMOF-a 中羧基的对称伸缩振动数值为1581 cm-1、非对称伸缩振动数值为1403 cm-1、对称伸缩振动与非对称伸缩振动的差值(Δν)为178 cm-1;而1700 cm-1处无明显吸收峰,说明LMOF-a 中羧基的主要存在方式为双齿配位且无游离的羧基。
2.2 有机农药的荧光检测
图3(a)为有机农药草甘膦(GPHS)、毒死婢(CPR)、三唑磷(TZP)、CTL、NF、TFL 及DCN 的分子结构。图3(b)为LMOF-a对7种有机农药的荧光响应。
首先,向LMOF-a 悬浊液中分别加入GPHS、CPR、TZP、CTL、NF、TFL 及DCN(每种农药的浓度分别有2.0、6.0、10.0 mmol/L 三种),考察LMOF-a 对7种有机农药的荧光响应。如图3(b),随着加入浓度的提高,有机磷农药GPHS、CPR 及TZP 对LMOF-a荧光的淬灭效果不明显,而缺电子有机农药CTL、NF、TFL 及DCN 对LMOF-a 的荧光有明显的淬灭效果。加入浓度为2.0 mmol/L 时,CTL、NF、TFL 及DCN 使LMOF-a 的荧光强度相应地下降了40.4%、47.8%、95.9%及99.6%。这是由LMOF-a 的富电子骨架与缺电子有机农药的电荷转移作用导致的[26]。
图4 为LMOF-a 对有机 农药CTL、NF、TFL 及DCN 的浓度分辨荧光响应。如图4 所示,未加入有机农药时,LMOF-a 的悬浊液发射强烈的蓝色荧光,色坐标为(0.15,0.11),最大发射波长位于429 nm,荧光强度为807。随着有机农药加入量的提高,LMOF-a 的荧光强度迅速降低;向LMOF-a 悬浊液中分别加入0.10 mmol/L CTL、NF、TFL 及DCN 可使荧光强度分别降低13.8%、13.7%、25.1%及23.4%。加入3.00 mmol/L TFL,荧光强度下降达99.0%;加入2.00 mmol/L DCN,荧光强度下降达99.6%。值得注意地,加入TFL 后,LMOF-a 的最大发射波长红移至494 nm,这种红移现象可能是由TFL 的三氟甲基与有机配体的氢键(X—H…F)导致的[34]。
图5 为 有 机 农 药NF、CTL、TFL 及DCN 对LMOF-a 的荧光淬灭效率(QE)柱状图。如图5所示,选取了5 个浓度点考察了4 种有机农药对LMOF-a的QE。加入量为0.20 mmol/L 时,CTL、NF、TFL 及DCN 对LMOF-a 的QE 分别为16.5%、20.6%、37.9%及52.2%。随着加入量的提高,4 种有机农药对LMOF-a的QE逐渐提高,当加入量达到1.00 mmol/L时,CTL、NF、TFL 及DCN 对LMOF-a 的QE 分别达33.2%、36.2%、85.8% 及94.9%。4 种有机农药对LMOF-a 荧光淬灭效率的顺序为:DCN>TFL>NF>CTL。
2.3 密度泛函理论计算

图1 有机配体的结构(a);LMOF-a的扫描电镜图(b);LMOF-a中双核Zn(Ⅱ)(c)、有机配体(d)的配位环境;LMOF-a的拓扑结构(e)Fig.1 Structure of organic ligand(a);SEM image of LMOF-a(b);the coordination environments of binuclear Zn(Ⅱ)center(c)and the organic ligand(d)in LMOF-a;topological structure of LMOF-a(e)
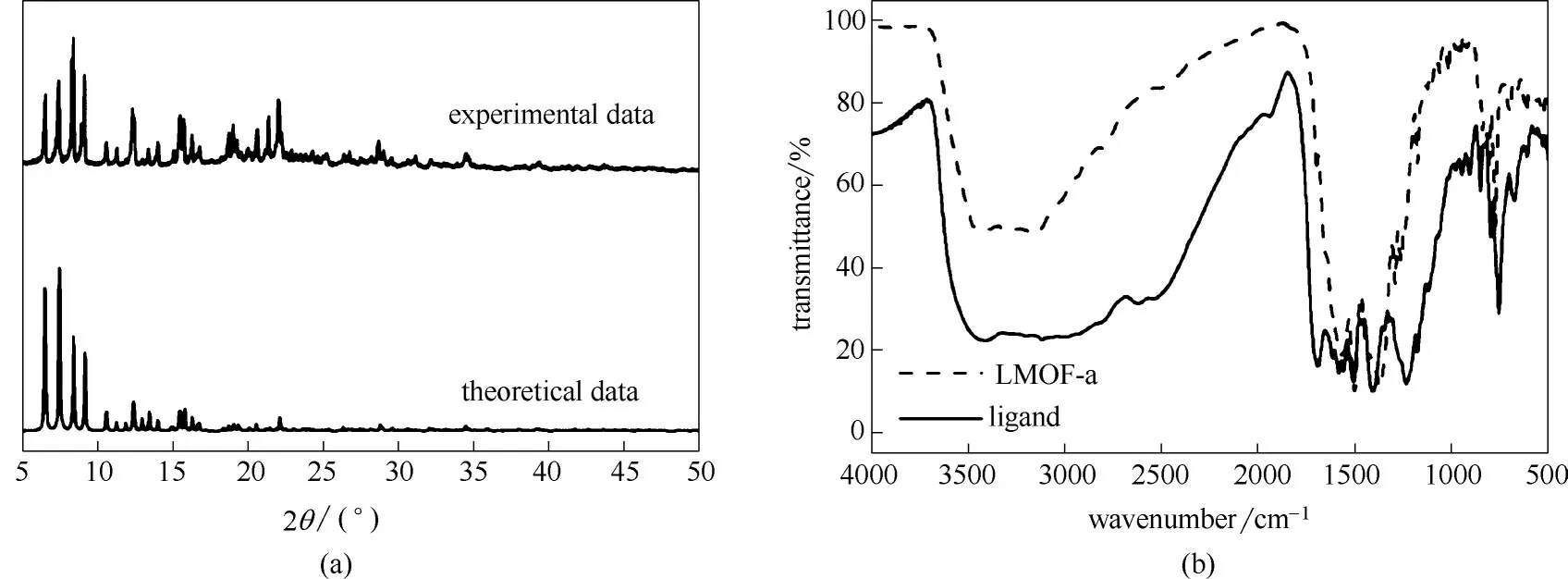
图2 LMOF-a的理论及实测PXRD谱图(a);有机配体及LMOF-a的红外光谱(b)Fig.2 Theoretical and experimental PXRD spectra of LMOF-a(a);FT-IR spectra of organic ligand and LMOF-a(b)
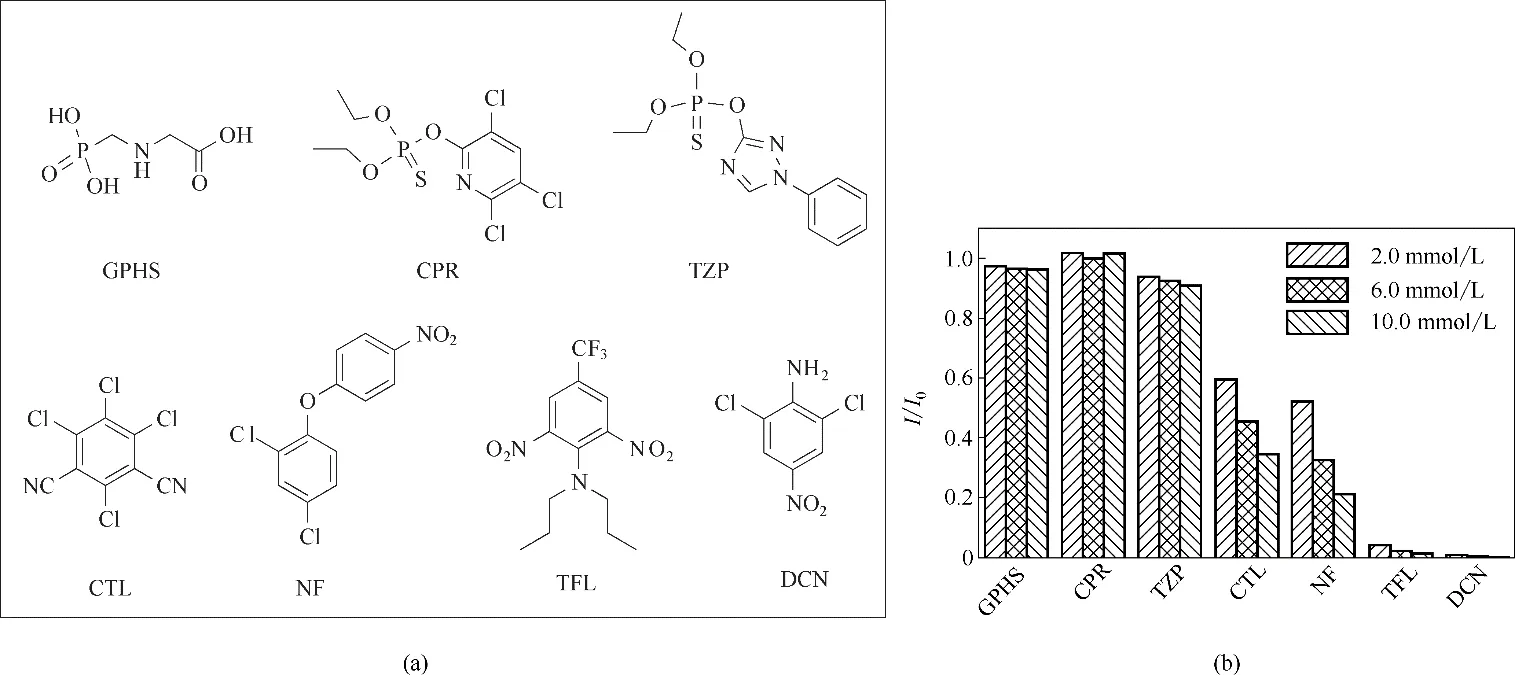
图3 有机农药GPHS、CPR、TZP、CTL、NF、TFL及DCN的结构(a);2.0、6.0及10.0 mmol/L加入浓度下LMOF-a对7种有机农药的荧光响应(b)Fig.3 Structures of organic pesticides GPHS,CPR,TZP,CTL,NF,TFL and DCN(a);fluorescent responses of LMOF-a to seven organic pesticides with addition concentration of 2.0,6.0 and 10.0 mmol/L(b)
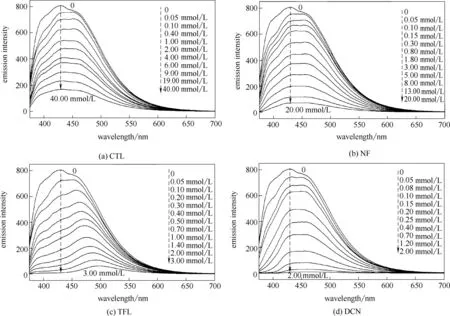
图4 LMOF-a对有机农药的浓度分辨荧光响应Fig.4 Concentration-dependent fluorescence responses of LMOF-a to organic pesticides
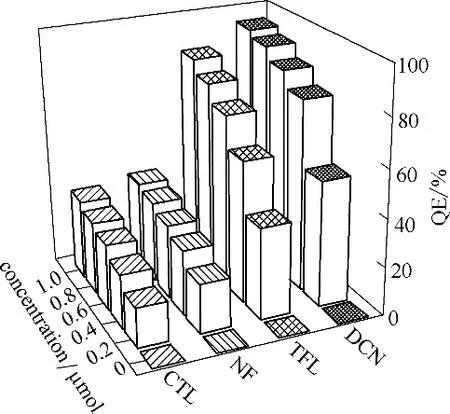
图5 有机农药NF、CTL、TFL及DCN对LMOF-a的荧光淬灭效率Fig.5 Fluorescence quenching efficiency histograms of organic pesticides NF,CTL,TFL,and DCN to LMOF-a
LMOF 吸收能量形成激发态,通过电荷转移作用,LMOF 的LUMO 与分析物的LUMO 发生电荷转移,LMOF 的激发态能量通过分析物以非辐射形式释放并导致LMOF 发生荧光淬灭[35]。通常LMOF 与分析物发生电荷转移要求分析物的LUMO能级要小于或接近LMOF 有机配体的LUMO 能级;而电荷转移程度通常由二者的LUMO能级差决定,差值越大,电荷转移程度越大[36]。通过DFT计算了有机配体及有机农药CTL、NF、TFL 及DCN 的HOMO 及LUMO能级。图6为配体及有机农药的前沿轨道数据及电子云等值面。如图6 所示,有机配体的HOMO 主要由4-氨基苯甲酸单元提供,部分由三嗪环提供,而其LUMO 主要由1 个对苯二甲酸单元提供,部分由三嗪环提供,因此配体的电荷转移跃迁形成了LMOF-a 的 激 发 态。有 机 配 体、CTL、NF、TFL 及DCN 的LUMO 能级分别为-2.327、-3.015、-2.335、-2.962 及-2.406 eV。4 种有机农药的LUMO 能级均低于有机配体,因此CTL、NF、TFL 及DCN 与LMOFa 均存在电荷转移作用。有机配体与CTL、NF、TFL及DCN 的LUMO 能级差分别为0.688、0.008、0.635及0.079 eV,因此有机配体与CTL 的电荷转移程度最大。
2.4 光谱分析
图7为有机农药CTL、NF、TFL 及DCN 的吸收光谱与LMOF-a荧光光谱的交叠。荧光共振能量转移作用(FRET)为荧光的再吸收过程。FRET 的效率通常取决于LMOF的发射光谱与分析物吸收光谱的交叠程度,交叠越大,FRET 效率越高[37]。如图7 所示,LMOF-a 的荧光光谱与有机农药CTL、TFL 及DCN的紫外/可见吸收光谱均有不同程度的交叠,而与NF 几乎无交叠,因此LMOF-a 与CTL、TFL 及DCN存在FRET 作用,而与NF 几乎不存在FRET 作用。基于以上研究,LMOF-a 对CTL、TFL 及DCN 的检测机理同时包括电荷转移机理及FRET 机理;而对NF的检测机理为电荷转移机理。
2.5 LMOF-a对有机农药的检测效率
LMOF 的荧光淬灭属于动态淬灭过程。Stern-Volmer 方程[式(1)]可用于拟合实验数据并计算检测效率[38]。
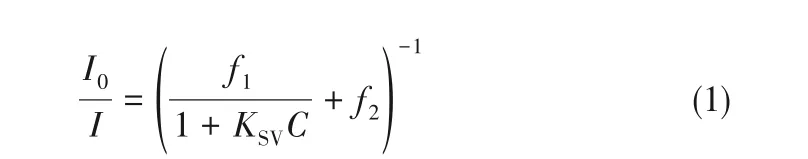
式中,I0为LMOF-a的初始荧光强度;I为加入相应浓度有机农药后的荧光强度;f1及f2为拟合曲线的线性分布,用来描绘曲线的弯曲程度,f1+f2=1;C为有机农药的浓度,mmol/L;KSV为LMOF-a 对有机农药的检测效率,L/mmol。
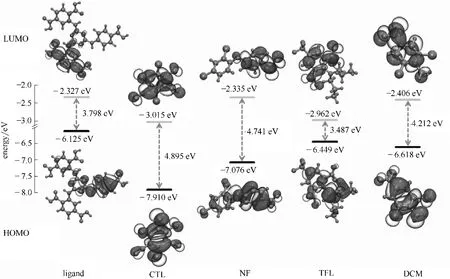
图6 配体及有机农药的电子云等值面分布(0.02 a.u.)及前沿分子轨道能级(1 a.u.=27.2114 eV)Fig.6 Electron density isosurfaces(0.02 a.u.)and energy levels of frontier molecular orbitals of the ligand and organic pesticides

图7 有机农药CTL、NF、TFL及DCN的紫外可见光谱与LMOF-a的荧光光谱的交叠Fig.7 Overlaps between UV-vis spectra of organic pesticides CTL,NF,TFL,DCN and fluorescent spectrum of LMOF-a
根据式(1)得到LMOF-a 对有机农药CTL、NF、TFL 及DCN 的KSV值 分 别 为(0.322±0.035) L/mmol、(0.335±0.015 )L/mmol、(3.025±0.156) L/mmol 及(4.778±0.590) L/mmol。LMOF-a 对4 种有机农药检测效率顺序为:DCN>TFL>NF>CTL。因此,LMOF-a对DCN 具有最高的检测效率(图8 及表1)。上述计算结果与前沿轨道能级的计算结果(图6)不完全吻合,这可能是由于DCN 的分子直径(9.6 Å)小于CTL(10.4 Å)、NF (14.6 Å)及TFL (13.4 Å),导致DCN 更易被LMOF-a 的孔道(21.3 Å×13.4 Å)所富集,从而提高了检测效率。
利用式(2)计算LMOF-a 对4 种有机农药的检测限[39]。
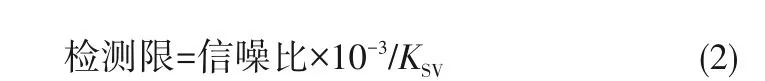
式中,信噪比为20lg(U1/U0),其中U1和U0分别为信号振幅及噪声振幅,数值分别为807 及0.3。因此LMOF-a 对CTL、NF、DCN 及TFL 的检测限分别为0.213、0.205、0.023 及0.014 mmol/L,LMOF-a 对DCN具有最低的检测限。综上,与利用气相色谱及高效液相色谱的有机农药检测技术相比,利用LMOF-a开发的荧光检测技术可实现对有机农药CTL、NF、DCN 及TFL 的高效检测,并且具有样品制备过程简便、耗时短、检测成本低廉的优势并展现出优异的实际应用价值。
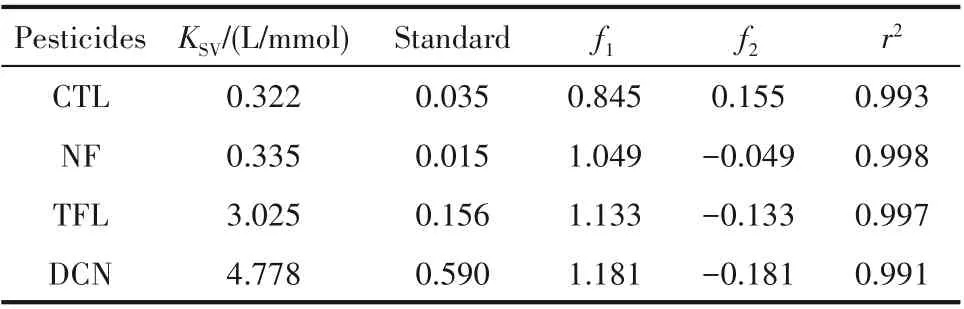
表1 LMOF-a检测有机农药的拟合参数Table 1 Fitting parameters for organic pesticides detection by LMOF-a
3 结 论
采用水热法合成了1例蓝光富电子金属有机骨架LMOF-a,并将其作为荧光探针用于检测有机农药除草醚(NF)、氟乐灵(TFL)、百菌清(CTL)及2,6-二氯-4-硝基苯胺(DCN)并研究检测机理。研究表明:(1) LMOF-a 对TFL、CTL 及DCN 的检测机理同时包括电荷转移机理及荧光共振能量转移机理,而对NF的检测机理为电荷转移机理。(2) LMOF-a 对DCN具有最高的检测效率,KSV达(4.778±0.590) L/mmol,检测限低至0.014 mmol/L。本研究为研发有机农药荧光检测技术提供理论指导及实验设计参考。

图8 LMOF-a荧光检测有机农药NF、CTL、TFL及DCN的Stern-Volmer曲线Fig.8 Stern-Volmer plots of LMOF-a for fluorescent detection of organic pesticides NF,CTL,TFL and DCN

