肠靶向海藻酸钙基微胶囊的制备及控释性能研究
温霜,巨晓洁,2,谢锐,2,汪伟,2,刘壮,2,褚良银,2
(1 四川大学化学工程学院,四川成都610065; 2 四川大学高分子材料工程国家重点实验室,四川成都610065)
引 言
口服肠靶向给药控释系统可以保护药物在胃内完整,进入小肠后再按照设定的要求释放药物,从而发挥局部或全身治疗作用,具有广泛的临床应用价值[1-6]。一方面,肠靶向控释可以降低药物对胃部的刺激,对胃起到保护作用;或是保护稳定性较差的药物(如不耐酸性以及蛋白类药物)在胃内不失活,提高药物疗效。另一方面,由于小肠是口服给药时药物的主要吸收部位,直接将药物靶向递送至肠部,可以提高药效、降低用药剂量;而且针对肠部疾病在病理区域直接释放药物,可以提高局部药物浓度。具有控释特性的口服肠靶向缓释制剂可以控制药物释放的速率和时间,实现药物的持久释放,具有提高药物安全性和有效性,减少用药频率的优势,对肠部疾病的治疗起到重要作用,因此受到了广泛关注[7-11]。目前临床使用的口服肠靶向缓控释制剂大多数是基于药物扩散机制设计的骨架型和贮库型制剂,常见的剂型主要有片剂、丸剂和胶囊剂等,其中骨架型制剂主要通过骨架材料的逐渐溶蚀控制药物的释放,贮库型制剂主要是薄膜包衣型制剂,主要通过包衣膜控制药物的释放。但是这些传统肠靶向制剂的制备工艺复杂,且不易吞服、释药过程可控性较差。通过微胶囊技术将药物包封制备成可供口服的微型胶囊,可以屏蔽药物不良气味、增加药物的稳定性、提高药物生物利用度,并且药物的释放过程更具可控性,是一种新型的、较理想的药物控释制剂[12-13]。因此,开发具有控释特性的口服肠靶向微胶囊给药系统,具有较为重要的科学研究价值和良好的临床应用前景。
目前,在肠靶向微胶囊载体材料中,天然高分子多糖占据重要位置。海藻酸,是一种天然的阴离子多糖,具有成本低、来源广泛、生物相容性好、无毒无免疫原性等优点,是肠靶向载体材料的优良选择[14-22]。基于海藻酸钙的微胶囊,常用于活性物质物质封装[18]和药物靶向递送[8,23-25]等生物医药领域,成为近年来药物控释领域的研究热点[8,26-27]。例如,Mei 等[14,20]通过毛细管共挤出装置结合生物硅化技术,制备了一种可供口服的毫米级海藻酸钙/精蛋白/二氧化硅微胶囊,并进一步在胶囊表面修饰聚甲基丙烯酸,使其具有良好的pH 响应性能,实现了维生素B12分子在不同pH 条件下的控制释放。Zhang等[26]用海藻酸钠和乳清蛋白制成微胶囊,将疏水性药物香芹酚通过口服给药靶向递送至猪肠道中,减少了药物在胃部的吸收。但这类海藻酸钙基微胶囊在肠部pH 条件下,囊壁稳定性差,易发生快速溶解[14,20],释药时间短[26],极易造成药物突释,出现血药的“峰-谷”现象,影响疗效。因此,研制开发在肠部具有良好稳定性的肠靶向海藻酸钙基微胶囊以实现药物在肠部的缓释是十分具有研究意义的。
基于此,本文利用实验室自制的毛细管共挤出装置[18]结合静电吸附和仿生硅化的方法[14,20,28],研制了一种可用于药物缓释的肠靶向海藻酸钙基复合微胶囊。利用壳聚糖进行复凝聚,提高了微胶囊在肠部pH 条件下的稳定性[8,17,29-30]。而后通过仿生硅化的方法来抑制微胶囊的溶胀行为,得到的海藻酸钙-壳聚糖/精蛋白/二氧化硅(ACPSi)复合微胶囊,其囊膜具有pH 响应渗透性能,通过在囊壁中嵌入pH响应的肠溶微球作为“微阀门”,以更好地控制药物的释放速率。
1 实验材料和方法
1.1 材料
海藻酸钠(Na-Alg,分析纯)、壳聚糖(纯度>99.9%)、硝酸钙(Ca(NO3)2)、羧甲基纤维素钠(CMC,分析纯)、醋酸(分析纯)、硅 酸钠(Na2SiO3)、浓盐 酸(纯度>99.0%)、氢氧化钠(NaOH)、无水乙醇(分析纯)、二氯甲烷(分析纯)、十二烷基硫酸钠(SDS)、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4),均购自成都市科龙化工试剂厂;硫酸鱼精蛋白(P4380),购自Sigma-Aldrich 试剂公司;吲哚美辛(纯度>99%),购自阿拉丁试剂公司;羟丙甲基纤维素邻苯二甲酸酯(HPMCP,31%(质量)),购自麦克林试剂公司;实验用水为双重去离子水(>18.2 Ω)。
1.2 分析测试仪器
毛细管共挤出装置,自制;注射泵(LSP01-2A型),保定兰格恒流泵有限公司;数码相机(SELP1650型),日本索尼公司;扫描电子显微镜(SEM,TM3030型),日立高新技术公司;万能测试机(EZ-LX 型)、紫外分光光度计(UV-1800 型),日本岛津公司;往复式水浴恒温振荡器(SHZ-B 型),上海跃进医疗器械有限公司;离心机(GK-20G-C型),上海飞鸽有限公司;真空冷冻干燥机(FD-1C-50 型),北京博医康实验仪器有限公司;电子分析天平(FA-2004 型,精度为0.01 mg),上海良平仪器仪表有限公司;纯水系统(Millipore Elix-10型),Millipore公司。
1.3 制备原理
首先,采用毛细管共挤出技术和复凝聚法制备海藻酸钙-壳聚糖(AC)微胶囊[图1(a)、(b)]。在酸性水环境中,壳聚糖带正电荷、海藻酸带负电荷,带有相反电荷的这两种多糖通过静电作用与钙离子反应形成海藻酸钙-壳聚糖聚电解质复合物,可以提高海藻酸钙囊壁在较高pH 条件下的稳定性[8,17,29-30]。然后,AC 微胶囊[图1(b)、(e)]通过静电作用吸附精蛋白,制得海藻酸钙-壳聚糖/精蛋白(ACP)微胶囊[图1(c)、(f)];最后,在精蛋白的调控下与硅酸钠反应,得到海藻酸钙-壳聚糖/精蛋白/二氧化硅(ACPSi)复合微胶囊[图1(d)、(g)]。仿生硅化可以进一步提高微胶囊的力学性能,抑制其在肠液pH 环境中的的溶胀行为[28]。其中,海藻酸和精蛋白分子间在不同pH 环境中的静电相互作用使囊膜渗透性能具有pH 响应特性:在胃液pH 条件下,精蛋白分子间由于静电排斥作用分散在海藻酸钙凝胶网络中,囊膜扩散渗透率低,囊壁为药物提供保护作用,微胶囊内负载的吲哚美辛不被释放;而在肠液pH 条件下,精蛋白分子由于与海藻酸钙分子间的静电吸附作用被吸附到海藻酸钙凝胶网络上,微胶囊扩散渗透率增大,吲哚美辛缓慢释放,从而实现微胶囊的肠靶向药物递送和控释性能。并且通过在囊壁中嵌入肠溶微球作为“微阀门”,利用肠溶微球在肠部pH 条件下的溶解特性,为药物释放提供更多“微通道”,以更好地控制药物的释放速率。
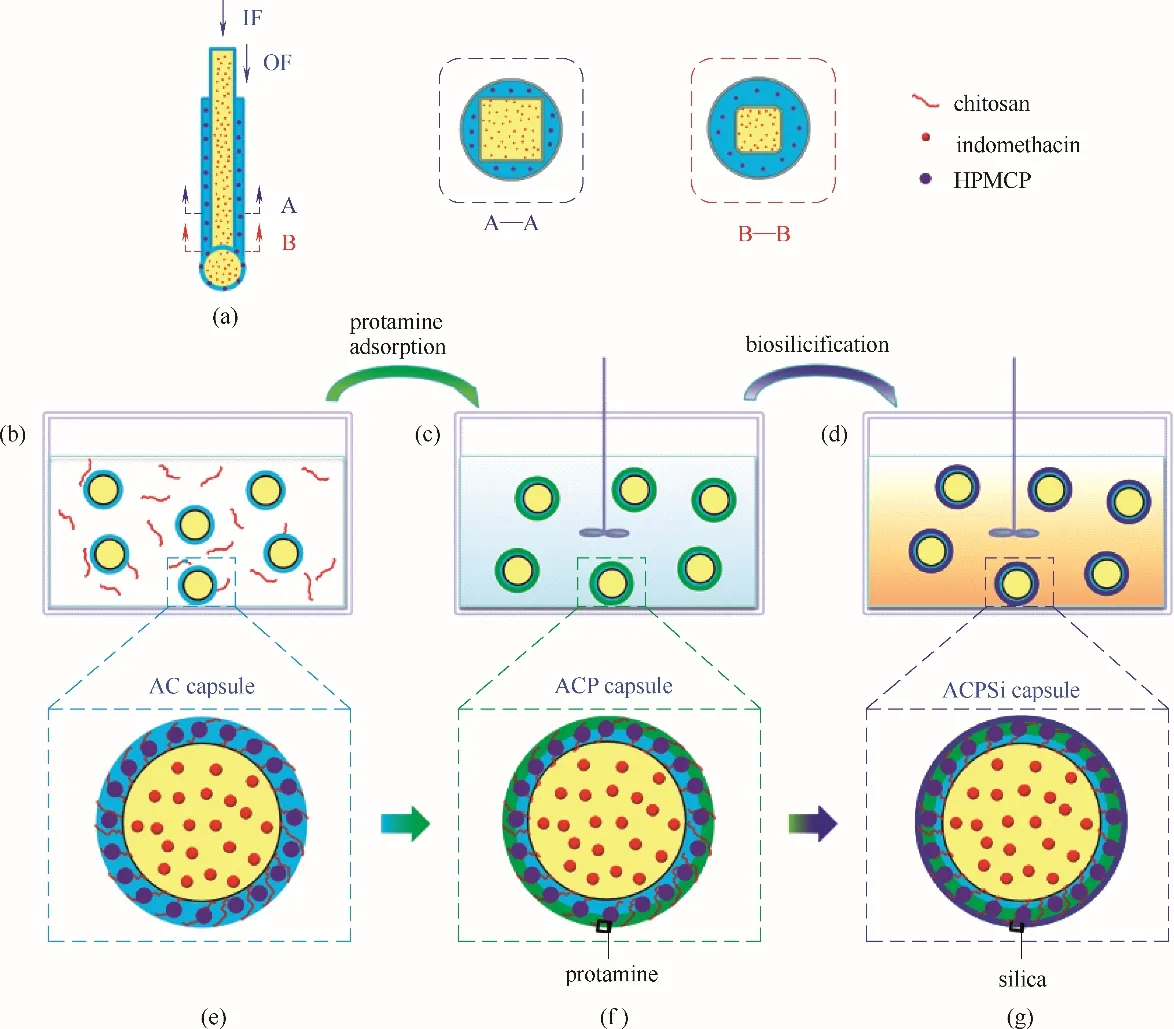
图1 利用毛细管共挤出装置制备ACPSi复合微胶囊的示意图Fig.1 Schematic illustration of the process for preparation of Ca-alginate-based capsules by co-extrusion device
1.4 肠溶微球的制备与表征
肠溶微球是利用自制的微流控装置结合乳化溶剂扩散法制备的。内相流体(IF):称取0.14 g HPMCP 溶于20 ml 二氯甲烷与乙醇的混合溶剂(9∶1,体积比)中,溶解制得油相,流速为500 μl/h。外相流体(OF):含有0.6%(质量) SDS 的水溶液,流速为1400 μl/h。接收液为去离子水,制备过程中每1 h换一次接收液。待微球完全反应成形后,用少量去离子水洗涤三次,60°C 下干燥6 h 后得到干燥肠溶微球。
利用光学显微镜观察微球形态,利用SEM 观察肠溶微球的微观结构。为验证微球的肠溶特性,将一定量的干燥微球分别分散于pH 2.5和pH 6.8的磷酸缓冲液中,在光学显微镜下观察微球在不同pH条件下形态和粒径随时间的变化。
1.5 肠靶向ACPSi复合微胶囊的制备
基于毛细管共挤出技术结合静电吸附和仿生硅化的方法,制备ACPSi复合微胶囊。首先,利用毛细管共挤出装置制备AC 微胶囊。IF 为1%(质量)的CMC 水溶液,流速为20 ml/h;OF 为含有2%(质量)Na-Alg 和0.2%(质量) SDS 的水溶液,流速为15 ml/h;内外相流体通过共挤出装置逐滴滴入含有10%(质量) Ca(NO3)2和0.2%(质量)壳聚糖的1%(体积)醋酸水溶液中,装置管口距液面高度约5 cm。液滴滴入接收液数秒后即形成AC 微胶囊。然后,将AC 微胶囊加入到浓度为2 mg/ml 的硫酸鱼精蛋白水溶液中,以200 r/min 速度机械搅拌30 min,带正电的精蛋白分子被吸附在带负电的海藻酸钙凝胶网络中,得到ACP 微胶囊。最后在相同搅拌速度下,将ACP微胶囊转移到由0.2 mol/L 冰醋酸溶液配制的浓度为60 mmol/L 的硅酸钠溶液中,此时硅酸钠呈电负性,和微胶囊表面带正电的精蛋白分子发生静电吸附,机械搅拌1 h 后制备得到ACPSi 复合微胶囊,用0.2 mol/L 的冰醋酸溶液洗涤三次后于4°C 条件下保存备用。通过在IF 中加入模型药物,可以制备得到包载药物的ACPSi复合微胶囊;通过在OF中加入肠溶微球,可以制备得到囊壁嵌有肠溶微球的ACPSi复合微胶囊。
1.6 肠靶向ACPSi复合微胶囊的结构表征
利用SEM 对冻干后的ACPSi 复合微胶囊的微观结构进行表征;利用数码相机拍照对ACPSi 复合微胶囊的整体外观形貌进行表征,并利用统计分析软件计算微胶囊的平均粒径,并根据式(1)计算粒径偏差系数(CV)值

式中,Di为第i 个微胶囊的直径;N 为微胶囊的个数为微胶囊直径的平均值。
1.7 肠靶向ACPSi复合微胶囊的稳定性能研究
利用万能材料测试机对硅化前后的ACP 微胶囊和ACPSi 微胶囊进行抗压实验,研究微胶囊在受到挤压直到囊壁破损的这一过程中应力应变的变化规律,从而研究复合微胶囊的抗压性能。将ACPSi 复合微胶囊置于pH 2.5 的磷酸缓冲液中,3 h后,将其转移到pH 6.8 的磷酸缓冲液中,期间定时用数码相机拍照,并用统计分析软件计算微胶囊在不同时刻的粒径变化,从而分析微胶囊在不同pH缓冲溶液中的溶胀性能。
ACPSi复合微胶囊拟贮存于0.2 mol/L 的醋酸溶液中,探索其保存方法可靠性。将制备得到的ACPSi载药微胶囊随机分为4组,每组10颗微胶囊,取其中一组试管测量单颗微胶囊初始含药量的平均值,将剩余3 组分别保存于0.2 mol/L 的醋酸溶液中,于0、7、14、21、28 d 定期测量各组试管中微胶囊的释药量,并计算单颗微胶囊的平均释药量,根据单颗微胶囊的初始含药量(m0)和时间点i 的释药量(mi),由式(2)计算时间点i 时微胶囊含药量的变化率(Ri)

1.8 肠靶向ACPSi复合微胶囊的肠靶向性能研究
本实验选择吲哚美辛作为模型药物。吲哚美辛难溶于水,具有抗炎和解热镇痛的功效,可用于肠部疾病如肠炎和肠癌的治疗,但用药过程中常伴有副反应的发生,对胃有强刺激性,且体内半衰期短,需要频繁服药。因此利用肠靶向缓释载体可以减少吲哚美辛的服用频率,提高药效,同时保护胃部不受药物刺激。
将吲哚美辛包封于微胶囊的囊芯中,分别以pH 2.5 和pH 6.8 的磷酸缓冲液来模拟胃液和肠液,研究ACPSi复合微胶囊的肠靶向药物控释性能。配制吲哚美辛浓度分别为2 mg/ml 和22.5 mg/ml 的混悬液作为内相流体,并含有1%(质量)的CMC,其他实验步骤同1.4节,制备具有不同载药浓度的ACPSi复合微胶囊。对两种载药浓度的ACPSi微胶囊分别在模拟胃液和模拟肠液中进行释药实验。37°C 条件下,将ACPSi 载药微胶囊随机分成3 组,每组15颗,分别置于pH 2.5 的磷酸缓冲液中释药3 h,再分别转移到pH 6.8 的磷酸缓冲液中释药19 h,不同时间取上清液1 ml 用紫外分光光度计测定其药物浓度,测完再将上清液倒回释药瓶中;最后,释药结束将所有微胶囊进行机械破坏,在pH 6.8 的磷酸缓冲液和乙醇1∶1 混合液中超声30 min,以保证药物全部释放,8000 r/min 离心10 min 后,测上清液中药物的浓度,计算药物累计释放率。
2 实验结果与讨论
2.1 肠靶向ACPSi复合微胶囊的可控制备与表征
2.1.1 肠靶向ACPSi 复合微胶囊的形态分析 AC载药微胶囊如图2(a)、(b)所示,囊壁透明,囊芯由于载有吲哚美辛呈现白色,微胶囊粒径均一,球形度良好。ACPSi 载药复合微胶囊如图2(c)、(d)所示,此时囊壁由于硅化作用由透明变为白色,ACPSi 复合微胶囊同样具有良好的单分散性,并保持着良好的球形度。图2(e)、(f)分别是两种微胶囊的粒径分布,AC 微胶囊和ACPSi 复合微胶囊平均直径分别约为3.20 和3.18 mm,为毫米级尺寸,便于口服,经计算AC 微胶囊和ACPSi 复合微胶囊的CV 值分别为1.49%和1.63%,进一步充分说明所制备的微胶囊粒径均一、单分散性好。本研究中复合微胶囊的制备过程具有良好的稳定性:①复凝聚过程中,海藻酸与钙离子的交联反应在数秒内即可完成,交联反应迅速;②精蛋白分子通过静电吸附作用吸附在微胶囊的表面,最后通过仿生硅化的方法使得硅酸钠在精蛋白表面缩聚形成二氧化硅壳层,这两步连续操作的条件温和、反应时间短、过程简单,制备得到的复合微胶囊球形度良好。③毛细管共挤出技术属于液滴微流控技术,由于对流体精确的操控能力,所制备液滴模板尺寸精确可控、尺寸均一,微胶囊的制备亦具有良好的可重复性。

图2 AC微胶囊与ACPSi微胶囊的光学照片[(a)~(d)]与粒径分布图[(e)、(f)]Fig.2 Optical photos((a)—(d))and size distributions((e),(f))of AC capsules and ACPSi capsules
2.1.2 肠靶向ACPSi复合微胶囊的形貌分析 ACPSi复合微胶囊的表面和断面的SEM 图如图3。ACPSi复合微胶囊表面光滑,具有良好的球形度。将ACPSi复合微胶囊机械切开,可以看到,囊内部具有较大空腔[图3(b)],可用来封装药物或其他活性成分。由复合微胶囊的断面SEM 图[图3(c)]可以观察到,微胶囊的囊壁主要有两层组成,最外层是二氧化硅坚硬壳层,内层主要是海藻酸钙-壳聚糖复合壳层。由囊壁的能谱分析中可以证实[图3(d)]Si 元素以及N 元素的存在,其中C、O、N 元素较多,可以间接说明硅化成功。

图3 ACPSi微胶囊的SEM图[(a)~(c)]和EDX分析(d)Fig.3 SEM images((a)—(c))and EDX spectra(d)of ACSPSi capsule
2.2 肠溶微球的形貌分析与肠溶性能研究
肠溶微球的制备过程中,内相油相中的乙醇不断向外相水相扩散,HPMCP在油相中的溶解度逐渐降低,最终形成微球析出。通过显微镜拍照后利用统计软件测定,微球的平均粒径约为52 μm。如图4(a)所示,分散在纯水中的微球具有良好的分散性,球形度良好,粒径均一。微球的SEM 图如图4(b)所示,经过干燥后的微球形状完整,表面粗糙并具有孔隙结构,这样的结构使得微球在特定pH 条件下更易溶解。
由于HPMCP 是典型的肠溶高分子,不溶于pH<5.5 的酸性溶液,但于pH 6.8 的肠液中可以快速溶解[31]。HPMCP 微球在不同pH 条件下的粒径变化如图4(c)所示,微球在pH 2.5 的缓冲液中保存180 min 后粒径基本保持不变;但置于pH 6.8 的缓冲液中,微球在5 min 内迅速溶解完全,证明了制备得到的HPMCP微球具有良好的肠溶特性。
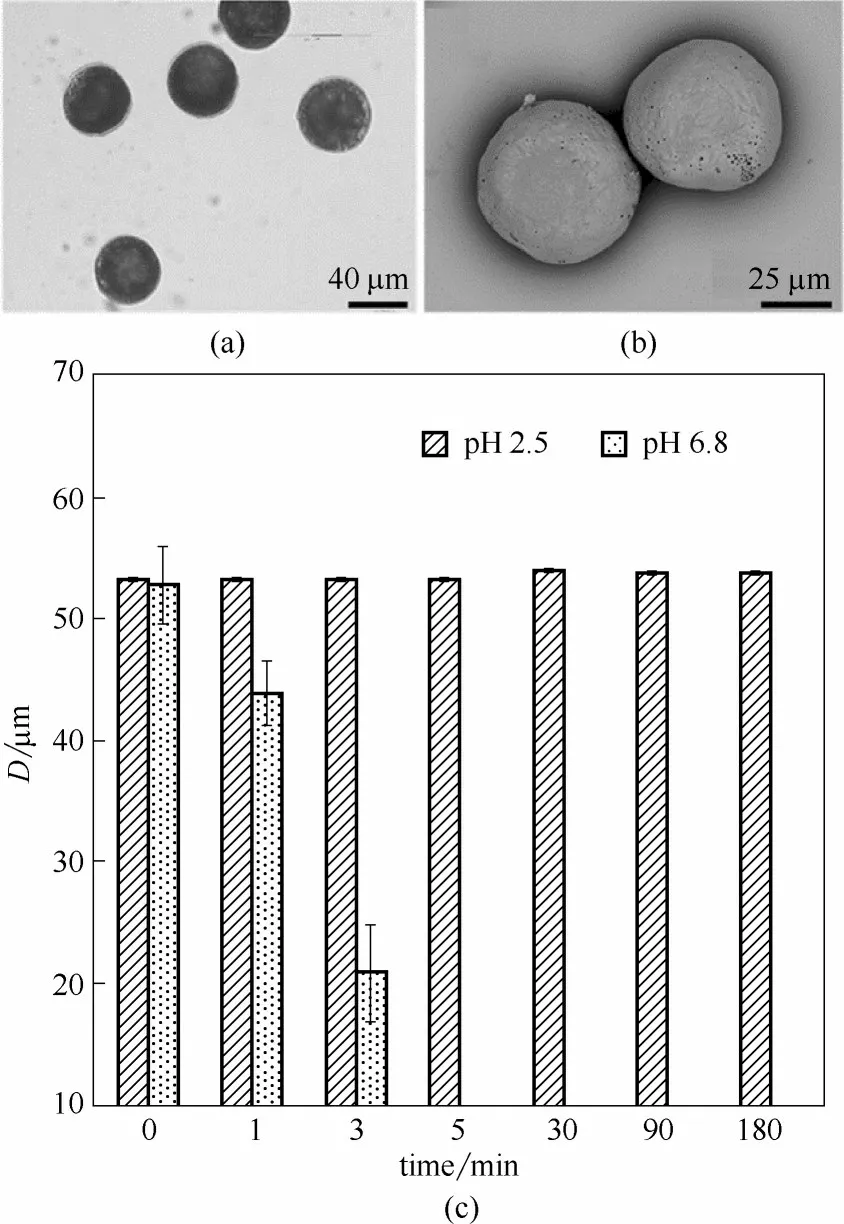
图4 HPMCP微球在纯水中的光学显微照片(a)和SEM图(b),以及HPMCP微球在pH 2.5和pH 6.8条件下的粒径变化(c)Fig.4 Microscopical photo(a)and SEM image(b)of HPMCP microspheres in pure water,and size changes of HPMCP microspheres at different pH conditions(c)
2.3 肠靶向ACPSi复合微胶囊的稳定性能研究
2.3.1 肠靶向ACPSi 复合微胶囊的抗压性能 图5(a)是AC 微胶囊和ACPSi 复合微胶囊在受压下的应力-应变曲线。随着压力的增大,微胶囊形变程度增大,应变值随之增大。当微胶囊破裂时,压力骤降至0,应变也不再继续增大,此时得到的应力和应变值即为相应条件下微胶囊所能承受的最大应力和最大应变。硅化后的ACPSi微胶囊其最大应力及应变值相对硅化前均有所降低,这是由于AC 微胶囊的囊壁为凝胶网络结构,具有较强的弹性,压力作用下的可形变程度较大;而ACPSi 复合微胶囊最外层为坚硬的二氧化硅壳层,这使得微胶囊的弹性变差,因此在受到挤压时囊的形变程度有所减小。因此,相较于AC 微胶囊,ACPSi 复合微胶囊所能承受的压力较小,在较低压力下就会发生破裂。

图5 AC微胶囊和ACPSi微胶囊受到挤压时的应力-应变曲线(a),ACPSi微胶囊开始受到挤压发生形变(b)和最终破裂(c)的照片(标尺为1 cm)Fig.5 The stress-strain curves of AC and ACPSi capsules when they are extruded(a);the photos of ACPSi capsule starts to be squeezed(b)and finally burst(c)(the scale bar is 1 cm)
2.3.2 肠靶向ACPSi复合微胶囊的溶胀性能 为研究微胶囊的溶胀性能,分别测定了AC 微胶囊和ACPSi复合微胶囊在不同pH 条件下的粒径变化,如图6 所示,相比于初始保存于0.2 mol/L 的醋酸溶液中的微胶囊,AC 微胶囊和ACPSi 复合微胶囊在pH 2.5条件下静置3 h后,粒径几乎不发生变化;而转移至pH 6.8 条件下,海藻酸钙凝胶网络由于去质子化而带负电,随着pH 升高,在静电排斥作用下会发生溶胀,12 h 后,AC 微胶囊的粒径明显增大,相比而言,硅化后的ACPSi 复合微胶囊在pH 6.8 的缓冲液中粒径只有略微增大,说明二氧化硅壳层能够有效地抑制微胶囊的溶胀,提高微胶囊的机械稳定性。
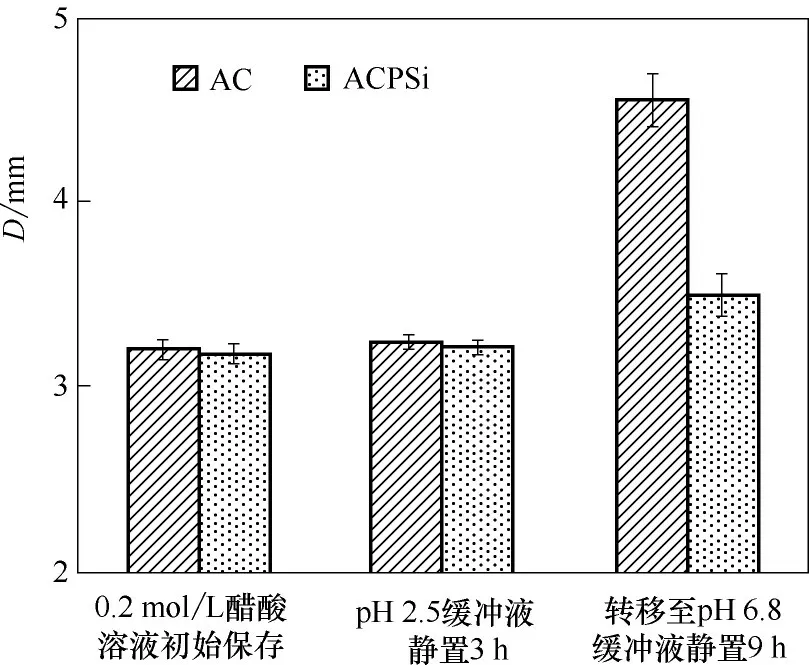
图6 AC和ACPSi微胶囊保存于0.2 mol/L醋酸溶液以及在不同pH条件下的粒径Fig.6 Sizes of AC and ACPSi capsules in 0.2 mol/L acetic acid solution and under different pH conditions
2.3.3 肠靶向ACPSi 复合微胶囊的保存 为研究ACPSi 载药微胶囊的保存方法,以0.2 mol/L 的醋酸溶液为保存介质,研究了微胶囊内负载药物的泄漏情况。图7 是载药微胶囊保存28 d 后含药量的变化,可以看出ACPSi 载药微胶囊的含药量基本保持恒定,几乎没有发生变化。由此说明,将ACPSi微胶囊保存在0.2 mol/L 的醋酸溶液中可以有效防止囊芯药物外泄。
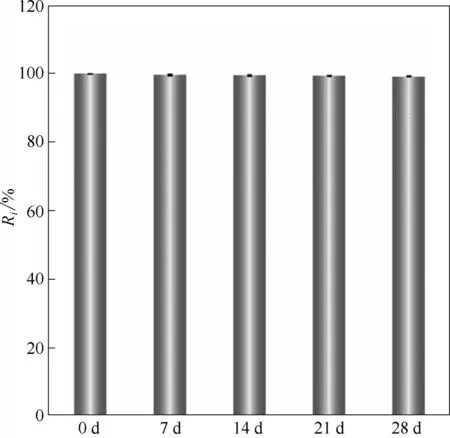
图7 ACPSi载药微胶囊保存0.2 mol/L的醋酸溶液中含药量的变化Fig.7 Changes in drug content of ACPSi capsules stored in 0.2 mol/L acetic acid solution
2.4 肠靶向ACPSi复合微胶囊的肠靶向性能研究
图8 为负载药物浓度分别为2 mg/ml和22.5 mg/ml 的ACPSi 复合微胶囊在不同pH 条件下的累计释放率随时间的变化。在pH 2.5 条件下,大量带正电的精蛋白分子排斥地分布于电中性的海藻酸钙凝胶网络空隙中,堵塞了凝胶网络中药物的扩散通道,囊壁的渗透性能较差,微胶囊几乎不释放吲哚美辛,当吲哚美辛浓度为2 mg/ml 和22.5 mg/ml 时,ACPSi复合微胶囊3 h时的累计释药率分别为2.35%和0.33%。而在pH 6.8 条件下,带正电的精蛋白分子由于静电作用被吸附到了带负电的海藻酸钙网络上,使得凝胶网络通道打开,囊壁的渗透性增强,药物容易扩散出来,释放速度加快,当吲哚美辛浓度为2 mg/ml时,转移至pH 6.8条件下的ACPSi复合微胶囊释药至22 h 时的累计释药率达到93.18%;当吲哚美辛浓度提高至22.5 mg/ml时,ACPSi复合微胶囊释药至22 h 时的累计释药率达到77.78%。可以看出,随着药物浓度的增大,药物累计释放率有所下降,这是由于微胶囊的总载药量提高了10 倍,而吲哚美辛的扩散速率受到自身溶解性质及囊壁阻力的限制,绝对释放量无法相应提高至10 倍以上,因此累计释放率有所降低。HPMCP 肠溶微球可作为控制药物的释放“微阀门”嵌入囊壁,在pH 2.5 条件下,微球稳定存在,此时“微阀门”关闭,释药速率几乎无变化;而在pH 6.8 条件下,微球快速溶解,此时“微阀门”打开,释药速率有所提高,22 h时的药物累计释放率提高了约4%。因此,利用囊壁中肠溶微球“微阀门”的开关作用,在确保药物缓释的同时,可进一步控制药物在肠部的释放速率。可以看出,该复合微胶囊具有良好的肠靶向性能和药物控释性能,作为口服肠靶向药物缓释制剂具有良好的应用前景。

图8 不同载药浓度的ACPSi微胶囊在pH 2.5和pH 6.8条件下的释药曲线(IMC代表吲哚美辛)Fig.8 Drug release curves of ACPSi capsules with different drug loading concentrations at pH 2.5 and pH 6.8(IMC is indomethacin)
3 结 论
利用毛细管共挤出装置结合复凝聚法、静电吸附作用和仿生硅化的方法,成功制备得到具有肠靶向作用和缓控释特性的ACPSi复合微胶囊。该复合微胶囊粒径均一,且具有良好的单分散性。通过比较硅化前后的AC 微胶囊和ACPSi 复合微胶囊在不同pH 条件下的粒径变化,充分证明外层二氧化硅层能够有效抑制海藻酸钙基微胶囊在pH 6.8 条件下的溶胀行为。探索了ACPSi复合微胶囊的保存方法,将其保存在0.2 mol/L 的醋酸溶液中28 d 可以有效防止囊芯药物外泄。以吲哚美辛为药物模型,探究了具有不同载药浓度的ACPSi复合微胶囊在不同pH 条件下的释药行为,当pH 为2.5 时,药物释放极少,而转移至pH 6.8 的环境时,药物可持续释放,证明ACPSi复合微胶囊可以实现对药物的肠靶向缓慢释放。通过在囊壁嵌入HPMCP 肠溶微球,提供“微阀门”作用,可控制药物在不同pH 条件下的释放速率。总之,该复合微胶囊结构可控、粒径均一,具有良好的肠靶向控释特性,可以减少药物对胃的刺激,增强药物稳定性,提高药物生物利用度;并且其制备过程简单环保、成本较低,作为口服肠靶向缓控释给药系统具有良好的临床应用前景。此外本文中肠溶微球和微胶囊的制备过程具有良好的稳定性和可控性,通过采用微通道并联的方式,可以实现液滴模板的高产量生产,具有规模化制备的前景。

