miR-1225-5p靶向调控S100A9抑制肝癌细胞增殖、迁移和侵袭的机制研究
王华忠,于 江,苏晓玲,成 薇,陈益国
(中国人民解放军联勤保障部队第九二二医院检验科,湖南衡阳 421001)
肝癌是世界范围内常见的恶性肿瘤,其发病率和病死率均较高[1]。由于肝癌患者早期无明显症状,多数患者在确诊时已处于晚期[2]。肝癌的治疗方法主要有外科手术、放疗和化疗、靶向药物治疗等,但术后易复发和转移,预后较差[3]。肝癌的发生和发展涉及多种因素,与多种基因表达失控有关[4]。从分子水平探讨肝癌发生和发展机制,对肝癌的靶向分子治疗有重要意义。微小RNA(miRNA)是一类小分子单链非编码RNA,其通过与靶mRNA的3′非翻译区(3′UTR)靶向结合抑制靶mRNA表达或降解mRNA,参与调控基因的表达,其在细胞的增殖、凋亡、迁移和侵袭等生物学行为中发挥重要作用[5]。miR-1225-5p是近年来新发现的一种miRNA,有研究显示,其参与胃癌、前列腺癌、乳腺癌等肿瘤细胞的增殖、迁移、凋亡等[6-8],与肿瘤的发生和发展密切相关。但目前miR-1225-5p对肝癌细胞生物学行为的影响还未知。生物信息学软件预测显示,S100钙结合蛋白A9(S100A9)的3′UTR中含有与miR-1225-5p互补的核苷酸序列,提示S100A9是miR-1225-5p的靶基因。S100A9是钙结合蛋白S100蛋白家族成员之一,参与细胞生长、分化、凋亡、炎性反应等生命活动。有研究显示,S100A9在肝癌患者血清和细胞中表达水平升高,其可促进肝癌细胞的存活和侵袭[9-10]。本研究主要探讨miR-1225-5p对肝癌细胞增殖、迁移和侵袭的影响,以及其是否通过调控S100A9表达发挥作用,以期为肝癌的靶向分子治疗提供一定的理论依据。
1 材料与方法
1.1细胞和试验试剂 肝癌细胞系Huh7、MHCC97H和MHCCLM3及正常肝细胞系THLE-2(中国科学院上海细胞库);胎牛血清(FBS)和RPMI 1640培养基(美国Gibco公司);四甲基噻唑蓝(MTT)和胰蛋白酶(美国Sigma公司);LipofectamineTM2000试剂盒和Trizol试剂(美国Invitrogen公司);反转录试剂盒和PCR试剂盒(日本TaKaRa公司);PCR引物(上海生工生物工程有限公司);鼠抗人细胞周期蛋白D1(CyclinD1)、p21、p27单克隆抗体(上海长岛生物技术有限公司);鼠抗人基质金属蛋白酶-2(MMP-2)、MMP-9、MMP-14单克隆抗体(北京中彬金桥生物技术有限公司);miR-1225-5p模拟物(mimics)及模拟阴性对照物、miR-1225-5p抑制剂及阴性对照和S100A9过表达载体(上海英骏生物技术有限公司);BCA蛋白测定试剂盒(上海碧云天公司);双荧光素酶活性检测试剂盒(美国Promega公司)。
1.2方法
1.2.1细胞培养 各细胞均用含10% FBS的RPMI 1640培养基置于37 ℃、5% CO2培养箱中培养。每隔2 d更换1次新鲜培养基。当细胞融合度达到80%左右时,吸弃培养基,加入适量磷酸盐缓冲液(PBS)清洗细胞,然后加入0.25%胰蛋白酶溶液消化细胞,进行传代培养。
1.2.2细胞分组和转染 对数生长期的Huh7细胞以每孔1×105个接种于6孔板中,当细胞融合度达到60%时,更换为无FBS的培养基。参照LipofectamineTM2000试剂盒操作说明执行,将miR-1225-5p mimics(miR-1225-5p组)、模拟阴性对照物(miR-NC组)、miR-1225-5p抑制剂(anti-miR-1225-5p组)、抑制剂阴性对照序列(anti-miR-NC组)、S100A9的小干扰RNA(si-S100A9组)、siRNA阴性对照(si-NC组)及miR-1225-5p mimics与S100A9过表达载体(miR-1225-5p+pcDNA-S100A9组)、miR-1225-5p mimics与空载体(miR-1225-5p+pcDNA组)分别转染至Huh7细胞。转染48 h后,采用实时荧光定量聚合酶链反应(qRT-PCR)或Western blot试验分别检测细胞中miR-1225-5p和S100A9水平并评价转染效果。
1.2.3qRT-PCR检测miR-1225-5p和S100A9 mRNA表达水平 Trizol试剂提取各组细胞中总RNA,微量核酸仪测量RNA水平及A260/A280。采用反转录试剂盒将提取的RNA反转录为cDNA,再以cDNA为模板,进行PCR扩增。PCR总反应体系为20 μL,扩增条件为95 ℃ 20 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共进行35个循环。miR-1225-5p上游引物5′-GTG GGT ACG GCC CAG TGG GGG G-3′,下游引物5′-CCC CCC ACG GGC CGT ACC CAC-3′;S100A9 上游引物5′-CGG GAT CCA TGG CTG CCA AAA CAG GA-3′,下游引物5′-GCT CTA GAT TAC TTC CCA CAG CCT TT-3′;U6上游引物5′-ACG CAA ATT CGT GAA GCG TT-3′,下游引物5′-AAC GCT TCA CGA ATT TGC GT-3′;GAPDH上游引物5′-CCA TGG AGA AGG CTG GGG-3′,下游引物5′-CAA AGT TGT CAT GGA TGA CC-3′。miR-1225-5p以U6作为内参,S100A9以GAPDH作为内参,采用2-△△Ct法计算miR-1225-5p和S100A9 mRNA的相对表达水平。
1.2.4Western blot试验检测蛋白表达 加入含蛋白酶抑制剂的蛋白裂解液,提取细胞中总蛋白。以BCA蛋白试剂盒定量后,取适量蛋白,100 ℃煮沸5 min。蛋白变性后,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,每泳道30 μg蛋白。电泳结束后,湿转至硝酸纤维素膜,5%脱脂牛奶中封闭,时间为2 h。各组分别加入一抗,4 ℃孵育过夜。再加辣根过氧化物酶标记的羊抗兔二抗IgG,室温孵育1 h。最后加入化学发光试剂,避光显影,凝胶成像系统曝光拍照。
1.2.5MTT检测Huh7细胞增殖 转染后的各组Huh7细胞,以每孔1×103个接种于96孔板中,于培养箱中分别培养24、48、72 h。每孔加入20 μL的MTT溶液(5 g/L)。于培养箱中继续培养4 h后吸弃培养基,加入150 μL二甲基亚砜。结晶紫充分溶解后,振荡混合均匀,于酶标仪490 nm处测定A值。
1.2.6Transwell检测Huh7细胞的迁移和侵袭能力 转染后的各组Huh7细胞,用不含FBS的RPMI 1640培养基调整浓度为每毫升5×104个。细胞迁移试验:Transwell上室直接加入100 μL细胞悬液,下室加入500 μL含FBS的RPMI 1640培养基,置于培养箱中培养48 h。培养结束后,经多聚甲醛固定、结晶紫染色,于倒置显微镜观察,随机选取5个视野,计数。细胞侵袭试验:将Matrigel基质胶用RPMI 1640培养基以1∶8的比例稀释,铺于Transwell上室,自然晾干后再加入100 μL细胞悬液,后续操作步骤与细胞迁移试验相同。
1.2.7双荧光素酶报告基因试验验证miR-1225-5p与S100A9的靶向关系 PCR扩增含有miR-1225-5p结合位点的S100A9的3′UTR序列,并将其插入psi-CHECK载体中,构建S100A9野生型质粒(S100A9-WT)。同时利用基因定点突变技术,将结合位点突变后,插入psi-CHECK载体,构建S100A9突变型质粒(S100A9-MUT)。分别将S100A9-WT、S100A9-MUT与miR-1225-5p mimics、模拟阴性对照物共转染至Huh7细胞。转染48 h后,收集细胞。采用细胞裂解液裂解细胞,取上清液,参照双荧光素酶活性检测试剂盒操作说明,检测各组的荧光素酶活性。
1.3统计学处理 采用SPSS22.0统计软件进行数据分析处理。多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1miR-1225-5p和S100A9在肝癌细胞和正常肝细胞中的表达水平比较 与正常肝细胞THLE-2比较,肝癌细胞系Huh7、MHCC97H和MHCCLM3中miR-1225-5p表达水平均降低,S100A9 mRNA和S100A9表达水平均升高,差异均有统计学意义(P<0.05)。选择肝癌细胞系Huh7用于后续试验,见图1。

注:A为miR-1225-5p在肝癌细胞系中的表达;B为S100A9 mRNA在肝癌细胞系中的表达;C和D为S100A9蛋白在肝癌细胞系中的表达。与正常肝细胞THLE-2比较,*P<0.05。

注:A为miR-1225-5p相对表达量;B为miR-1225-5p过表达对肝癌Huh7细胞增殖的影响;C和D为miR-1225-5p过表达对肝癌Huh7细胞增殖相关蛋白表达的影响。与miR-NC组比较,*P<0.05。
2.2miR-1225-5p过表达对肝癌Huh7细胞增殖的影响 miR-1225-5p组Huh7细胞中miR-1225-5p水平明显高于miR-NC组,差异有统计学意义(P<0.05),表明miR-1225-5p mimics转染成功,Huh7细胞中miR-1225-5p过表达。与miR-NC组比较,miR-1225-5p组Huh7细胞培养48、72 h后A值、CyclinD1水平均降低,p21和p27蛋白水平均升高,差异均有统计学意义(P<0.05)。见图2。
2.3miR-1225-5p过表达对肝癌Huh7细胞迁移和侵袭的影响 与miR-NC组比较,miR-1225-5p组Huh7细胞迁移和侵袭数量、MMP-2、MMP-9和MMP-14水平均降低,差异均有统计学意义(P<0.05)。见图3。

注:A和B为miR-1225-5p过表达对肝癌Huh7细胞迁移和侵袭的影响;C和D为miR-1225-5p过表达对肝癌Huh7细胞迁移和侵袭相关蛋白表达的影响。与miR-NC组比较,*P<0.05。
2.4下调S100A9表达对肝癌Huh7细胞增殖、迁移和侵袭的影响 si-S100A9组Huh7细胞中S100A9水平均明显低于si-NC组,差异均有统计学意义(P<0.05),表明S100A9 siRNA转染成功,Huh7细胞中S100A9表达下调。与si-NC组比较,si-S100A9组Huh7细胞培养48、72 h后A值、迁移和侵袭数量、CyclinD1、MMP-2和MMP-9水平均降低,p21蛋白水平升高,差异均有统计学意义(P<0.05)。见图4。
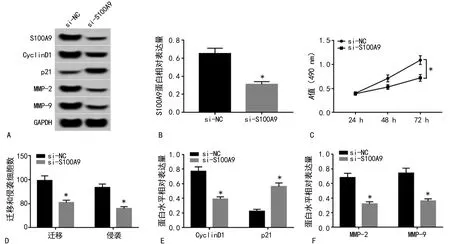
注:A为增殖、迁移和侵袭相关蛋白表达情况;B为S100A9相对表达量;C为下调S100A9表达对肝癌Huh7细胞增殖的影响;D为下调S100A9表达对肝癌Huh7细胞迁移和侵袭的影响;E为下调S100A9表达对肝癌Huh7细胞增殖相关蛋白表达水平的影响;F为下调S100A9表达对肝癌Huh7细胞迁移和侵袭相关蛋白表达的影响。与si-NC组比较,*P<0.05。
2.5miR-1225-5p靶向调控S100A9的表达 生物信息学软件预测显示,S100A9的3′UTR中含有与miR-1225-5p互补的核苷酸序列。双荧光素酶活性检测结果显示,miR-1225-5p mimics可降低S100A9的3′UTR野生型质粒荧光素酶活性(P<0.05),而对S100A9的3′UTR突变型质粒荧光素酶活性物无明显影响(P>0.05),说明miR-1225-5p可与S100A9的3′UTR靶向结合。Western blot试验检测结果显示,miR-1225-5p组S100A9水平低于miR-NC组,差异有统计学意义(P<0.05),anti-miR-1225-5p组S100A9水平高于anti-miR-NC组,差异有统计学意义(P<0.05),进一步说明miR-1225-5p在Huh7细胞中负调控S100A9的表达。见图5。
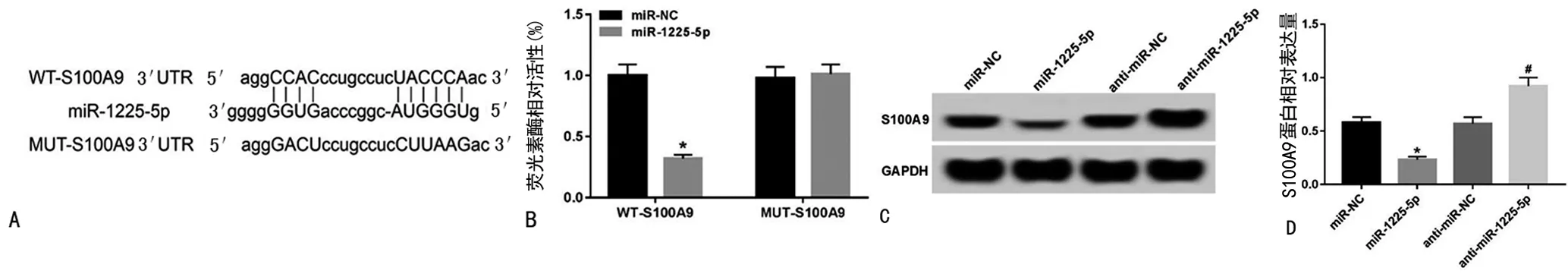
注:A为S100A9的3′UTR中含有与miR-1225-5p互补的核苷酸序列;B为双荧光素酶报告试验;C和D为miR-1225-5p对S100A9表达的影响。与miR-NC组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05。
2.6S100A9过表达逆转了miR-1225-5p过表达对肝癌Huh7细胞增殖、迁移和侵袭作用 与miR-1225-5p+pcDNA组比较,miR-1225-5p+pcDNA-S100A9组Huh7细胞培养48、72 h后A值、迁移和侵袭细胞数量、CyclinD1、MMP-2和MMP-9水平均升高,p21蛋白水平降低,差异均有统计学意义(P<0.05)。见图6。

注:A为免疫印迹图;B为S100A9蛋白相对表达量;C和D为S100A9过表达逆转了miR-1225-5p过表达对肝癌Huh7细胞增殖、迁移和侵袭作用;E和F为S100A9过表达逆转了miR-1225-5p过表达对肝癌Huh7细胞增殖,迁移和侵袭相关蛋白表达的作用。与miR-NC组比较,*P<0.05;与miR-1225-5p+pcDNA组比较,#P<0.05。
3 讨 论
miRNA是一类长度为18~25个核苷酸的小分子RNA,广泛存在于真核生物体中,其表达与肿瘤、心脑血管疾病等密切相关,可作为疾病诊断和治疗的靶向指标[11-12]。随着对miRNA的深入研究发现,miR-1225-5p与肿瘤的发生和发展密切相关。WANG等[13]研究显示,miR-1225-5p在甲状腺癌组织和细胞系中表达下调,miR-1225-5p过表达可明显抑制甲状腺癌细胞的增殖、迁移和侵袭能力,并促进肿瘤细胞凋亡。SUN等[14]研究显示,miRNA-1225-5p过表达通过靶向下调细胞分裂周期14B蛋白表达抑制喉癌细胞增殖,阻滞肿瘤细胞周期,并诱导细胞凋亡。目前少见miR-1225-5p影响肝癌细胞生物学行为的相关报道。
本研究结果显示,与正常肝细胞比较,肝癌细胞系中miR-1225-5p表达水平降低,提示miR-1225-5p作为抑癌基因参与肝癌的发生和发展。转染miR-1225-5p mimics至肝癌Huh7细胞,Huh7细胞的增殖能力降低,迁移和侵袭细胞数减少,CyclinD1、MMP-2和MMP-9表达水平降低,而p21和p27蛋白表达水平升高,与相关研究结果一致[15-16],说明miR-1225-5p过表达可抑制肝癌细胞Huh7增殖、迁移和侵袭。
miRNA通常在转录后调控靶基因的表达,进而影响细胞的生物学行为[16]。为了进一步探讨miR-1225-5p抑制肝癌细胞增殖、迁移和侵袭的作用机制,本研究通过生物信息学软件预测显示,S100A9的3′UTR中含有与miR-1225-5p互补的核苷酸序列,提示miR-1225-5p可能调控S100A9表达。进一步通过双荧光素酶活性检测和Western blot试验证实,miR-1225-5p在肝癌Huh7细胞中靶向负调控S100A9表达。S100A9是一种钙结合蛋白,参与下咽癌、膀胱癌、非小细胞肺癌等肿瘤的发生和发展[17-19]。HUANG等[20]研究显示,S100A9在肝细胞癌中表达水平升高,且高表达的患者预后较差,其可作为肝细胞癌早期诊断的生物学标志物。蔡琰[21]研究发现,S100A9可能通过激活p38丝裂原活化蛋白激酶通路促进鼻咽癌细胞的增殖、迁移和侵袭。本研究结果显示,肝癌细胞系中S100A9 mRNA和S100A9表达水平高于正常肝细胞,提示S100A9在肝癌发展过程中发挥重要作用。转染S100A9的小干扰RNA抑制S100A9表达后,肝癌细胞Huh7的增殖能力降低,迁移和侵袭细胞数减少,CyclinD1、MMP-2和MMP-9表达水平降低,而p21蛋白表达水平升高,与相关研究结果一致[22],说明下调S100A9表达可抑制肝癌细胞的增殖、迁移和侵袭能力。本研究结果显示,过表达S100A9逆转了miR-1225-5p过表达对肝癌细胞增殖、迁移和侵袭的抑制作用,提示miR-1225-5p通过下调S100A9表达影响肝癌细胞的生物学行为。
4 结 论
miR-1225-5p在肝癌细胞系中表达水平降低,过表达miR-1225-5p可抑制肝癌细胞的增殖、迁移和侵袭,其可能通过靶向下调S100A9表达发挥作用,为肝癌的靶向分子治疗提供一定的新思路。本研究还存在一定的不足之处,接下来将通过裸鼠移植瘤试验进一步探讨miR-1225-5p对肝癌的影响。

