食源性黄酮类化合物调控自噬干预疾病的研究进展
徐 洁,王 君,谭欣同,李大鹏
(山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018)
食源性黄酮类化合物是一类具有C6-C3-C6结构主链及含氧杂环的复杂酚类次生代谢物[1],是水果、蔬菜、茶、葡萄酒以及巧克力等食品中最常见的活性成分。研究发现,黄酮类化合物在调节机体健康方面具有积极的作用,它既可以直接清除超氧阴离子、羟基自由基等氧化物质提高细胞活性[2-3],也能够调控细胞内不同的信号通路促进细胞的存活、生长和增殖[4]。此外,黄酮类化合物还能降低环氧合酶2(cyclooxygenase-2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)以及白细胞介素6(interleukin-6,IL-6)等促炎因子的表达,削弱炎症反应进而缓解细胞损伤。近期研究发现,黄酮类化合物所表现出的抗氧化、抗炎等生物学活性与自噬关系密切[5-6]。
“自噬”最初是由比利时的诺贝尔奖获得者Christian de Duve提出,用来描述细胞内溶酶体分解代谢产生营养物质的过程[6-7]。饥饿、氧化应激以及化学应激等都会诱导细胞自噬[8]。在哺乳动物细胞内,已知的自噬可分为以下3 种类型:巨自噬、微自噬和分子伴侣介导的自噬,其中巨自噬是主要类型,其形态学标志是双层膜自噬囊泡的形成及其与溶酶体的融合。在癌症中,自噬可能呈现双刃剑行为,这主要取决于肿瘤发展阶段,在肿瘤早期自噬诱导细胞死亡,但在已成熟的肿瘤模型中自噬促进细胞存活[9]。在神经退行性疾病中,自噬通过清除错误折叠蛋白质聚集体减缓疾病发展[10]。自噬也是维持心肌细胞大小以及整体心脏结构和功能的一种稳态机制,在衰竭心脏中通过上调自噬从而使心肌细胞免受血流动力学应激的影响[11]。由此可知,自噬在众多疾病中发挥着重要的作用。因此,寻找具有调控自噬能力的化合物,对干预和治疗相关疾病具有重要意义。
黄酮类化合物广泛存在于人类膳食中并具有多种生物学功能。许多研究表明黄酮类化合物能通过自噬作用干预炎症、癌症、肝病、心血管疾病等的发生[12-14]。本文围绕黄酮类化合物通过不同信号通路调节自噬干预疾病的发生进行了综述。
1 自噬的发生及其分子机制
自噬最初是在酵母中发现的,在哺乳动物细胞中也发现酵母中的自噬相关蛋白或者这些蛋白的类似物[15-16]。自噬分为四个阶段:成核、膜的伸长、与溶酶体融合、降解[17]。成核阶段是细胞器产生的双层膜结构在待降解物质周围环绕形成隔离膜,该过程主要是Unc-51样激酶1/2(Unc-51-like kinase 1/2,ULK1/2)复合物发挥作用,它由腺苷单磷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)激活,受雷帕霉素的哺乳动物靶标复合物1(Mammalian target of rapamycin complex 1,mTORC1)的负调控。关于自噬体膜的来源众说纷纭,有研究证明内质网膜、高尔基体膜、质膜等都参与了自噬体膜的形成[18-24],且可能与所要降解的靶向物质有关[7]。膜的伸长是隔离膜继续延长,包裹细胞质,形成完整的双层膜结构的过程,这期间主要由包含自噬相关基因6(Autophagy related gene 6,Atg6)、液泡蛋白分选相关蛋白34(vacuolar protein sorting-associated protein 34,Vps34)、自噬相关基因14L(Autophagy related gene 14L,Atg14L)及液泡蛋白分选相关蛋白15(vacuolar protein sorting-associated protein 15,Vps15)的III型磷脂酰肌醇3激酶复合物(Class III Phosphatidylinosittide 3-kinase,PI3KC3)在发挥作用。与溶酶体融合过程中,主要是自噬相关基因8(Autophagy related gene 8,Atg8)、自噬相关基因12(Autophagy related gene12,Atg12)组成的两个泛素样系统在发挥作用。Atg8的C末端被自噬相关基因4(Autophagy related gene 4,Atg4)家族的半胱氨酸切割露出甘氨酸残基形成微管相关蛋白1轻链3I(microtubule-associated protein 1 light chain 3I,LC3I),它的甘氨酸残基在E1样蛋白酶自噬相关基因7(Autophagy related gene 7,Atg7)和E2样蛋白酶自噬相关基因3(Autophagy related gene 3,Atg3)的作用下与溶酶体膜内磷脂酰乙醇胺结合形成微管相关蛋白1轻链3II(microtubule-associated protein 1 light chain 3II,LC3 II),使它们与膜紧密结合[25]。Atg12-Atg5-Atg16的定位决定了自噬相关基因8脂化的位点[25-27]。LC3是酵母中Atg8的同源蛋白,它的脂化促进了自噬体膜的扩张和闭合[27]。LC3 II定位在前自噬体中,会选择性隔离降解靶标到自噬体。在降解的过程中,自噬相关基因9(Autophagy related gene 9,Atg9)循环系统发挥着重要作用。在自噬后期自噬相关基因9从自噬体膜结构中抽离形成新的Atg9囊泡,循环利用。自噬相关基因9从自噬体向外周位点的反向运输过程中,自噬相关基因1复合物(Unc-51-like kinase 1,ULK1),Atg2-Atg18复合体以及磷脂酰肌醇3激酶(Phosphatidylinosittide 3-kinase,PI3K)复合物参与其中的调控[28]。自噬形成过程如图1所示。
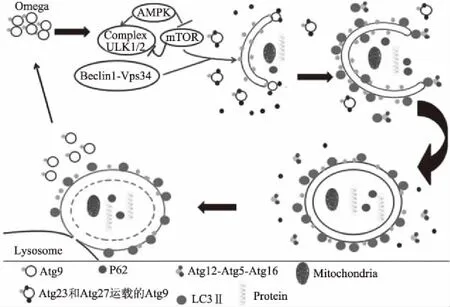
图1 自噬的发生过程Fig.1 Process of autophagy
2 食源性黄酮类化合物调控自噬对不同疾病的干预
黄酮类化合物根据结构可以分为异黄酮、黄酮醇、二氢黄酮、黄酮、黄烷醇、花青素[29]。研究发现,不同的黄酮类化合物调节自噬作用的信号通路、作用机制及对不同疾病的干预存在差异。
2.1 癌症
金雀异黄酮在MCF-7乳腺癌细胞中通过增加促凋亡蛋白B细胞淋巴瘤-2相关X蛋白/B细胞淋巴瘤-2蛋白(B-cell lymphoma-2 Associated X Protein/B-cell lymphoma-2 protein,BAX/Bcl-2)比例,降低锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)、铜锌超氧化物歧化酶(copper-zinc superoxide dismutase,CuZn-SOD)和硫氧还蛋白氧化还原酶(thioredoxin reductase,TrxR)等抗氧化酶基因表达,上调自噬进而促进肿瘤细胞的凋亡,发挥显著的抗增殖作用[30]。在原发性积液淋巴瘤细胞中,槲皮素通过抑制磷脂酰肌醇3激酶/蛋白激酶B/雷帕霉素的哺乳动物靶标(Phosphatidylinosittide 3-kinase/Protein kinaseB/mammalian target of Rapamycin,PI3K/AKT/mTOR)和信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)途径诱导细胞的凋亡和自噬,在加入STAT3的抑制剂AG490和雷帕霉素哺乳动物靶标(mammalian target of Rapamycin,mTOR)的抑制剂NVP-BEZ235发现:AG490不仅抑制STAT3的表达,还降低了mTOR的靶标真核翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor4E-binding protein1,4E-BP1)的磷酸化水平,NVP-BEZ235处理后也降低了细胞中信号转导和转录激活因子3的表达,说明PI3K/AKT/mTOR和STAT3间相互作用[31]。有研究表明信号STAT3参与自噬的调控[32],而且抑制STAT3的激活促进自噬的发生[33]。橘皮素在肝癌细胞(HepG2)中通过C-Jun N-末端蛋白激酶/B淋巴细胞瘤-2/自噬相关蛋白Beclin 1(C-Jun N-terminal protein kinase 1/B-cell lymphoma-2 protein/Autophagy-related protein Beclin 1,JNK/Bcl-2/Beclin1)途径诱导自噬,进而抑制HepG2细胞的增殖和迁移[34]。橙皮苷在氧化偶氮甲烷诱导的结肠癌模型中显著上调肿瘤抑制因子磷酸酶和张力蛋白同源物(phosphatase and tensin homologue,PTEN)的表达,靶向抑制调控有丝分裂的丝氨酸/苏氨酸激酶激活的磷脂酰肌醇3激酶/蛋白激酶B/糖原合酶激酶3β(phosphatidylinosittide 3-kinase/protein kinase B/glycogen synthase kinase-3β,PI3K/AKT/GSK-3β)和mTOR通路,进而上调自噬自噬诱导结肠癌细胞的凋亡[35]。在人结肠癌细胞系中,芹菜素通过抑制蛋白激酶B/雷帕霉素的哺乳动物靶标(Protein kinaseB/mammalian target of Rapamycin,AKT/mTOR)信号通路诱导自噬溶酶体系统降解参与Wnt信号传递过程的β-连环蛋白(β-catenin),进而发挥抗癌作用[36]。在积液淋巴瘤细胞系的BC3、BCBL1细胞中,芹菜素通过诱导自噬,降低活性氧(reactive oxygen species,ROS)的含量,促进细胞的凋亡[37]。在Hep38细胞中,芹菜素通过提高ROS含量诱导自噬进而促进细胞的凋亡,在用自噬抑制剂处理后ROS的含量没有变化但细胞凋亡率上升[38]。这说明ROS不是影响细胞自噬和凋亡的必要条件,但当氧化还原失衡导致产生超过细胞去除能力的ROS的量时,ROS会和自噬相互作用来维持细胞稳态[39-44]。
在某些癌细胞中黄酮类物质通过与自噬抑制剂联用发挥抗癌作用。在人胃癌细胞中,川陈皮素诱导细胞凋亡,产生保护性自噬,而在川陈皮素和自噬抑制剂氯喹联合处理后可进一步促进人胃癌细胞的凋亡[45]。芹菜素在肝癌细胞中诱导凋亡,且通过抑制PI3K/AKT/mTOR信号通路诱导保护性自噬;在芹菜素和自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)共同处理后会进一步增加肿瘤细胞的凋亡率[46]。飞燕草素在MDA-MB-453和BT474人乳腺癌细胞中通过激活腺苷单磷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)抑制mTOR进而诱导自噬,而抑制自噬后会增加飞燕草素诱导的细胞凋亡和抗增殖作用[47]。在人间皮瘤细胞中,表儿茶素没食子酸酯(epigallocathechin-3-gallate,EGCG)诱导产生活性氧(ROS),损害线粒体膜电位进而促进细胞死亡,且发现EGCG能够诱导细胞自噬。为了测定EGCG诱导的自噬和细胞死亡间的关系,在用自噬抑制剂氯喹(Chloroquine,CQ)处理后,发现EGCG诱导的细胞死亡增强[48],说明EGCG通过诱导自噬促进肿瘤细胞死亡。由此可知,黄酮类物质在某些癌细胞中诱导的自噬对细胞是有保护作用的,在与自噬抑制剂联用后会促进癌细胞的凋亡,这说明黄酮类化合物与自噬抑制剂联用也是治疗癌症的有效手段。
2.2 肝病
在非酒精性脂肪肝中,樱桃花青素通过抑制雷帕霉素哺乳动物靶标(mammalian target of Rapamycin,mTOR)激活自噬,保护肝细胞免受氧化应激的影响,并清除油酸(Oleic acid,OA)诱导的脂质蓄积过程中的脂质[49]。在人肝星状细胞中,矢车菊素-3-O-葡萄糖苷通过活化腺苷单磷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)上调自噬抑制肝星状细胞活化,改善慢性酒精性肝损伤[50]。在酒精处理的肝细胞中LC3Ⅱ和p62的含量均升高,且溶酶体膜蛋白LAMP1以及自噬体和溶酶体融合所必需的LAMP2和Rab2的表达量下降,细胞内的自噬受到抑制;在加入槲皮素后其通过抑制mTOR,促进其下游的转录因子EB(transcription factor EB,TFEB)核转移进而提高自噬通量改善慢性酒精中毒症状[51]。此外,槲皮素还通过激活磷脂酰肌醇3激酶/蛋白激酶B(Phosphatidylinosittide 3-kinase/Protein kinaseB,PI3K/AKT)途径抑制自噬来降低肝损伤,并通过抑制转化生长因子β1/Smads(transforming growth factor-β1/Smads,TGF-β1/Smads)途径减轻由CCl4和胆管结扎诱导的C57小鼠肝纤维化[52]。研究发现TGF-β1/Smads和PI3K/AKT这两条通路间的关系是串扰复杂的:p-Smad3负调控蛋白激酶B(Protein kinaseB,AKT)和磷脂酰肌醇3激酶(phosphatidylinosittide 3-kinase,PI3K)的表达;AKT通过螯合胞质中的Smad3进而抑制Smad3介导的生长抑制和凋亡;AKT还通过磷酸化叉头盒子O蛋白(forkhead box O,FOXO)阻断转化TGF-β1抑制细胞活性的作用;而TGF-β1可激活磷脂酰肌醇3激酶PI3K[53]。
2.3 心血管疾病
在氧糖剥离再灌注的人脑微血管内皮细胞中,表没食子酸酯(epigallocatechin gallate,ECG)通过上调自噬,减少细胞凋亡,促进新生血管形成保护脑免受缺血/再灌注损伤[54]。在低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)处理的人脐静脉内皮细胞中,ECG通过III类磷脂酰肌醇3激酶/Beclin-1和磷酸酶和张力蛋白同源物/I类磷脂酰肌醇3激酶/蛋白激酶B级联信号(phosphatase and tensin homologue/class I PI3K/Protein kinaseB cascade signaling,PTEN/PI3K I/AKT)介导的自噬减少细胞损伤和凋亡[55]。在低密度脂蛋白诱导的动脉粥样硬化模型中,木樨草素处理后增强了细胞内的自噬,减少了细胞内的脂质累积,降低了细胞的凋亡率;然而在用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)处理后则呈现相反的效果,说明木樨草素通过上调自噬减少低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)刺激的泡沫细胞的形成[56]。葛根素通过腺苷单磷酸激活蛋白激酶/雷帕霉素哺乳动物靶标/Unc-51样激酶1(adenosine monophosphate-activated protein kinase/mammalian target of Rapamycin/Unc-51-like kinase 1,AMPK-mTOR-ULK1)途径抑制自噬的启始,减轻了脑缺血/再灌注损伤[57]。橙皮苷主要通过激活磷脂酰肌醇3激酶/蛋白激酶B/雷帕霉素的哺乳动物靶标(Phosphatidylinosittide 3-kinase/Protein kinaseB/mammalian target of Rapamycin,PI3K/AKT/mTOR)途径抑制过度自噬来减少心肌脑缺血/再灌注损伤[58]。在棕榈酸刺激的牛主动脉内皮细胞中,表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)通过钙离子/钙调蛋白依赖性蛋白激酶β/腺苷单磷酸激活蛋白激酶(calcium ion/calmodulin-dependent protein kinase kinaseβ/adenosine monophosphate-activated protein kinase,Ca2+/CaMKKβ/AMPK)信号通路诱导自噬,进而降低细胞内的油脂积累;在用钙调蛋白依赖性蛋白激酶β(calmodulin-dependent protein kinase kinaseβ,CaMKKβ)抑制剂STO-609处理后并没有改变p-mTOR/mTOR的含量,说明雷帕霉素哺乳动物靶标(mammalian target of Rapamycin,mTOR)在牛主动脉内皮细胞(Bovine aortic endothelial cells,BAEC)中不参与EGCG诱导的自噬[59]。
研究发现柚皮苷能够穿过血脑屏障。在脑缺血再灌注细胞模型中,柚皮苷减少了3-硝基酪氨酸的形成,降低了线粒体中微管相关蛋白1轻链3II(microtubule-associated protein 1 light chain 3II,LC3II)与微管相关蛋白1轻链3I(microtubule-associated protein 1 light chain 3 I,LC3I)的比例,并抑制了Parkin蛋白向线粒体的转运,减弱了细胞内的过度自噬,进而减少梗塞面积以及细胞凋亡率来预防脑缺血再灌注损伤[60]。
在脂多糖(lipopolysaccharide,LPS)诱导的心肌损伤模型中,芹菜素改善了心脏损伤,并且降低了炎性细胞因子。研究证明芹菜素的抗炎作用与其调控的自噬有关,它通过调控转录调节因子转录因子EB(transcriptional regulator transcription factor EB,TFEB)和下游靶基因,增加液泡蛋白分选相关蛋白11(vacuolar protein sorting-associated protein 11,Vps11)和微管相关蛋白1A/1B轻链3B(Map1lc3),进而上调自噬通量,发挥抗炎作用[61]。
2.4 其他疾病
β-淀粉样蛋白(beta-amyloid,Aβ)是阿尔兹海默症的主要致病因子,它会诱导Neuro-2A脑神经瘤细胞的自噬进而抑制葡萄糖摄取,在加入橙皮素和橙皮苷后自噬受到抑制,进而增加了葡萄糖摄取,这表明橙皮素或橙皮苷可能是预防阿尔茨海默症的潜在药物[62]。在阿尔兹海默症的大鼠模型中,高剂量的金雀异黄酮通过自噬降解致病性聚集体Aβ,改善阿尔兹海默症的症状[63]。在亨廷顿氏病细胞模型中,金雀异黄酮也通过自噬降解突变的亨廷顿聚集体,从而增强细胞活力[64]。此外,在低密度脂蛋白(Low-density lipoprotein,ox-LDL)处理的人脐静脉内皮细胞中,金雀异黄素通过去乙酰化酶1/肝激酶B1/腺苷单磷酸激活的蛋白激酶(sirtuin 1/liver kinase B1/adenosine monophosphate-activated protein kinase,SIRT1/LKB1/AMPK)途径诱导自噬,降低衰老相关蛋白P16和P21的表达水平,减缓机体的衰老[65]。在HepG2细胞中,儿茶素可以有效减少人肝癌HepG2细胞中AFP的分泌并同时诱导α-胎儿蛋白聚集物(α-fetal protein,AFP)聚集,同时儿茶素诱导的自噬降解α-胎儿蛋白聚集物(α-fetal protein,AFP)保护细胞免受损伤[66]。由此可以推测黄酮类物质可以通过上调自噬,降解细胞内的致病聚集物,进而干预疾病。
椎间盘退变(intervertebral disc degeneration,IDD)是腰痛的主要原因,目前对IDD有效的药物很少。研究表明,在髓核细胞中,柚皮苷通过腺苷单磷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信号途径促进自噬标志物LC3II/LC3I和Beclin-1的表达,并减少氧化应激诱导的凋亡。此外,体内研究也表明,柚皮苷可能通过调控自噬,进而改善穿刺诱导的大鼠模型中的椎间盘退变,保护髓核细胞免于凋亡[67]。
在慢性粒白血病K562细胞(K562 cells of chronic myelogenous leukemia,K562 cells of CML)中,结果表明葛根素以剂量依赖的方式抑制K562细胞的活力,增加细胞的凋亡和自噬。然而在使用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)抑制自噬后,发现其诱导凋亡的作用也被抑制,这说明葛根素通过自噬作用促进K562细胞的凋亡[68]。
目前人口老龄化严重,患有代谢性骨疾病的人数也在增加。用于治疗骨质疏松症的唑来膦酸盐具有抑制破骨细胞的骨吸收能力,它在长期服用期间会引起与双膦酸盐有关的颌骨坏死(bisphosphonate-related osteonecrosis of the jaw,BRONJ)。研究表明,高良姜黄素、山柰酚等类黄酮诱导的自噬能够抵抗唑来膦酸盐的毒性,且类黄酮诱导自噬支持成骨转录因子,从而诱导成骨细胞分化和骨形成[69]。
3 食源性黄酮类化合物调控自噬增强临床药效
食源性黄酮类物质除了通过调控自噬直接干预疾病外,还可以在与药物联用的过程通过调控自噬使药物更好地发挥药效。在多形性胶质母瘤细胞中,芦丁通过抑制替莫唑胺诱导的自噬进一步促进细胞的凋亡,增强替莫唑胺的抗癌功效[70]。此外,抗癌剂多柔比星长期使用会引起心脏毒性和心力衰竭,而芦丁通过抑制心肌细胞的自噬和凋亡,减弱多柔比星引起的心脏毒性[71]。庆大霉素通常用于抑制革兰氏阴性菌,但其对肾有毒性作用;用150 mg/kg芦丁和80 mg/kg庆大霉素联合处理的小鼠中,芦丁通过抑制自噬减轻庆大霉素诱导的小鼠肾毒性[72]。在人前列腺癌细胞(PC3)中,表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)通过显著上调自噬减轻抗癌药硼替佐米(Bortezomib,BZM)对细胞的毒性作用,从而减轻内质网压力并抑制C/EBP同源蛋白(C/EBP-homologous protein,CHOP)上调,最终保护PC3细胞免于凋亡[73]。在表皮生长因子受体(epidermal growth factor receptor,EGFR)产生耐药突变的非小细胞肺癌细胞H1975中,芹菜素与治疗非小细胞肺癌的吉非替尼(gefitinib)联合应用显著抑制自噬,破坏了细胞对葡萄糖的利用,进一步促进癌细胞的凋亡[74]。综上所述,临床药物与天然产物联合使用可能是减轻药物毒副作用的有效策略,两者联用可以更好地发挥化学药物的功效。
4 食源性黄酮类物质调控自噬的信号通路
PI3K/AKT/mTOR是食源性黄酮类物质调控自噬的一条常见通路。其中mTOR是调控自噬的一个关键蛋白,它对自噬启始的关键蛋白ULK1/2具有负调控作用,同时mTOR也受AMPK的负调控。TFEB是mTOR的下游蛋白,有研究表明它能够上调VPS11及LC3蛋白,从而增大自噬通量[61]。本文所述的食源性黄酮类物质多以调控mTOR上下游蛋白的途径诱导自噬。此外,食源性黄酮类物质还能通过调控Beclin1蛋白进而调节自噬[34,55,67]。抑制mTOR会激活的Ulk1-Atg13-FIP200复合物,进而激活Beclin1、Bcl-2家族蛋白、III类PI3K和Atg14L复合物开始形成自噬体[75]。Beclin1与抗凋亡蛋白Bcl-2结合会抑制自噬。而橘皮素通过JNK介导Bcl-2的磷酸化,然后磷酸化Bcl-2从Beclin1/Bcl-2复合物中解离,从而导致Beclin1 释放并开始自噬,进而抑制肝癌细胞的迁移和增殖[34,76]。本文所述的食源性黄酮类物质调控自噬的具体信号通路如表1所示。
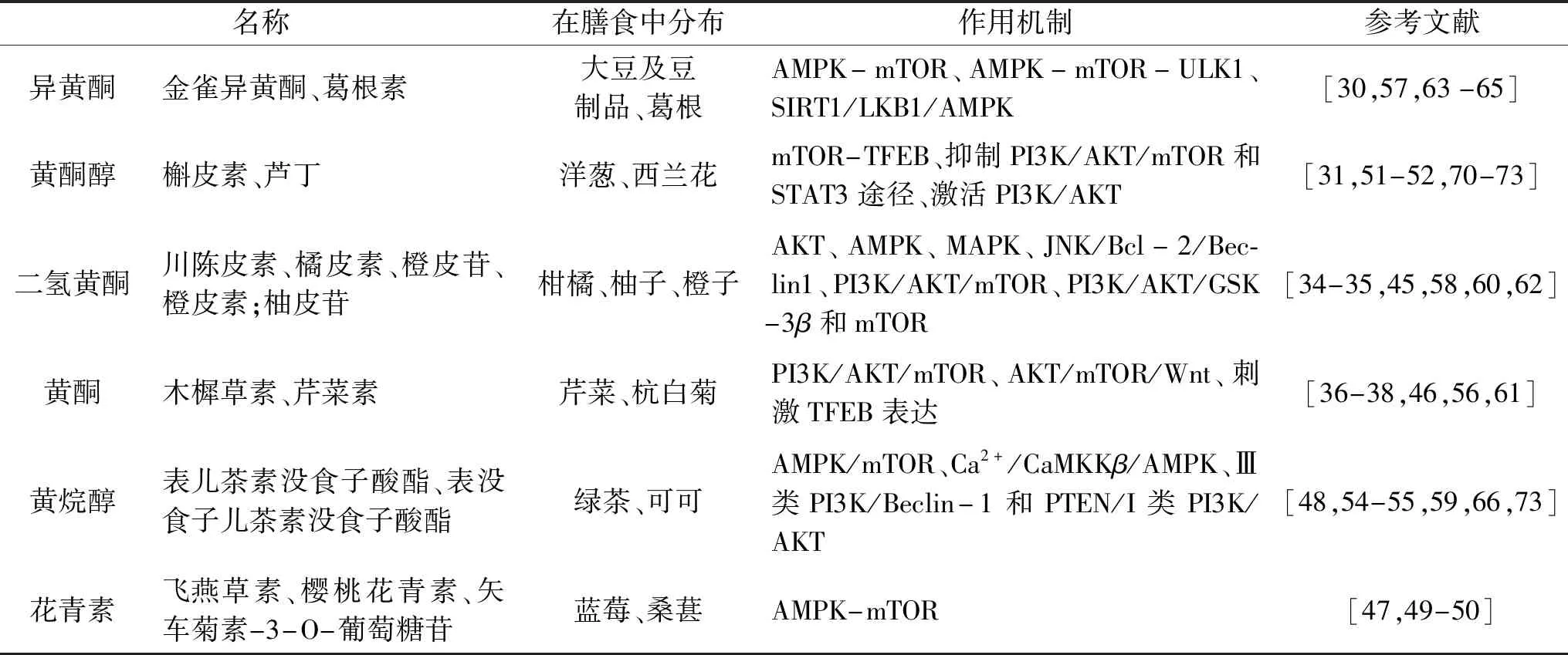
表1 食源性黄酮类化合物在自噬中的作用及机制Table 1 The role and mechanism of foodborne flavonoids in autophagy
5 结论与展望
自噬主要通过降解细胞内受损的细胞器、聚集的蛋白体物质来维持体内平衡,自噬的失调导致细胞在死亡和存活之间失衡,引起器官和组织发生严重病变。黄酮类化合物作为植物源食品中广泛存在的一类天然活性成分,它通过调控自噬,进而干预炎症、肝病、心血管疾病、神经退行性疾病等慢性疾病。研究表明,黄酮类物质调控自噬的过程可能与多个信号通路有关,而PI3K/AKT/mTOR信号途径可能与黄酮类物质的干预作用关系最密切。食源性黄酮类物质诱导的自噬对同种类型的细胞存活的影响也是不同的,这可能是与细胞的状态有关。黄酮类化合物在部分癌症模型中诱导的自噬对癌细胞的存活是呈保护性的,在与自噬抑制剂联用后能进一步增加癌细胞的凋亡率。可见,从调控自噬的角度,食源性黄酮类物质与临床药物联用可能更有利于发挥药物的抑癌效果。总之,进一步筛选和明确食源性黄酮类化合物功能成分在自噬调控中的作用机制,开发具有特定功能活性的黄酮类功能食品对于促进人体健康具有重要的意义。

