不同菌发酵紫薯制品对降血糖相关酶的影响及活性成分分析
刘思含,李高阳,,*,宋 莹,侯宇豪,常 霞,谢秋涛
(1.湖南大学隆平分院,湖南长沙 410125; 2.湖南省农业科学院农产品加工研究所,湖南长沙 410125)
紫薯(Ipomoeabatatas(L.)Lam)属旋花科甘薯属草本植物,因薯肉呈深紫色而得名,又叫黑薯、紫心甘薯[1]。紫薯营养丰富,富含硒元素、花青素、蛋白质、淀粉、果胶、纤维素、氨基酸、维生素及多种矿物质,被营养学家称为“营养最均衡的保健食品之一”,极具应用价值[2]。研究表明,紫薯产品不仅色泽鲜亮、香气诱人,还具有抑菌、抗氧化、抗突变、增强人体免疫力、预防癌症、延缓衰老、促进肠胃蠕动和排毒、降低心血管疾病发生率、保肝护肝等功能特性[3]。紫薯的高营养价值使得研究紫薯加工产品成为一大热点,而微生物发酵作为常见的食品加工手段,使得发酵型紫薯产品在紫薯产品中占有一席之地。
这是因为在食品加工的过程中,微生物消耗营养素生产各种具有极高活性的物质,从而提高食品的功能特性[4]。另外,微生物产生的各种高活性的酶还可以将食物中的一些结合状态的功能成分释放出来,进一步提高食品的功能性[5]。除了用紫薯作为原料生产紫薯酒或紫薯醋的工艺研究外[6],利用微生物发酵提高紫薯的功能特性[7]也是发酵紫薯产品的研究重点。
近年来,糖尿病的发病率呈现出了明显的上升趋势。在临床上,α-淀粉酶和α-葡萄糖苷酶活性抑制剂发挥着重要作用,防止餐后高血糖的发生[8]。研究表明,植物中的黄酮、多酚、多糖等高活性物质具有显著抑制α-淀粉酶和α-葡萄糖苷酶活性的作用[9]。通过加工提高植物中高活性成分的含量来抑制糖尿病相关酶已成为研究热点。目前市场上以紫薯为原料的降血糖产品少见,利用微生物发酵的手段研究适用于糖尿病人的紫薯食品具有广阔的前景。本研究以α-淀粉酶和α-葡萄糖苷酶的活性抑制率作为考核指标,探讨不同菌种、不同发酵方式的紫薯产品对降血糖相关酶的抑制效果,并考察了发酵制品中多酚、多糖和黄酮等活性成分的变化规律,从而为降血糖发酵紫薯等功能食品的研发提供参考。
1 材料与方法
1.1 材料与仪器
植物乳杆菌、保加利亚乳杆菌亚种、嗜热链球菌、低糖面包酵母、白酒酵母、葡萄酒酵母 均实验室保存;紫薯 市售;果胶酶、纤维素酶、α-淀粉酶、α-葡萄糖苷酶等 Sigma公司。
CLARIOstar全波长荧光扫描酶标仪 德国BMG公司;Waters UPLC超高效液相色谱仪 Waters公司;Agilent 7890B气相色谱仪 安捷伦公司;752N紫外可见分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 发酵紫薯制品的制备 工艺流程:紫薯→洗净→蒸熟→研磨→(液化→)灭菌→接菌→发酵→灭菌
将新鲜紫薯洗净,蒸熟,磨成泥状。称取定量紫薯泥灭菌后作为固体发酵底物。取相同质量的紫薯泥同时加入的0.2%(占紫薯质量)果胶酶、0.2%纤维素酶、0.2%α-淀粉酶及料液比1∶1 g/mL的纯净水,37 ℃酶解24 h,将其液化为紫薯汁,灭菌后作为液体发酵底物。
参考常用的发酵方法[10],取相同质量的发酵底物同时加入2%的菌液发酵4 h后,巴氏灭菌终止发酵,将发酵完成后的紫薯制品放入-18 ℃低温贮藏。发酵所用底物、发酵菌菌液、发酵方式所组成的样品及其编号见表1。

表1 不同菌种的发酵底物及方式Table 1 Fermentation substrates and methods of different strains
1.2.2α-淀粉酶活性抑制试验α-淀粉酶的活性测定参考Mccue等[11]的方法稍作改动。取5 g发酵紫薯制品加入0.1 mol/L磷酸缓冲液(PBS,pH6.9)摇匀,静置30 min,以3000 r/min离心10 min,取上清液待测。取500 μL的上清液加入500 μLα-淀粉酶溶液(5 U/mL),37 ℃孵育10 min,随后加入500 μL 1%可溶性淀粉,37 ℃孵育10 min,再加入1 mL 3,5-二硝基水杨酸(DNS)试剂,沸水浴5 min终止反应。冷却至室温后稀释一倍,在540 nm处用酶标仪测定吸光度。阴性组加入500 μL PBS缓冲液取代上清液,空白组加入1 mL PBS缓冲液取代上清液和α-淀粉酶溶液。按照式(1)计算发酵紫薯制品对α-淀粉酶的抑制率。

式(1)
式中:A1为阴性组;A2为空白组;A3为样品组。
1.2.3α-葡萄糖苷酶活性抑制试验α-葡萄糖苷酶的活性测定参考Yao等[12]的方法稍作改动。取5 g发酵紫薯制品加入0.1 mol/L磷酸缓冲液(PBS,pH6.9)摇匀,静置30 min,以3000 r/min离心10 min,取上清液待测。取100 μL的上清液加入50 μLα-葡萄糖苷酶溶液(10 U/mL),37 ℃孵育15 min,再加入50 μL 1 mmol/mL 4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG),37 ℃孵育15 min,加入100 μL Na2CO3(1 mol/L)终止反应。样品空白对照组加入50 μL PBS缓冲液取代α-葡萄糖苷酶;空白组加入50 μL PBS缓冲液取代α-葡萄糖苷酶和100 μL PBS缓冲液取代上清液;阴性组加入100 μL PBS缓冲液取代上清液,其余条件相同。在400 nm处用酶标仪测定吸光度。按照式(2)计算发酵紫薯制品对α-葡萄糖苷酶的抑制率。

式(2)
式中:A1为阴性组;A2为空白组;A3为样品组;A4为样品空白组。
1.2.4 多糖含量及组成的测定
1.2.4.1 非淀粉多糖的提取 参考文献[13]方法稍作修改。称取5 g发酵紫薯制品加入100 mL蒸馏水,60 ℃水浴2 h,冷却后加入适量α-淀粉酶水解1 h,3000 r/min离心20 min,取上清液45 ℃真空浓缩。然后按料液比1∶20 g/mL加入无水乙醇沉降8 h。4000 r/min离心10 min,取沉淀60 ℃烘至干燥,用50 mL 80%乙醇洗涤3次,得到非淀粉多糖。
1.2.4.2 多糖含量的测定 多糖含量用苯酚-硫酸法[14]。取1.2.4.1中5 g样品中所得的非淀粉多糖加入5 mL蒸馏水配成溶液。取2 mL溶液加入1 mL 6%苯酚水溶液,再加入5 mL浓硫酸,沸水浴5 min,冷却至室温,稀释10倍。在480 nm处测定吸光值,以葡萄糖为标准品,并做葡萄糖标准曲线,数值以多糖含量占样品总含量的百分比(%)计。
1.2.4.3 多糖组成的测定 多糖的组成参考文献[15]的方法。取20 mg非淀粉多糖加入15 mL 2 mol/L三氟乙酸,105 ℃水解6 h,取5 mL水解液50 ℃ 0.8 MPa减压蒸发至干,用甲醇洗涤,洗涤3次每次10 mL。加入5 mL吡啶溶解。取800 μL水解液加入300 μL 0.5 mg/mL肌醇溶液,加入300 μL N,O-双(三甲基硅烷基)三氟乙酰胺和三甲基氯硅烷(99∶1)混合衍生生化试剂,在70 ℃衍生40 min,过0.22 μm有机滤膜,然后进行GC-MS分析。单糖标品为:葡萄糖、果糖、阿拉伯糖、木糖、鼠李糖、甘露糖、半乳糖和岩藻糖。
色谱条件:DB-5石英毛细管柱毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:柱初始温度140 ℃,以4 ℃升到240 ℃,进样口温度250 ℃,载气流速1 mL/min,分流比为50∶1。质谱条件:离子源温度230 ℃,电离方式为EI,电子能力70 eV,数据采集方式为选择离子检测模式(Selective Ion Monitoring,SIM),选择特征离子分别为:73.00、115.10、147.10、191.10、204.10、217.10、265.10、291.10、292.10、305.10、306.10、318.20和437.30。
1.2.5 总多酚含量的测定 总酚测定参考改进的Folin-Ciocalteu方法[16]。取5 g发酵紫薯制品加入20 mL 80%乙醇,摇匀,静置1 h,3000 r/min离心5 min,取上清液,得到含有多酚的样液。取0.5 mL样液加入0.5 mL超纯水,摇匀。加入0.5 mL福林试剂,振荡1 min。加入1.5 mL 20% Na2CO3溶液,振荡1 min,加入超纯水定容10 mL。70 ℃水浴加热10 min,冷却。760 nm处测定吸光值。以没食子酸为标品,并做没食子酸标准曲线,数值以mg/10 g计。
1.2.6 总黄酮含量的测定 总黄酮测定参考改进的Dewanto[17]方法。取5 g发酵紫薯制品加入20 mL 80%乙醇,摇匀,静置1 h,3000 r/min离心5 min,取上清液,得到含有黄酮的样液。取1 mL样液加入5 mL 70%乙醇,再加入0.3 mL 5% NaNO2溶液摇匀,静置5 min,加入0.3 mL 10% Al(NO)3溶液摇匀,静置5 min,加入2 mL 1 mol/L NaOH溶液摇匀,加入70%乙醇定容10 mL。510 nm处测定吸光值。以芦丁为标品,并做芦丁标准曲线,数值以mg/10 g计。
1.2.7 多酚、黄酮组分测定 参考Wang等[18]的多酚黄酮的测量指标进行测定。取5 g发酵紫薯制品加入20 mL 50%甲醇,摇匀,静置1 h,3000 r/min离心5 min,取上清液,过0.22 μm有机滤膜。用50%甲醇配制100 μg/mL标品溶液(表儿茶素、咖啡酸、对香豆酸、阿魏酸、原儿茶酸、芦丁、氯化矢车菊素)。
色谱条件:色谱柱ACQUITY UPLC×BEH C18色谱柱(2.1 mm×150 mm,1.7 μm);流动相:甲醇(A)-0.5%乙酸水溶液(B),梯度洗脱(0~6 min,30% A;6~21 min,20% A;21~30 min,30% A);检测波长为283、320 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL。
1.3 数据处理
实验取3次重复试验平均值,用Excel和SPSS 2.0对结果进行数据处理,用Origin 8.5绘制图表进行分析。
2 结果与分析
2.1 发酵紫薯制品对降血糖相关酶的影响
2.1.1 发酵紫薯制品对α-淀粉酶的抑制率 发酵是一种常见的改变食品功能特性的手段,不同菌种及其不同发酵方式对发酵产品会产生不同的影响[19]。图1为发酵紫薯制品对α-淀粉酶的活性抑制率的对比图。如图1所示,在降血糖活性的表现上,虽然不同菌种及其不同处理方式对α-淀粉酶的活性抑制率各不相同,但均高于未发酵样品,推测发酵提高了菌种对α-淀粉酶活性的抑制率,这与其他研究的结论相同[20]。通过对比图1A与1B,图1C与1D、1E发现,在对α-淀粉酶的活性抑制影响中,以紫薯汁为发酵底物的发酵方式>以紫薯泥为底物的发酵方式;而对比图1D与图1E发现,无氧发酵的方式>有氧发酵的方式;而通过图1E图内对比发现,有氧发酵产品对α-淀粉酶活性抑制的影响较小。
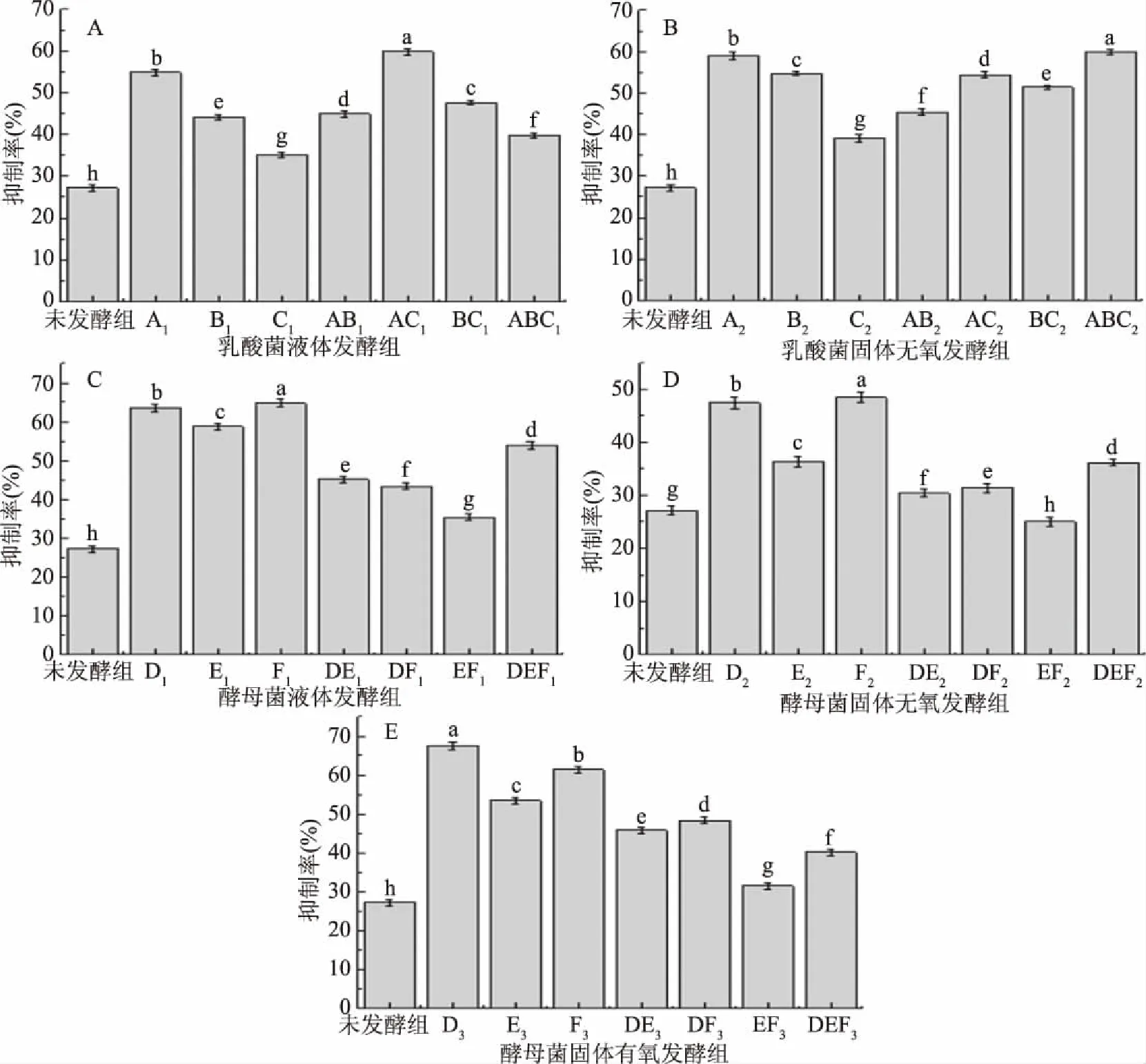
图1 发酵紫薯制品对α-淀粉酶活性的抑制率Fig.1 Inhibition rate of α-amylase activity in fermented purple sweet potato products注:不同小写字母表示差异显著(P<0.05),A1、B1等图标表示不同组发酵样品组(详见表1);图2~图5同。
对比植物乳杆菌发酵组(A1)、保加利亚乳杆菌亚种发酵组(B1)和嗜热乳酸链球菌发酵组(C1)发现,乳酸菌发酵对α-淀粉酶的活性抑制率,A1>B1>C1;而这3组在图1B中有相同的规律;在图1A混合乳酸菌发酵对α-淀粉酶的活性抑制率对比中,植物乳杆菌与嗜热乳酸链球菌混合发酵组(AC1)抑制率最高;而在图1B中三种乳酸菌混合发酵组(ABC2)对α-淀粉酶活性抑制率最高。综合图1A和1B而言,单一植物乳杆菌发酵对α-淀粉酶的活性抑制效果较好,具有典型性。
对比图1C、1D和1E发现,单一酵母菌发酵组(D1、E1、F1、D2、E2、F2、D3、E3、F3)比混合酵母菌发酵组(DE1、DF1、EF1、DEF1、DE2、DF2、EF2、DEF2、DE3、DF3、EF3、DEF3)对α-淀粉酶活性抑制效果要更为显著(P<0.05)。在图1C、1D中,低糖面包酵母组(D1、D2)与葡萄酒酵母组(F1、F2)对α-淀粉酶活性的抑制差别较小,并显著(P<0.05)高于白酒酵母组(E1、E2);但在E1组中,D3比F3的抑制效果更显著(P<0.05)。综合图1C、1D和1E,单一低糖面包酵母菌发酵对α-淀粉酶的活性抑制效果较好,具有典型性。
2.1.2 发酵紫薯制品对α-葡萄糖苷酶的抑制率 在降血糖的功效上,α-葡萄糖苷酶抑制剂是以抑制碳水化合物分解来达到抑制餐后血糖上升目的[21]。图2为发酵紫薯制品对α-葡萄糖苷酶的活性抑制率对比图。如图2所示,不同菌及不同处理方式对α-葡萄糖苷酶的活性抑制率也各不相同,但与其他研究结果相同的是,发酵使α-葡萄糖苷酶的活性抑制率有所提高[20]。在对α-葡萄糖苷酶的活性抑制影响中,对比图2A与2B,图2C与2D、2E,以紫薯汁为发酵底物的发酵方式(A2组、C2组)要优于以紫薯泥为底物的发酵方式(图2B、2D、2E);无氧发酵的方式(图2D)优于有氧发酵的方式(图2D);图2E组内对比发现,有氧发酵并未对α-葡萄糖苷酶的活性抑制产生较大影响。

图2 发酵紫薯制品对α-葡萄糖苷酶的活性抑制率Fig.2 Inhibition rate of α-glucosidase activity in fermented purple sweet potato products
对比图2A组中的单一乳酸菌发酵组(A1、B1、C1)发现,α-葡萄糖苷酶的活性抑制的影响,B1、C1相似,A1>B1、C1,并且图2B有相同的规律;在图2A混合乳酸菌发酵对比中,三种乳酸菌混合发酵组(ABC1)要稍优于其他组;而在图2B中植物乳杆菌与保加利亚乳杆菌亚种混合发酵组(AB2)抑制率最高。综合图2A与2B而言,单一植物乳杆菌发酵同样对α-葡萄糖苷酶的活性抑制效果较好,具有典型性。
对比图2C中单一酵母菌发酵组(D1、E1、F1)对α-葡萄糖苷酶的活性抑制率发现,低糖面包酵母(D1)>白酒酵母(E1)>葡萄酒酵母(F1),并且图2D有相同的规律;而在图2C与2D组内对比中,混合酵母菌发酵组均对α-葡萄糖苷酶的活性抑制率影响差异不大,均低于低糖面包酵母组(D1、D2)。综合图2C、2D,单一低糖面包酵母菌发酵同样对α-葡萄糖苷酶的活性抑制效果较好,具有典型性。
综合不同菌种及不同发酵方式发酵的紫薯制品对α-淀粉酶的活性抑制率以及α-葡萄糖苷酶的活性抑制率的对比,发现液体发酵普遍优于固体发酵,乳酸菌发酵中以单一植物乳杆菌发酵最为典型,其对α-淀粉酶的活性抑制率为54.8%,α-葡萄糖苷酶的活性抑制率为68.5%;而酵母菌发酵中则以单一低糖面包酵母发酵最为典型,其对α-淀粉酶的活性抑制率为63.5%,α-葡萄糖苷酶的活性抑制率为70.9%;最终选出对降血糖相关酶抑制效果最佳的发酵剂为低糖面包酵母,发酵方式为液体发酵。
2.2 发酵紫薯制品的成分分析
2.2.1 多糖含量及组分分析 植物多糖是研究最多的具有降血糖功能的天然提取物之一,例如黑木耳多糖能抑制α-葡萄糖苷酶的活性,并缓解己糖激酶、琥珀酸脱氢酶活性的降低;茶多糖能增强葡萄糖激酶和己糖激酶的活性;铁皮石斛多糖能促进胰岛素的分泌等[9],甚至有许多植物多糖提取物,如阿卡波糖等,已经被广泛应用到降血糖的治疗中。测定发酵前后紫薯制品的非淀粉多糖的含量变化及它的单糖组成有助于分析其对降血糖相关酶的影响。
由于多糖可能对降血糖相关酶产生影响,所以测定了发酵样品中的非淀粉多糖的含量,其结果见图3,图3为不同发酵紫薯样品中非淀粉多糖的含量对比图。由图3可知,除以紫薯泥为底物的酵母菌有氧发酵组外,其余发酵组的多糖含量均较未发酵组多糖含量有所提高,推测发酵提高了紫薯的多糖含量,其会对α-淀粉酶及α-葡萄糖苷酶的活性产生一定影响,这与益生菌利用糖产生功能性物质的研究相符[22]。其中未发酵组的多糖含量为2.21%,以紫薯汁为底物的植物乳杆菌发酵组为乳酸菌发酵组中多糖含量最高组,多糖含量达到3.51%,而以紫薯汁为底物的低糖面包酵母发酵组则为酵母菌发酵组中多糖含量最高组,多糖含量达到3.52%。有研究表明,紫薯的碱溶性多糖的单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖和葡萄糖[23],所以进一步对三组的非淀粉多糖的单糖组成进行测定研究,测定常见的单糖,能为推测对降血糖相关酶产生影响的多糖物质组成及其性质提供参考,其结果见表2。

图3 发酵紫薯制品的总糖含量Fig.3 Total polysaccharide content of fermented purple sweet potato products
表2为发酵样品中较为典型的样品和未发酵原样的非淀粉多糖的单糖组成。由表2所示,葡萄糖、果糖、阿拉伯糖、木糖、鼠李糖、甘露糖、半乳糖和岩藻糖的总含量并未占非淀粉多糖的全部组成,大约占78.48%~83.42%,而在这八种单糖组成中,葡萄糖占主要组成,含量超过了50%。但发酵组与未发酵组进行对比后可见,葡萄糖的比重在降低,由未发酵组76.49%下降至植物乳杆菌液体发酵组68.48%,低糖面包酵母液体发酵组66.99%,而其他微量单糖的组成均在不同程度的上升。而研究表明岩藻依聚糖具有潜在抑制α-淀粉酶活性的作用[24]。植物乳杆菌液体发酵组与低糖面包酵母液体发酵组对比可知,对于阿拉伯糖、鼠李糖、木糖、半乳糖的相对含量,植物乳杆菌液体发酵组比低糖面包酵母液体发酵组高,而对于岩藻糖、甘露糖、果糖的相对含量,植物乳杆菌液体发酵组比低糖面包酵母液体发酵组低。
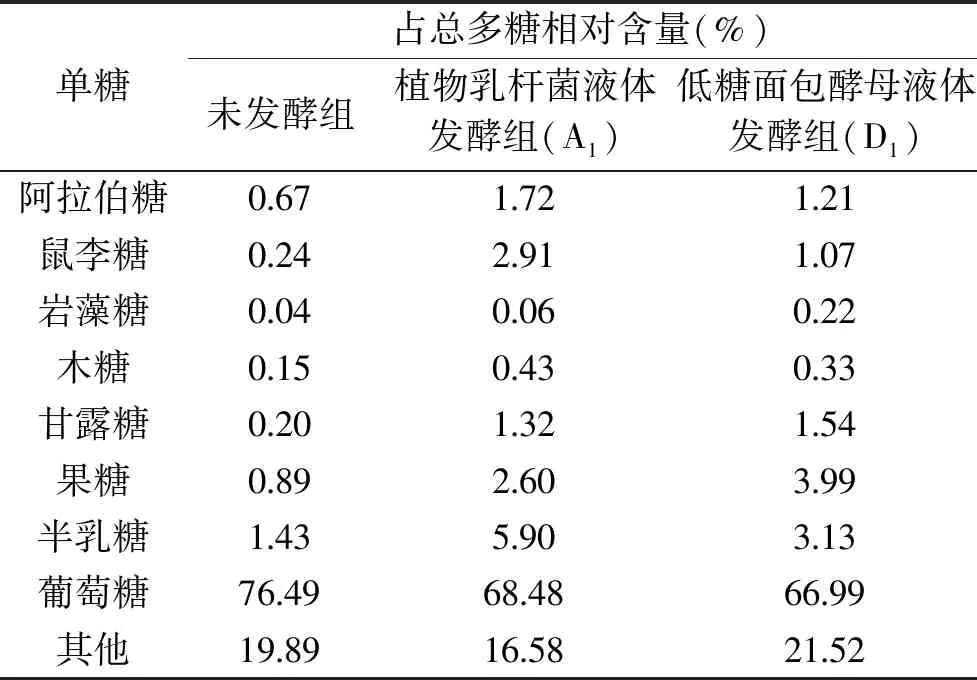
表2 典型发酵方式的发酵紫薯制品中多糖的组成Table 2 Composition of polysaccharides in fermented purple sweet potato products by typical fermentation methods
2.2.2 总多酚含量分析 与植物多糖一起作为天然降血糖提取物研究热点的还有植物中的多酚[9]。例如苹果多酚有抑制α-葡糖苷酶活性、加强葡萄糖向外周细胞的转运作用;茶多酚能抑制受试动物肠道内碳水化合物消化酶的活性,减少胰岛素细胞损伤等。所以要研究紫薯发酵前后降血糖相关酶活性抑制率的不同,同样需要对紫薯制品中的多酚进行检测。
图4为不同发酵紫薯样品中多酚含量对比图。由图4可知,发酵后的紫薯产品中的总酚含量大部分显著(P<0.05)高于未发酵的紫薯原样,仅有小部分低于紫薯原样,而低于原样组的α-葡萄糖苷酶和α-淀粉酶活性抑制率也没有显著提高,甚至低于未发酵组,说明发酵提高了样品中的多酚含量。其中未发酵组的多酚含量为0.49 mg/10 g,植物乳杆菌液体发酵组(A1)和低糖面包酵母液体发酵组(D1)多酚含量均达到0.78 mg/10 g,为含量最高组,因为在发酵过程中,植物细胞壁被破坏导致多酚被释放[10]。而以紫薯泥为底物的酵母有氧发酵组的多酚含量几乎均低于未发酵组,原因可能是在发酵过程中释放的多酚在有氧环境中被氧气氧化,导致含量降低[25]。由于图2中不同组之间的α-葡萄糖苷酶活性抑制率的变化规律与图4相似,而有相关研究表明酚类对降血糖相关酶有抑制作用[9],推测样品中的多酚同样可能对α-葡萄糖苷酶和α-淀粉酶活性有抑制作用。
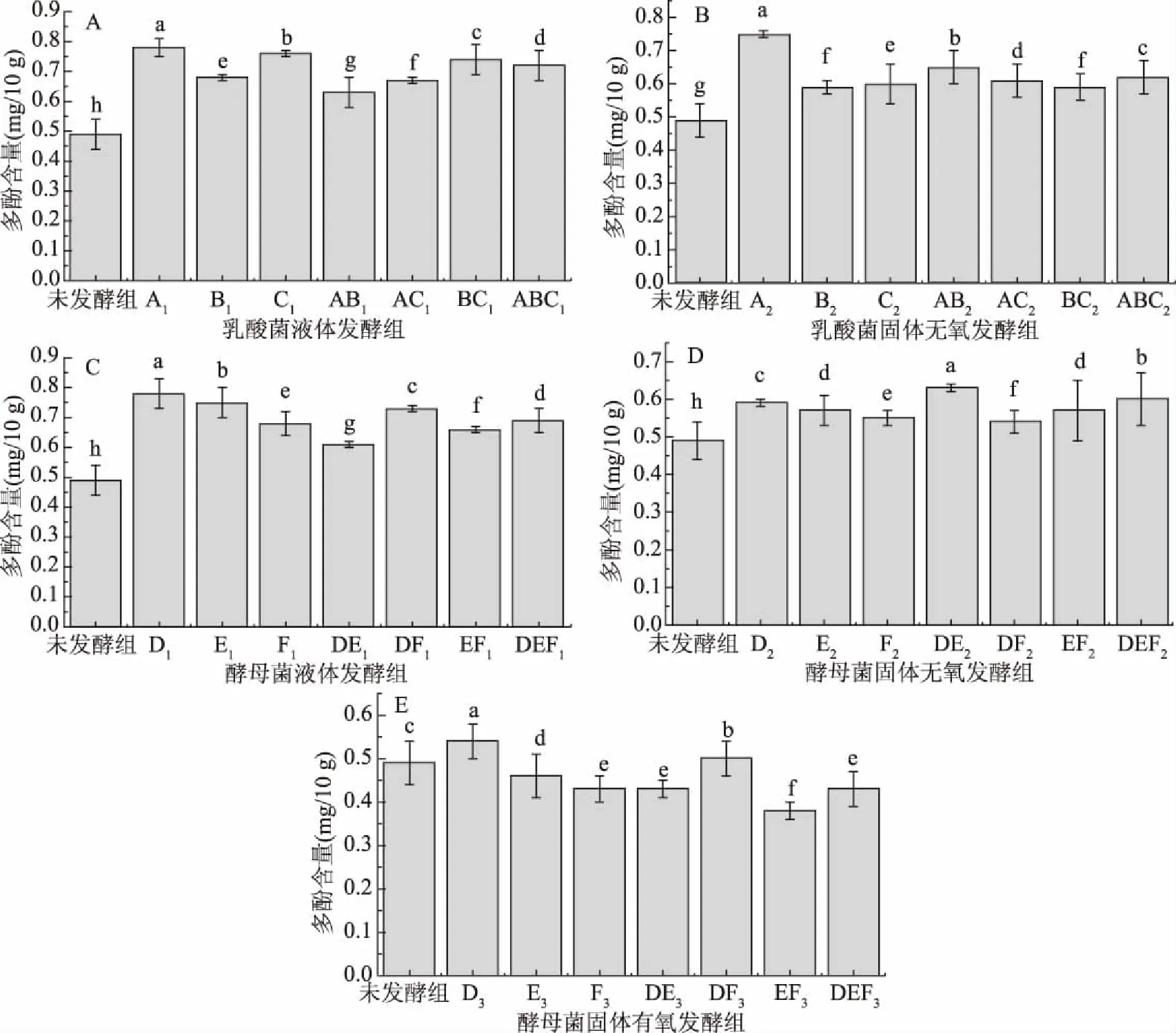
图4 发酵紫薯制品的多酚含量Fig.4 Polyphenol content of fermented purple sweet potato products
2.2.3 总黄酮含量分析 作为天然降血糖提取物的还有一个研究热点则是植物中的黄酮[9]。例如柑橘皮黄酮能增强机体免疫力、抗氧化作用和改善脂代谢紊乱;蜂胶总黄酮能清除体内自由基,提高机体抗氧化能力及修复受损的胰岛β细胞;葛根异黄酮有增强糖尿病小鼠的抗氧化能力,改善糖尿病小鼠的糖脂代谢的能力等等。所以研究紫薯发酵前后降血糖相关酶活性抑制率的不同,也需要对紫薯制品中的黄酮进行检测。
图5为不同发酵紫薯样品中黄酮的含量对比图。由图5可知,同样发酵后的紫薯产品中的总酮含量大部分高于未发酵的紫薯原样,仅有小部分低于未发酵的紫薯原样,说明发酵也同样提高了样品中的黄酮含量。其中未发酵组黄酮含量仅为2.24 mg/10 g,而植物乳杆菌液体发酵组(A1)和低糖面包酵母液体发酵组(D1)黄酮含量则达到了10.81和10.68 mg/10 g,几乎为未发酵组含量的5倍,而且除以紫薯泥为底物的酵母有氧发酵组外,其余发酵样品的黄酮含量全在6.9~11 mg/10 g之间,为未发酵组的3~5倍左右,而以紫薯泥为底物的酵母有氧发酵组的黄酮含量最低也达到4.39 mg/10 g。而黄酮含量经过发酵后整体升高的原因可能是由于发酵释放了黄酮类物质[26]。结合图1中不同组之间的α-淀粉酶活性抑制率的变化规律,并且同样有相关研究表明黄酮类物质对降血糖相关酶有抑制作用[9],推测样品中的黄酮也同样可能对α-葡萄糖苷酶和α-淀粉酶活性产生抑制作用。
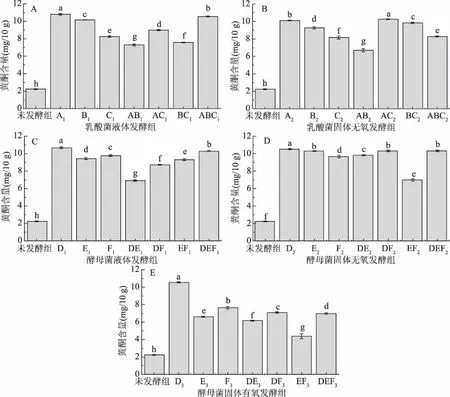
图5 发酵紫薯制品中的黄酮含量Fig.5 Flavonoids content of fermented purple sweet potato products
2.2.4 多酚黄酮组分分析 为进一步研究发酵制品中的多酚、黄酮含量变化对α-葡萄糖苷酶和α-淀粉酶活性抑制是否真的产生影响,对多酚黄酮含量均较高组及未发酵组的常见的多酚黄酮含量进行了检测对比,其结果见表3。有研究表明儿茶素的含量升高有助于提高α-淀粉酶活性抑制率[27],从表3中可以发现与发酵前相比,原儿茶酸的含量的确有所提高,推测发酵产生的多酚、黄酮含量变化对α-葡萄糖苷酶和α-淀粉酶活性抑制率造成了正面影响;而在植物乳杆菌液体发酵组(A1)中未检出表儿茶素,但与未发酵组相比,低糖面包酵母液体发酵组(D1)的表儿茶素含量显著(P<0.05)提高,但由于A1、D1两组对α-葡萄糖苷酶和α-淀粉酶活性抑制影响均较高,推测不同多酚黄酮成分对降血糖相关酶产生的影响途径不同;咖啡酸含量、氯化矢车菊素与未发酵组相比含量均有提高;在未发酵组中均为检测出对香豆酸和阿魏酸,但在A1、D1两组中均检出少量对香豆酸和阿魏酸,与此相似的是用米曲霉等霉菌进行发酵时,阿魏酸与对香豆酸的含量也有提高[24];但与未发酵组相比,芦丁含量显著降低(P<0.05),推测可能是在黄酮多酚被释放出来的同时也发生了成分转换,但这些成分对α-葡萄糖苷酶和α-淀粉酶活性分别造成了哪些影响还需对这些成分进行分离和分析。并且,有研究表明紫薯还有其他多种多酚黄酮,而这些多酚黄酮对α-葡萄糖苷酶和α-淀粉酶活性是否造成影响任需进一步检测[28]。

表3 典型发酵方式发酵组中的多酚黄酮含量Table 3 Flavonoid content in the fermentation group under typical fermentation mode
3 结论
本文研究了植物乳杆菌、保加利亚乳杆菌亚种、嗜热链球菌、低糖面包酵母、白酒酵母、葡萄酒酵母的单菌或其混合菌发酵紫薯泥或紫薯汁的发酵制品抑制降血糖相关的α-淀粉酶和α-葡萄糖苷酶效果。对比不同发酵制品对α-淀粉酶、α-葡萄糖苷酶的活性抑制效果,发酵均提高了制品的活性抑制效果,单一菌优于混合菌发酵制品,紫薯汁优于紫薯泥发酵制品。以植物乳杆菌液体发酵组与低糖面包酵母液体发酵组为典型发酵组。其中低糖面包酵母的紫薯汁发酵制品对降血糖相关酶的活性抑制率最高,对α-淀粉酶的活性抑制率达到63.5%,对α-葡萄糖苷酶的活性抑制率达到70.9%。同时,发酵紫薯制品中非淀粉多糖、总酚、总酮含量对比未发酵紫薯均有提高。低糖面包酵母的紫薯汁发酵制品中非淀粉多糖含量为3.52%,总酚含量为10.68 mg/10 g,总酮含量为0.78 mg/10 g。本文对进一步探讨发酵紫薯产品如何抑制降血糖相关酶代谢机理提供了理论基础,并为开发紫薯降血糖功能产品提供参考。

