鸡肉酶解物对HepG2细胞抗氧化活性及小鼠血清抗氧化酶活性的影响
,2,*
(1.华南农业大学食品学院,广东广州 510642;2.畜禽产品精准加工和安全控制技术国家地方联合工程研究中心,广东广州 510642)
2107年我国禽肉产量为2344.82万t,其中鸡肉占63%,达1477万t[1]。分割是目前我国肉鸡加工的主要方式,鸡胸肉是肉鸡分割中价格较低廉的产品。鸡鸡胸肉具有高蛋白、低脂肪、多维生素和微量元素的特点,是一种富含优质蛋白质的食材,每100 g鸡肉中含有蛋白质21.73 g[2],鸡肉蛋白质的氨基酸组成比例平衡,检测得到鲜味氨基酸和抗氧化性氨基酸含量较高[3]。

本文在前期研究得出鸡肉盐溶蛋白酶解物SSPH(Salt-Soluble Protein Hydrolysate,SSPH)和鸡肉肌纤蛋白酶解物MFH(Muscle Fibrin Hydrolysate,MFH)具有良好体外抗氧化效果的基础上[10,15],开展了HepG2细胞抗氧化和小鼠体内抗氧化酶活性的研究。
1 材料与方法
1.1 材料与仪器
鸡胸肉(黄羽肉鸡) 广州市江丰实业股份有限公司卓味家禽加工厂提供;酸性蛋白酶(10万U/g,实测9.8万U/g) 南宁庞博生物工程有限公司;人肝癌细胞株HepG2 购自中国科学院肿瘤细胞库;昆明种雄性小白鼠(Specific pathogen Free,SPF级) 广东省医学动物实验中心[实验动物生产许可证号:SCXK(粤)2013-0002];舒克贝塔实验鼠维持饲料(小鼠饲料)[全价颗粒饲料,生产许可证:苏饲证(2014)01008,营养成分执行标准:GB 14924.3-2010,其中,饲料中的粗蛋白含量≥180 g/kg] 江苏省协同医生物工程有限责任公司;过氧化氢酶试剂盒(货号:A007-1-1)、超氧化物歧化酶试剂盒(货号:A001-3)、谷胱甘肽过氧化物酶试剂盒(货号:A005) 南京建成生物工程研究所;DMSO(Dimethyl sulfoxide二甲基亚砜)、胎牛血清(fetal bovine serum,FBS);青-链霉素溶液(双抗)、DEME高糖培养基;HBSS(Hank’s Balanced Salt Solution,Hank’s平衡盐溶液)、PBS(Phosphate buffered solution,磷酸盐缓冲液) 均为细胞级,Gibco公司;MTT[Thiazolyl Blue Tetrazolium Bromide,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]、AAPH(2,2′-azobis[2-methylpropionamidine]dihydrochloride,偶氮二异丁脒盐酸盐)、荧光素钠、DCFH-DA(2′,7′-Dichlorodihydrofluorescein diacetate,2′,7′-二氯荧光黄双乙酸盐) 均为细胞级,Sigma公司;其他试剂和药品 均为分析纯。
多功能酶标仪 美国PerkinElmer;Costa 96孔板美国Corning;25 cm2-透气盖细胞培养瓶 美国Corning;CO2细胞培养箱 新加坡ESCO;UV1240分光光度计 岛津;DY89-Ⅱ型电动玻璃匀浆机 宁波新芝公司。
1.2 实验方法
1.2.1 酸性蛋白酶酶解制备鸡肉酶解产物 以鸡胸肉为原料,经特定工艺提取鸡肉盐溶蛋白(Salt-Soluble Protein,SSP)及鸡肉肌纤蛋白(Muscle Fibrin,MF),经酸性蛋白酶酶解制备获得深度酶解的鸡肉盐溶蛋白酶解物SSPH和肌纤蛋白酶解物MFH。SSP酶解条件:底物浓度为7.0%(w/v)蛋白质含量、E∶S=1 ku/g蛋白质、温度45 ℃、pH4.0、酶解8 h,酶解物中肽(含氮物)含量27.33 mg/mL;MF酶解条件:底物浓度为7.0%(w/v)蛋白质含量、E:S=3 ku/g蛋白质、温度45 ℃、pH4.5、酶解8 h,酶解物中肽(含氮物)含量32.31 mg/mL。采用高效凝胶色谱法(色谱柱:TSKgel 2000 SWXL 300 mm×7.8 mm)对SSPH及FMH进行分子量分布检测,结果如表1所示。

表1 鸡肉酶解物SSPH与MFH分子量分布所占百分含量(%)Table 1 The molecular weight distribution ofchicken enzymatic lysates SSPH and MFH(%)
1.2.2 鸡肉酶解物HepG2细胞的抗氧化活性实验
1.2.2.1 HepG2细胞培养 将HepG2细胞按常规方法复苏后,置于含有质量分数10%胎牛血清、1%非必需氨基酸、1% L-谷氨酰胺和1%双抗的低糖DMEM培养液中,37 ℃、5% CO2的湿润培养箱中进行培养,隔天更换培养液,待细胞贴壁融合率达80%左右时,用含质量分数0.02% EDTA的0.25%胰酶消化细胞,按1∶3传代。取对数生长期细胞进行实验[16]。

表2 小鼠实验分组表Table 2 Mice experimental grouping table
1.2.2.2 鸡肉酶解物对HepG2细胞存活率的影响 为避免鸡肉酶解物对细胞的毒性作用,确定后续实验的样品浓度,进行不同浓度条件下样品对HepG2细胞的存活率实验。取对数期的HepG2细胞配制成浓度为6×104个/mL的悬液,接种到Costa 96孔板中,每孔加100 μL,于培养箱中进行贴壁培养24 h。培养结束后弃去培养基,用PBS清洗细胞3次,样品组加入鸡肉酶解物,使培养孔中样品最终浓度分别为50、125、250、500、1000 μg/mL,对照组加入相同体积的无FBS培养液,每组设置5个平行孔,分别于24、48、72、96 h在每孔中加入20 μL浓度为5 mg/mL的MTT试剂,4 h后吸出培养液,加入DMSO 150 μL溶解沉淀,测定490 nm处吸光值,按照式(1)计算细胞存活率[17]。
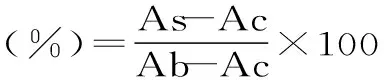
式(1)
式中:As:样品组吸光值;Ab:对照组吸光值;Ac:空白组吸光值。
1.2.2.3 鸡肉酶解物对HepG2细胞的荧光强度影响 采用细胞内荧光强度测定法,参考文献[18]。取对数期的HepG2细胞,接种于Costa 96孔板,每孔100μL,约6×104个/mL,加入用DMEM基础培养基稀释好的DCFH-DA液100 μL与样品溶液,使得DCFH-DA终浓度为25 μmol/L,鸡肉酶解物最终浓度为12.5、25、50、75、125、250 μg/mL,每个浓度设置5个孔,在37 ℃,5%的CO2培养箱中培养60 min后弃去培养液,加入浓度600 μmol/L ABAP液100 μL,反应10 min,用多功能酶标仪测其荧光值TC。测定条件:温度37 ℃,发射波长538 nm,激发波长485 nm,每5 min测定一次,跟踪测定1 h,得到荧光值TC。用 DCFH-DA溶液与含有浓度600 μmol/L的AAPH的HBSS液处理的细胞为阳性对照PC;用DCFH-DA溶液与不含有AAPH的HBSS处理的细胞为阴性对照NC。
1.2.2.4 鸡肉酶解物对HepG2细胞的抗氧化活性影响 用Origin 8.0软件计算时间-荧光强度曲线下的积分面积,并按照式(2)计算细胞内抗氧化活性值(cellular antioxidant activity,CAA)。
式(2)

1.2.3 鸡肉酶解物对小鼠体内抗氧化酶活性的影响
1.2.3.1 实验小鼠准备 选用4周龄雄性成年昆明种小鼠,适应性喂养(温度保持22±2 ℃,相对湿度保持50%±10%,噪音<60 dB,模拟白天和晚上的时间间隔为12 h,自由进食和饮水);一周后,体重达(27±0.6) g,开始实验[19]。
1.2.3.2 实验小鼠分组 将60只小鼠随机分为6组,每组10只,实验前逐只称重,使组间初重差异不显著(P>0.05)。设置生理盐水对照组(Saline control,SC)和鸡肉匀浆对照组(chicken homogenate control)CHC;实验组为SSPH和MFH,分别设置40和200 mg/kg·bw·d两个剂量,每只胃饲(灌胃方法)容量均0.2 mL/d[4]。实验分组如表2所示。
1.2.3.3 小鼠饲养 实验小鼠集中饲养于华南农业大学动物实验中心[许可证编号:SYXK(粤)2014-0136]。每天上午10:00~11:00按时胃饲,定期称重,实验为期28 d。
1.2.3.4 血清抗氧化酶活性测定 末次小鼠胃饲后经30 min休息,将小鼠放入放于水深为30 cm,水温为(25±1) ℃的实验水箱中游泳30 min后取出,目内眦静脉采血,血液经3000 r/min离心10 min,收集上层血清,用于测定各项抗氧化酶活性。
谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)的活性测定:采用分光光度法,分别参照相应试剂盒说明书测定。其中,GSH-Px酶活定义为扣除非酶促反应作用,使反应体系中GSH浓度降低1 μmol/L为一个酶活力单位(U);SOD酶活,以SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U);CAT酶活为反应体系中1 mL血清1 s分解1 μmol/L的H2O2的量为一个活力单位(U)。
1.3 数据处理
采用SPSS 19、统计软件进行单因素方差分析ANOVA,组间比较用LSD法,采用Origin 8进行面积积分计算,用Excel进行实验数据做图。
2 结果与分析
2.1 鸡肉酶解物对HepG2细胞抗氧化活性的影响
2.1.1 鸡肉酶解物浓度对细胞活性的影响 为了解鸡肉酶解物是否对HepG2细胞存在毒性作用,确定后续实验的样品浓度,进行不同浓度条件下样品对HepG2细胞的存活率实验,实验结果如图1所示。
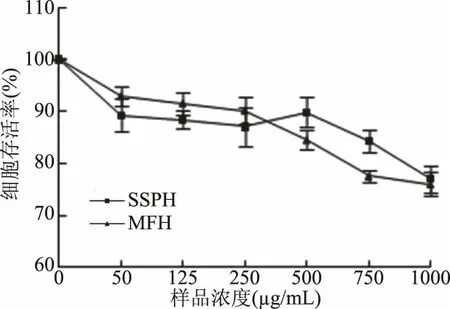
图1 鸡肉酶解物浓度对HepG2细胞存活率的影响Fig.1 Effect of chicken enzymatic hydrolysatesconcentration on the survival rate of HepG2 cells
图1结果显示,鸡肉酶解物SSPH浓度在50~500 μg/mL范围内,HepG2细胞的成活率均介于87.02%~89.87%;MFH浓度在50~250 μg/mL范围内,HepG2细胞的成活率均大于90%,浓度500 μg/mL时降为84.50%,浓度增加导致细胞成活率降低。图1结果表明,鸡肉酶解物SSPH及MFH对HepG2细胞均不存在毒性,高浓度条件下细胞成活率降低,应该是因为高渗透压引起的。
2.1.2 鸡肉酶解物对HepG2细胞抗氧化活性的影响
2.1.2.1 鸡肉酶解物对HepG2细胞的荧光强度的影响 鸡肉酶解物对HepG2细胞荧光强度的实验结果如图2所示。
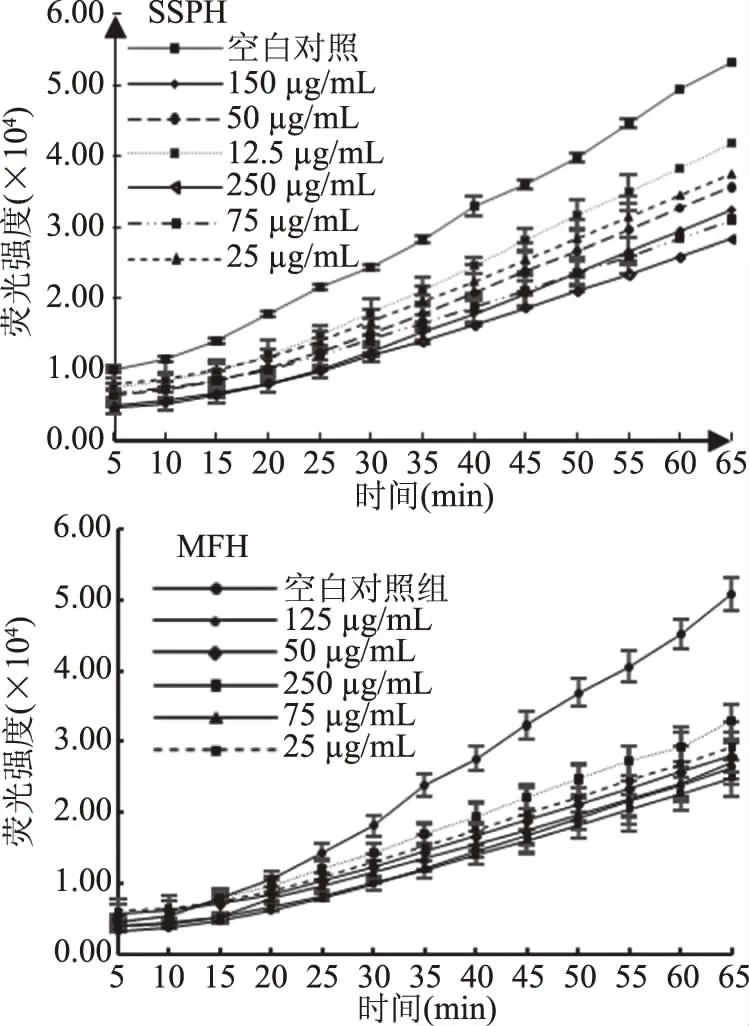
图2 鸡肉酶解物对HepG2细胞荧光强度的影响Fig.2 Effect of chicken enzymatic hydrolysateson fluorescence intensity of HepG2 cells
图2结果显示,HepG2细胞荧光强度随鸡肉酶解物浓度的增加而呈下降趋势,且鸡肉酶解物对HepG2细胞荧光强度与空白组相比均有显著性差异(P<0.05)。DCFH-DA是非标记性的氧化敏感的荧光探针,本身无荧光,可穿过细胞膜进入细胞后,被细胞内的酯酶水解,生成不能通透细胞膜且无荧光的DCFH,DCFH-DA荧光探针很容易地被装载到细胞内。进入细胞内的ABAP裂解成活性氧(ROS),可将DCFH氧化生成带有荧光的DCF,通过检测DCF的荧光强度来判断细胞内活性氧的水平,荧光强度与细胞内活性氧水平呈正比。图2结果表明,鸡肉酶解物SSPH及MFH均能显著降低(P<0.05)HepG2细胞内荧光强度,消除细胞内活性氧,提示SSPH及MFH均有明显的抗氧化活性,且呈良好的剂量-效应关系。细胞抗氧化活性实验中采用ABAP作为自由基来源,其产生的自由基性质更接近于生物体自然状态下产生的自由基,因此可以更好地分析抗氧化物质对由自由基引起的生物膜和细胞内物质损失的抑制作用[20-21]。
2.1.2.2 鸡肉酶解物对HepG2细胞的细胞抗氧化活性的影响 CAA是一种模拟生理条件,基于细胞模型的抗氧化实验方法[22]。将鸡肉酶解物对HepG2细胞的荧光强度用Origin 8.0软件进行积分面积,获得鸡肉酶解物抑制ROS氧化DCFH的剂量-效应曲线,结果如图3所示。
图3结果显示,鸡肉酶解物SSPH及MFH均有明显的抗氧化活性,并且存在一定的剂量-效应关系,即抗氧化效果随SSPH及MFH浓度的增加而增强,当SSPH及MFH的浓度为150 μg/mL时,CAA值分别达到43.17%和46.64%,250 μg/mL时,CAA值分别达到48.03%和47.95%。结果表明,鸡肉酶解物SSPH、MFH均具有良好的细胞ROS清除能力,且具有量效关系;鸡肉酶解物MFH的清除细胞ROS能力比同等浓度的SSPH高。刘艳等[23]对乌鸡低聚肽的细胞抗氧化研究结果显示,最佳的抗氧化浓度达1000 μg/mL,Halldorsdottir等[24]研究的鳕鱼蛋白酶解产物的ROS最强清除能力40%,因此,本研究鸡肉酶解物的细胞抗氧化效果更优。
2.3 鸡肉酶解物对小鼠血清抗氧化酶活性的影响
鸡肉酶解物小鼠血清SOD、CAT及GSH-Px等抗氧化酶活性的影响结果如表3所示。

表3 鸡肉酶解物对小鼠血清抗氧化酶活性的影响Table 3 Effect of chicken enzymatic hydrolysates on antioxidative enzyme activity of mouse serum
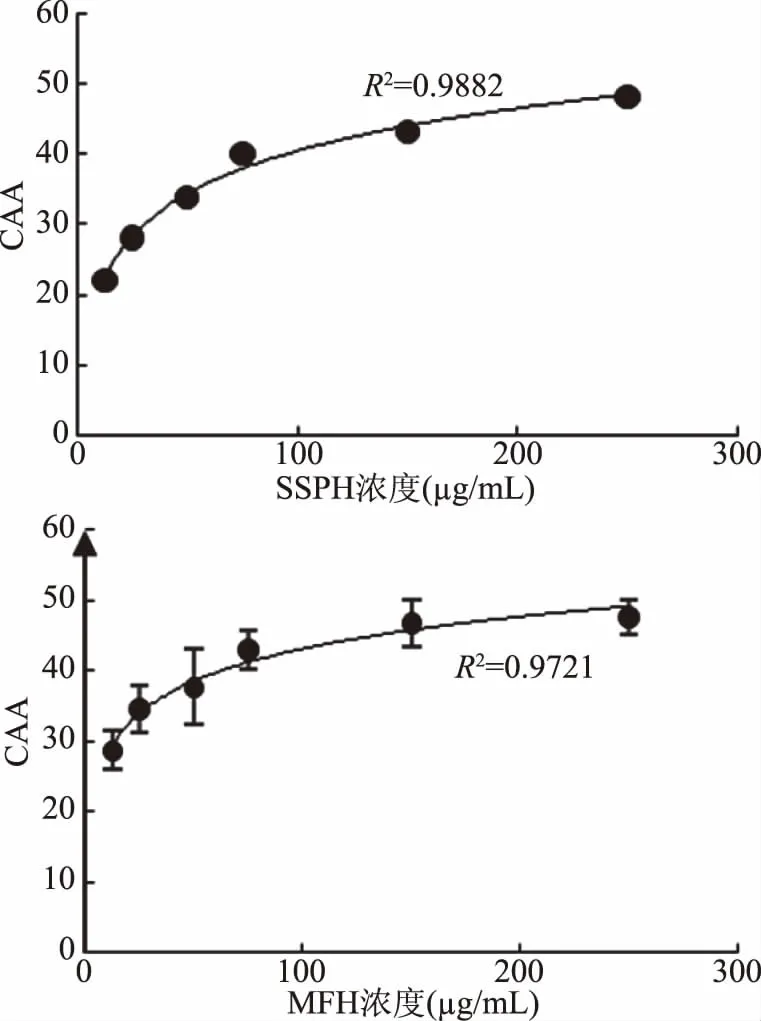
图3 鸡肉酶解物抑制ROS氧化DCFH的剂量-效应曲线图Fig.3 Dose-effect curve of chicken enzymatichydrolysates inhibiting ROS oxidation of DCFH
表3结果显示,鸡肉匀浆对照组除GSH-Px酶活显著高于(P<0.05)生理盐水对照组外,SOD及CAT酶活均差异不显著(P>0.05)。高剂量SSPH小鼠血清中的SOD、CAT及GSH-Px三种抗氧化酶酶活性均极显著高于(P<0.01)生理盐水对照组及鸡肉匀浆对照组;低剂量SSPH小鼠血清SOD酶活显著高于(P<0.05)鸡肉匀浆及生理盐水对照组,GSH-Px酶活极显著高于(P<0.01)生理盐水对照组,但与鸡肉匀浆组间差异不显著,CAT酶活与两个对照组间差异不显著(P>0.05)。高剂量MFH小鼠血清中的SOD及GSH-Px两种抗氧化酶活性均极显著高于(P<0.01)鸡肉匀浆对照组及生理盐水对照组,CAT酶活显著高于(P<0.05)两对照组;低剂量MFH小鼠血清SOD及CAT酶活显著高于(P<0.05)生理盐水对照组,GSH-Px酶活极显著高于(P<0.01)生理盐水对照组,而与高剂量鸡肉匀浆对照组相比,三种抗氧化酶的酶活均差异不显著(P>0.05)。生物体代谢过程中通常伴随着产生自由基,它们会损伤蛋白质、核酸、物膜,加速机体的衰老和死亡。生物体内有一套完善的抗氧化酶系统,使自由基的产生与消除处于动态平衡。生物抗氧化酶系统的主要成员包括:超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)等[25]。研究结果表明,鸡肉蛋白质经深度酶解处理后,能够有效提高其对小鼠抗氧化酶活性。研究结果与林琳等[26]、Sun等[27]及Nazeer等[28]的研究成果相一致,动物源性蛋白质酶解物具有较强的抗氧化活性,表现在提高小鼠或大鼠血液中SOD、CAT和GSH-Px的活力,通过增强机体抗氧化酶的活力,增强机体清除自由基的能力,维持着机体内部氧化-抗氧化作用的动态平衡,保证生物体的正常生命活动。
3 结论
通过鸡肉酶解物SSPH及MFH对HepG2细胞抗氧化活性分析,结果显示,当SSPH及MFH的浓度为150 μg/mL时,细胞抗氧化活性CAA值分别达到43.17%和46.64%,表明二者均具有良好的HepG2细胞ROS清除能力,且呈良好的剂量-效应关系。在HepG2细胞培养中,鸡肉酶解物SSPH和MFH的添加浓度为500 μg/mL时,HepG2细胞的成活率为84.50%和89.87%,鸡肉酶解物对HepG2细胞均不存在毒性。细胞抗氧化实验中,实验组的HepG2细胞内荧光强度均显著低于(P<0.05)空白对照组,并随鸡肉酶解物浓度增加而降低。通过鸡肉酶解物SSPH及MFH对小鼠体内抗氧化酶活性的分析,结果显示,胃饲剂量为40 mg/kg·bw·d的SSPH组的CAT酶活性与生理盐水及鸡肉匀浆对照组间差异不显著,给小鼠胃饲鸡肉酶解物SSPH及MFH剂量为200 mg/kg·bw·d后,小鼠血清中的SOD、CAT及GSH-Px抗氧化酶活性均极显著(P<0.01)或显著(P<0.05)高于生理盐水对照组及同剂量鸡肉匀浆对照组,表明鸡肉酶解物SSPH及MFH能有效提高小鼠体内抗氧化酶活性,促进实验小鼠的体内抗氧化能力。

