高效毛细管电泳法测定羊肚菌(Morchella sextelata)菌丝中单核苷类化合物含量的研究
马晓颖,吕立涛,曹 君,李 跃,王 红
(辽宁省农业科学院食用菌研究所,辽宁省食用菌优质栽培重点实验室,辽宁沈阳 110161)
羊肚菌(Morchella)是一种子囊菌,它味道鲜美,香味独特,营养丰富,保健功能全。现代医学研究表明,羊肚菌有“四抗”“两降”“一调节”的药用功效,即抗射线、抗肿瘤、抗氧化、抗疲劳作用,降血压、降血脂和调节免疫力的功效[1]。它既是宴会上的珍品,又是医药中久负盛名的良药[2],具有很大的研究价值。羊肚菌中有很多功能性物质,包括多糖、氨基酸和一些核苷类化合物[1]。核苷类成分具有降血脂、预防血栓及血管疾病、维持细胞生命、免疫调节、改善脑细胞代谢以及调节中枢神经等多种生理活性[3-4]。核苷类多被用于抗肿瘤抗病毒的药物中,核苷类是治疗肝炎及艾滋病等病毒性疾病的首选药物[5]。
目前被发现的“长寿药”烟酰胺单核苷酸(NMN)也是一种单核苷类化合物,有研究发现,NMN能够显著改善小鼠的生理机能的衰退,可以增强能量代谢,改善胰岛素敏感性和血浆中脂质的分布情况,并且改善眼部功能[6]。在食用菌中,已经报道的含有单核苷类化合物的有虫草[7]、猴头菇、香菇[8]等,研究发现羊肚菌的主要成分有多糖、氨基酸、脂肪酸和一些无机元素和色素等[9],单核苷类化合物研究较少,核苷类化合物检测方法有很多种,目前一般采用高效液相色谱的方法进行测定[10-12],高效液相可以不受分析对象挥发性和热稳定性的限制,并且应用范围较广;但是样品分析时间长、色谱柱易污染、分析运营成本高;毛细管电泳法的特点是样品预处理简单,同时可测定多个成分的含量,较高效液相法简便、快速;薄层色谱扫描法和紫外可见分光光度法的特点是仪器设备要求低,操作简便,但方法的灵敏度和重现性差[13]。且未见有关于高效毛细管电泳测定羊肚菌单核苷类化合物含量的报道。
本文以羊肚菌Morchellasextelata菌丝提取物为测定目标,利用高效毛细管-二极管阵列检测器来测定其中的单核苷化合物(3-脱氧腺苷,腺苷,鸟苷,尿苷,肌苷)的种类和含量,该方法简单可靠,重复性好,不仅可用于羊肚菌中单核苷类化合物含量的测定,对其他样品中的单核苷化合物的定性,定量检测都有一定的参考价值。
1 材料与方法
1.1 材料与仪器
羊肚菌(Morchellasextelata) 来源于辽宁省农科院食用菌研究所;野生羊肚菌Mes-6、Mes-9 采集于辽宁省沈阳市康平县;梯棱羊肚菌(Morchellaimportuna)和七妹羊肚菌(Morchellaseptimelata) 购于四川农科院;硼砂Na2B4O7、硼酸H3BO3、磷酸氢二钠Na2HPO4、磷酸二氢钠NaH2PO4色谱纯,美国Amresco生物试剂公司;单核苷化合物标准品、十二烷基磺酸钠 色谱纯,北京索莱宝科技有限公司;β-环糊精 分析纯,上海源叶生物科技有限公司;甲醇 色谱纯,国药集团化学试剂有限公司;试验用水 为超纯水;马铃薯液体培养基:将200 g马铃薯去皮切碎,煮烂后取得土豆汁,加入20 g葡萄糖或者蔗糖,加入琼脂15~20 g,加水至1000 mL,121 ℃灭菌即可。
P/ACE MDQ毛细管电泳仪 美国贝克曼公司;PHS-3C精密pH计 上海雷磁科技发展有限责任公司;ME204E电子天平 梅特勒-托利多仪器有限公司;HQ5200超声波清洗器 昆山市超声仪器有限公司;HZQ-QX全温振荡器 哈尔滨市东联电子技术开发有限公司;GRX6热空气消毒箱 上海精宏实验设备有限公司;T25匀浆机 德国IKA集团;CascadaTM实验室超纯水系统 Pall corporation;微孔滤膜 水系和有机系孔径0.22 μm,津隆设备有限公司。
1.2 实验方法
1.2.1 标准品的配制 用精密天平分别称取3-脱氧腺苷、腺苷、鸟苷、尿苷、肌苷适量,用50%甲醇溶解并定容配制成1.0 mg/mL的标准液,上述溶液均用0.22 μm孔径的有机滤膜滤过,超声除气,置冰箱4 ℃避光保存。
1.2.2 羊肚菌菌丝提取物的提取方法确定 将羊肚菌Morchellasextelata菌种活化以1∶200比例接种于马铃薯液体培养基中,25 ℃,180 r/min摇床培养7 d。将发酵液过滤后,菌丝体用无菌水冲洗3次,放入空气消毒箱里60 ℃烘干得干菌丝体,称取1 g放入50 mL离心管中,加入30 mL超纯水,用匀浆机打匀;然后利用以下三种方式进行提取:a超声提取30 min;在水浴锅中95 ℃加热保温提取2 h;b选取单独超声30 min;c单独水浴锅95 ℃加热保温提取2 h;三种方法进行样品的提取,通过比对不同提取方式下羊肚菌菌丝的指纹图谱来确定实验提取方法。
1.2.3 电泳条件的确定 高效毛细管电泳DAD二极管检测器检测,检测器工作环境要干燥,环境湿度不大于80%,温度变化小,且检测过程中仪器不要摇动,接通电泳后仪器要预热30 min后使用。
1.2.3.1 紫外检测波长 利用毛细管电泳DAD二极管检测器对5种单核苷类化合物(3-脱氧腺苷、腺苷、鸟苷、尿苷、肌苷)进行190~300 nm波长下吸收值的测定,选择最佳的试验波长。
1.2.3.2 运行电压的确定 本试验考察15、18、20、25、30 kV作为运行分离电压对分离5种单核苷类化合物的影响,波长为1.2.3.1中筛选出的最佳试验波长,运行缓冲液为pH9.0的25 mmol/L硼砂缓冲液,压力0.5 Psi进样10 s,运行时间为60 min。
1.2.3.3 缓冲液pH的确定 本试验考察pH9.0、9.2、9.4和9.6的硼砂缓冲液为运行缓冲液pH对分离5种单核苷类化合物的影响,波长为1.2.3.1中筛选出的最佳试验波长,运行缓冲液其他条件为25 mmol/L硼砂缓冲液,运行电压为20 kV,压力0.5 Psi进样10 s,运行时间为60 min。
1.2.3.4 缓冲液浓度的确定 实验考察10、20、30、50 mmol/L的硼砂缓冲液对分离5种单核苷类化合物的影响,波长为1.2.3.1中筛选出的最佳试验波长运行缓冲液其他条件为pH9.0硼砂缓冲液,运行电压为20 kV,压力0.5 Psi进样10 s,运行时间为60 min。
1.2.3.5 活性添加剂的确定 分别考察0.5、1.0、1.5、2.0 mg/mL浓度的β-环糊精对分离5种单核苷类化合物的影响,将β-环糊精加入到缓冲液中(样品中稀释一倍的缓冲液同样添加),波长为1.2.3.1中筛选出的最佳试验波长,运行缓冲液为pH9.0的25 mmol/L硼砂缓冲液,运行电压为20 kV,压力0.5Psi进样10s,运行时间为60 min。
1.2.3.6 进样时间的确定 试验分别考察5、8、10、15 s进样时间对分离5种单核苷类化合物的影响,波长为1.2.3.1中筛选出的最佳试验波长,运行缓冲液为pH9.0的25 mmol/L硼砂缓冲液,运行电压为20 kV,运行时间为60 min。
1.2.4 方法精密度、稳定性 取标准品溶液配制成0.05 mg/mL连续进样测定3次,记录迁移时间和峰面积,计算出峰时间和峰面积的RSD值,确定方法的精密度;分别取50 μL的5种标准品1.0 mg/mL混合到一起,在室温下放置0、2、4、6、8 h后,在最佳电泳条件下分别进样,每次3个重复,计算迁移时间和面积的RSD值确定方法的稳定性。
1.2.5 羊肚菌(Morchellasextelata)样品的测定 高效毛细管电泳对羊肚菌(Morchellasextelata)中单核苷类化合物的测定采用内标法(5种标准品混合物),将5种标准品(1 mg/mL)各吸取40 μL配制成混合标样,再分别加入等比例的处理好的羊肚菌菌丝提取物中,剩下的用缓冲液定容到200 μL,将混合标样、羊肚菌菌丝提取物以及羊肚菌菌丝提取物加混标分别进样,每一种样品进样3次。按优化得出的最优电泳条件进行测定。
1.2.6 羊肚菌其他菌种中单核苷化合物的测定 本试验所选择的羊肚菌菌种为六妹羊肚菌(Morchellasextelata),是目前较为常用的人工栽培羊肚菌的菌种,抗杂能力强,产量高,菌种稳定性好。实验也收集了一些其他羊肚菌品种,有一部分是野生的,一部分是人工可栽培的。野生羊肚菌Mes-6、Mes-9、梯棱羊肚菌(Morchellaimportuna)和七妹羊肚菌(Morchellaseptimelata)菌丝按照最优提取方法处理,对它们进行处理后,用最优电泳条件进行样品的分离,测定它们的单核苷含量。
1.3 数据处理
采用Excel软件处理数据。
2 结果与分析
2.1 羊肚菌菌丝样品提取方法的确定
在本实验中对羊肚菌菌丝提取方法进行了优化,采用60 ℃烘干得干菌丝体,称取1 g放入50 mL离心管中,加入30 mL超纯水,用匀浆机打匀,然后利用三种方法进行样品的提取,通过比对不同提取方式下羊肚菌菌丝的指纹图谱来确定实验提取方法。结果如图1所示,单独超声和单独水浴的提取方法使得毛细管电泳的指纹图谱不完整,可能是由于提取不彻底导致,所以选择先超声后水浴的方法为最后的提取方法。

图1 不同提取方法对羊肚菌指纹图谱的影响 Fig.1 Effects of different extraction methodson the fingerprint of Morchella注:a超声提取30 min,在水浴锅中95 ℃加热保温2 h;b选取单独超声30 min;c单独水浴锅95 ℃加热保温2 h。
2.2 紫外检测波长的确定
通过实验测得:3-脱氧腺苷190~219 nm吸收值最高;腺苷是190~223 nm和247~275 nm;鸟苷是190~228 nm和237~285 nm;尿苷是190~218 nm;肌苷是190~214 nm。且3-脱氧腺苷在190~212 nm间有一个干扰峰,所以选择214 nm为试验的运行波长(图2)。

图2 5种标准品214 nm下的吸收图谱Fig.2 Absorption spectra of five standards at 214 nm注:A:3-脱氧腺苷;B:腺苷;C:鸟苷;D:尿苷;E:肌苷;图3~图5,图8同。
2.3 运行电压对样品分离效果的影响
在毛细管电泳中,分离电压对样品的分离度和迁移时间有很大的影响。要尽可能选用比较高的电压,以达到样品分离的最佳状态,但是电压越高各个物质的距离越近,这样迁移时间比较近的物质就容易分不开,所以根据分离的物质不同,选取的分离电压需要优化,以达到最佳的分离效果。图3表明:随着电压的增高,5种单核苷类的迁移时间都向前移动,分离的顺序为3-脱氧腺苷、腺苷、鸟苷、尿苷和肌苷。其中15 kV和18 kV分离时间过长,20 kV以上均可达到20 min内分离5种单核苷化合物的目的,但是30 kV鸟苷和尿苷的分离度过低,所以选择25 kV为本试验的分离电压。
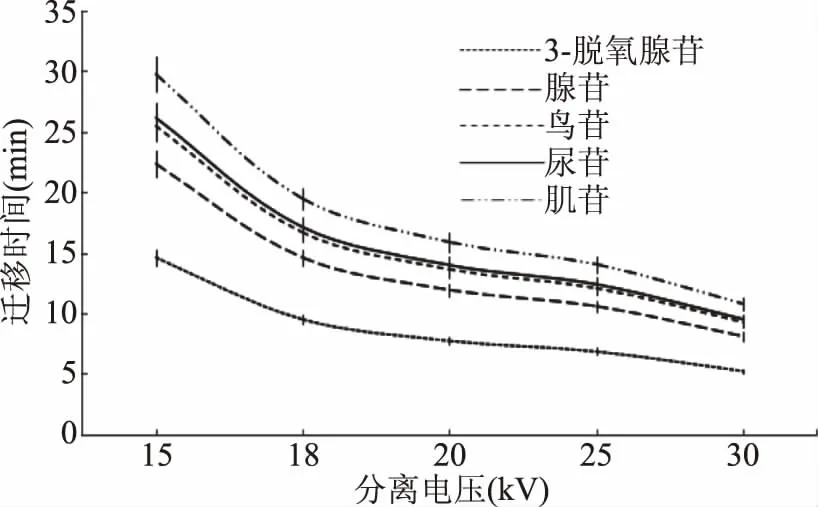
图3 不同分离电压对5种单核苷化合物分离的影响Fig.3 The effect of different separation voltageson the separation of five mononucleosides
2.4 缓冲液pH对样品分离的影响
缓冲液的酸碱性对物质的分离有很大的影响,经过缓冲液pH的优化,即使有相近等电点的物质也可以得到分离[14]。图4表明,pH越大,5种标准品分得越开,在pH9.0时鸟苷和尿苷和腺苷都未得到很好的分离,pH9.2时鸟苷和尿苷也未得到分离,pH9.4和pH9.6时5种标准品的分离度较好,但是pH9.6时5种物质的分离总时间大于20 min。所以选择pH9.4为试验缓冲液pH。
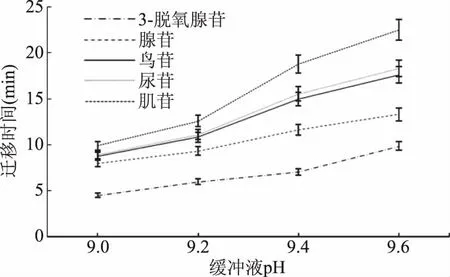
图4 不同缓冲液pH对5种单核苷化合物分离的影响Fig.4 The effect of pH in different buffers on theseparation of five kinds of mononucleoside compounds
2.5 缓冲液浓度对样品分离的影响
缓冲液浓度会影响溶液的黏度,高浓度的硼酸盐会增大样品的分离度,但浓度过大,电流过大,焦耳热效应增加会使得样品中各个物质的峰变宽,延长时间变长,从而降低了样品的分离效率[15-16]。图5表明,10、20 mmol/L硼砂缓冲液作为分离运行缓冲液时腺苷、鸟苷和尿苷没有分来,除腺苷外,鸟苷和尿苷系统均未显示迁移时间,30 mmol/L硼砂缓冲液鸟苷和尿苷的分离度没有50 mmol/L的硼砂缓冲液高,因此选择50 mmol/L为运行缓冲液浓度。
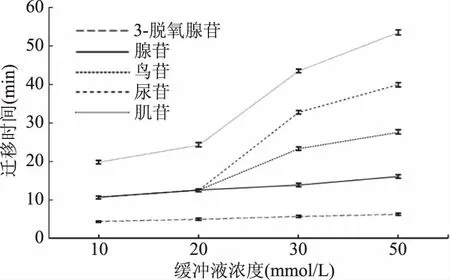
图5 不同缓冲液浓度对5种单核苷化合物分离的影响Fig.5 The effects of different buffer concentrationson the separation of five mononucleoside compounds
2.6 β-环糊精添加量对样品分离的影响
为了不同的分离分析目的,经常需要在缓冲溶液中加入不同的添加剂,表面活性剂可起到改变电渗流,溶解疏水性溶质等作用[17]。图6表明,在添加的4种不同浓度的β-环糊精的缓冲液中,5种单核苷类化合物不同浓度的β-环糊精添加到缓冲液中后标准品的电泳图谱的迁移时间没有显著性差异(P>0.05),但是在分离羊肚菌菌丝体提取物样品中,添加1.0 mg/mLβ-环糊精的样品分离效果好于其他浓度,所以选取1.0 mg/mLβ-环糊精作为试验添加剂(见图7)。

图6 β-环糊精添加量对5种单核苷类化合物分离的影响Fig.6 The effect of β-cyclodextrin additionon the separation of 5 mononucleoside compounds
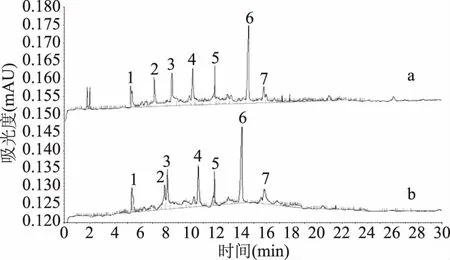
图7 缓冲液添加 1.0 mg/mL β-环糊精的羊肚菌菌丝指纹图谱(a)和未添加β-环糊精的羊肚菌菌丝指纹图谱(b)Fig.7 Hypha fingerprint of Morchella with 1.0 mg/mLβ-cyclodextrin in buffer solution(a)and hypha fingerprint ofMorchella without β-cyclodextrin in buffer solution(b)
2.7 进样时间对样品分离的影响
在毛细管电泳对物质分离的过程中,物质的浓度对样品的分离和峰型有很大的影响,而样品的进样浓度与处理方法,所选溶剂的溶解度和进样时间都有关系,所以在样品分离时,对进样时间进行优化可以减少在其他方面的工作量[18-19]。图8表明,不同的进样时间对5种标准品的分离时间没有较明显的影响,但是随着进样时间增大,5种单核苷化合物的峰宽均变宽(见图9),影响分离效率。而当进样时间为5 s时,鸟苷和尿苷没有完全分离,所以选择8 s为试验进样时间。
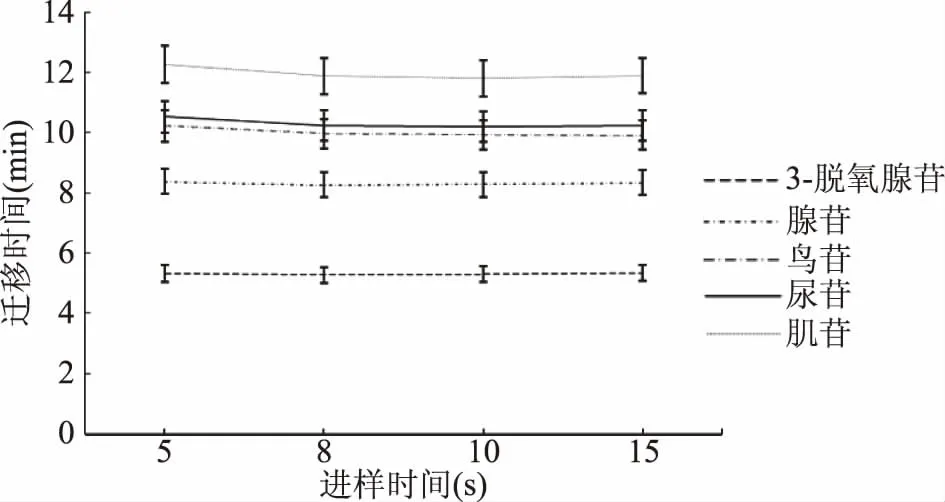
图8 不同进样时间对5种单核苷化合物分离的影响 Fig.8 Effect of different injection timeon the separation of five mononucleosides
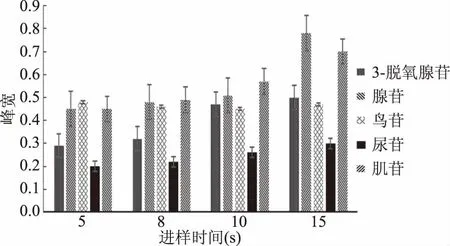
图9 不同进样时间对5种标准品峰宽的影响Fig.9 Effect of different injection timeon peak width of five standard products
2.8 方法的精密度的测定
操作方法参照[20-21],取标准品溶液配制成0.05 mg/mL连续进样测定3次,记录迁移时间和峰面积,计算3-脱氧腺苷迁移时间RSD为0.167%,峰面积的RSD为2.78%;腺苷迁移时间RSD为0.083%,峰面积的RSD为1.40%;鸟苷迁移时间RSD为0.61%,峰面积的RSD为2.9%;尿苷迁移时间RSD为0.66%,峰面积的RSD为2.72%;肌苷迁移时间RSD为0.89%,峰面积的RSD为1.96%。5种标准品的迁移时间RSD均小于0.89%,峰面积RSD均小于2.9%。
2.9 方法稳定性的测定
操作方法参照[22-23],分别取50 μL的5种标准品1.0 mg/mL混合到一起,在室温下放置0、2、4、6、8 h后,在最佳电泳条件下分别进样,每次3个重复,计算3-脱氧腺苷迁移时间RSD为0.5%,峰面积的RSD为3.84%;腺苷迁移时间RSD为0.53%,峰面积的RSD为2.62%;鸟苷迁移时间RSD为0.51%,峰面积的RSD为2.87%;尿苷迁移时间RSD为0.56%,峰面积的RSD为4.06%;肌苷迁移时间RSD为0.61%,峰面积的RSD为4.73%。表明方法的精密性较好。5种标准品的迁移时间RSD均小于0.61%,峰面积RSD均小于4.73%。表明标准品在8 h内具有良好的稳定性。
2.10 羊肚菌Morchella sextelata中核苷类化合物的测定
2.10.1 定性分析 操作方法参照文献[24-25],图10结果表明,3-脱氧腺苷、腺苷和尿苷出峰时间能与羊肚菌菌丝提取物中的几个单峰出峰时间相一致。再进一步确定将这3种标准品混合后加入样品中,如图11所示,加入混合标样后的样品色谱峰的个数没有增加,有相应的几个峰的峰面积明显加大,进一步确定了羊肚菌菌丝中含有3-脱氧腺苷、腺苷和尿苷。
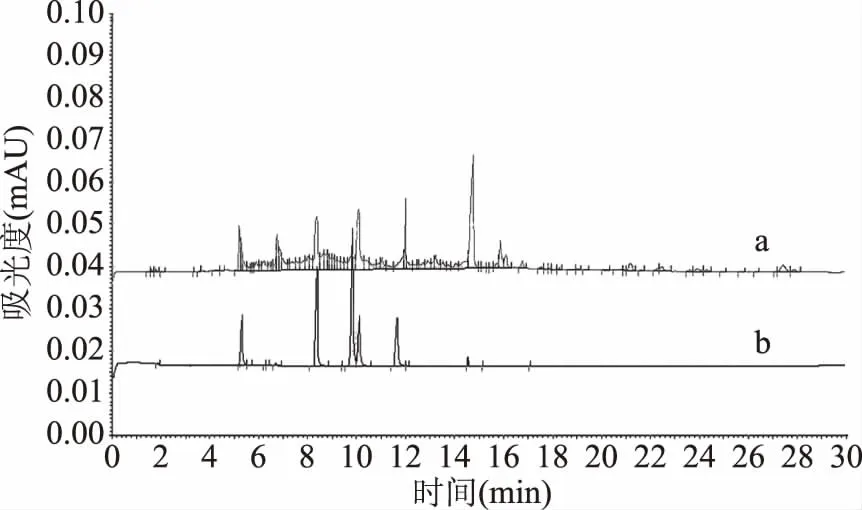
图10 羊肚菌菌丝体提取物色谱图(a)和5种单核苷类化合物(b)Fig.10 The chromatogram of mycelium extractfrom Morchella chinensis(a)and fivekinds of mononucleoside compounds(b)
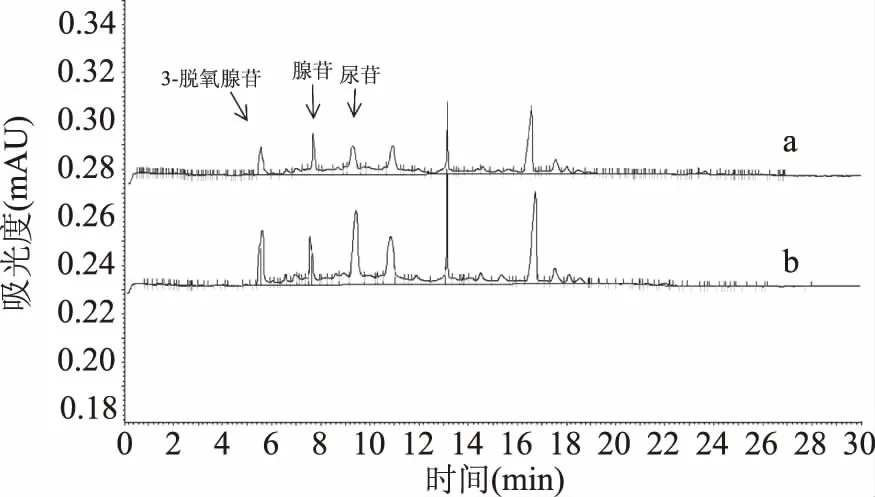
图11 羊肚菌菌丝体提取物(a)和羊肚菌菌丝体提取物加3-脱氧腺苷、腺苷和尿苷(b)Fig.11 Morchella mycelium extract(a)and Morchella myceliumextract plus 3-deoxyadenosine,adenosine,uridine(b)
2.10.2 定量测定
2.10.2.1 标准曲线的建立 将3种单核苷类化合物(3-脱氧腺苷、腺苷、尿苷)用50%甲醇配成1 mg/mL的母液,根据毛细管电泳中的定量计算方法,将3种单核苷类化合物标准品用缓冲液配成不同浓度分别进行进样测定。记录峰面积积分值,以对照品浓度(mg/mL)为横坐标,以对照品峰面积为纵坐标,进行线性回归方程的建立[26]。结果表明(见表1):决定系数R2的范围为0.9992~0.9997。
2.10.2.2 实际样品的定量测定 利用3种单核苷类化合物的标准曲线,将样品中3-脱氧腺苷、腺苷、尿苷的峰面积分别带入方程,并乘以提取液体的体积得到羊肚菌中3-脱氧腺苷含量为4.38 mg/g、腺苷含量为6.6 mg/g、尿苷含量为7.8 mg/g。

表1 羊肚菌中核苷类化合物的含量Table 1 Contents of nucleosides in Morchella

表2 样品加标回收率试验(n=3)Table 2 The recovery test of sample added standard(n=3)
2.11 回收率的测定
在羊肚菌菌丝体中测得的3种单核苷化合物浓度基础上添加低、中、高浓度的标准品,按照最佳优化条件进样测定,每一个样品进样3次[27]。将测得的峰面积带入到标准方程中,得出的浓度再除以理论浓度,得到回收率。表2表明,3种单核苷类化合物的回收率在95.5%~100.8%之间,且RSD小于4.9%。表明该方法适用于羊肚菌菌丝中3种单核苷类化合物的测定。
2.12 羊肚菌其他菌种中单核苷化合物的测定
结果如图12所示,3-脱氧腺苷中六妹含量最高,Mes-6含量最低;腺苷是Mes-6含量最高,梯棱羊肚菌含量最低;尿苷是Mes-6含量最高,梯棱羊肚菌含量最低。Mes-6菌丝体中腺苷含量是梯棱羊肚菌的4.92倍,尿苷含量是梯棱羊肚菌的5.92倍。

图12 不同品种的羊肚菌菌丝中单核苷类化合物的测定Fig.12 Determination of mononucleoside compoundsin hyphae of different species of Morchella
3 结论
利用二极管阵列检测器建立了5种单核苷类化合物的高效毛细管电泳图谱,对样品提取方法和电泳条件进行了优化,最终确定了以用菌粉按照1∶30加水先超声后水浴的方法提取样品的提取方法,以及最佳电泳条件为pH为9.4的50 mmol/L硼砂缓冲液以及1.0 mg/mL的β-环糊精为运行缓冲液,分离电压为25 kV,进样时间为8 s。再以羊肚菌菌丝提取物为样品进行5种单核苷类化合物的测定,结果表明羊肚菌Morchellasextelata菌丝中含有3-脱氧腺苷、腺苷以及尿苷。并与其他不同种类的羊肚菌菌丝提取物进行单核苷类化合物的含量的比对。野生羊肚菌Mes-6和Mes-9采集于辽宁省,为黄色系品种,目前人工栽培仍然不稳定。3-脱氧腺苷参与人体的免疫调节作用,可增强NK细胞对肿瘤细胞的杀伤力[28]。而腺苷可在凝血和炎症反应的调节中发挥介导的作用[29]。尿苷是药物合成的中间体,阻断癌细胞合成,修复受损基因等作用[30]。虽然野生羊肚菌Mes-6人工栽培不稳定,但是利用其菌丝体中的活性成分,将它应用到制药行业,也可成为羊肚菌发展的一条新途径。
目前测定单核苷类化合物通常用高效液相的方法[31],但是液相的流动相会用到大量的有机溶剂,样品的需求量也较高。高效毛细管电泳分离模式中溶质基于各自电泳迁移速率的不同而进行分离,组分在电泳中的流出顺序与组分的质荷比有关,不同质荷比的组分具有不同的迁移速度,因而物质得到分离。所有液相色谱的分离模式,包括正相、反相、离子交换、亲和、筛分等都可以在毛细管电泳中找到相应的模式[32]。本文利用对毛细管电泳中5种单核苷类物质分离需要的不同参数进行优化,得到分离效果较好的方法,除了本文涉及的羊肚菌菌丝体内的相关物质的测定,还可以应用到其他的样品的测定中去。并且高效毛细管电泳还具有分离效率高、分析速度快、样品和试剂用量少等特点,是一种更为环保、无害、便捷的检测方法,可以广泛的应用在各种领域中去。

