分子对接法研究苯并噻唑衍生物对mTOR的抑制作用
王小平,毛蓓蓓
(山东中医药大学,山东 济南 250355 )
雷帕霉素机制靶蛋白(mechanistic target of rapamycin,mTOR)作为PI3K/AKT/mTOR通路的重要组成部分,与细胞的生长、增殖、代谢、存活等密切相关[1]。研究发现,mTOR失调存在于多种癌症中,是肿瘤治疗的有效靶点[2]。目前,已经上市的mTOR抑制剂是对mTOR不完全抑制的雷帕霉素及其衍生物,ATP竞争性的mTOR抑制剂AZD2014,AZD8055,MLN0128,OSI027,CC-223等已进入I/II期临床试验阶段,更多的mTOR抑制剂先导化合物处于临床前的优化研究[3]。前期研究发现,苯并噻唑衍生物对mTOR展示出不同程度的抑制作用[4],具有进一步开发的潜力。
分子对接作为计算机辅助药物设计主要方法之一,是将配体分子放置在受体的活性位点中,观察配体与受体的相互作用和结合构象,在药物靶标寻找、药效物质筛选和作用机制研究方面被广泛运用[5-6]。本文主要是对不同活性程度的6个苯并噻唑类化合物与mTOR的分子对接进行研究,根据对接打分、化合物与蛋白口袋的结合以及氢键相互作用分析,探索苯并噻唑衍生物对mTOR抑制活性的作用机制。
1 实验方法
1.1 化合物与活性
苯并噻唑衍生物及其活性来源于文献[4],以活性化合物C3为对照,化合物C3-4对mTOR的抑制活性得到了保持,化合物C3-2对mTOR的抑制活性略有下降,化合物C3-1,C3-3,C3-5对mTOR的抑制活性显著下降。苯并噻唑衍生物的结构及活性见(表1)。

表1 苯并噻唑衍生物的结构及对mTOR的抑制活性
1.2 受体与配体的准备
选择蛋白晶体4JT6作为mTOR受体蛋白,PDB文件从蛋白数据库(https://www.rcsb.org/)下载得到。使用SYBYL-X2.1软件Surflex-Dock模块中的蛋白准备功能,去掉结晶水分子,对主链末端和侧链进行修复,为蛋白加氢,提取原始配体并确定其结合位点,为后续分子对接做准备(图1)。
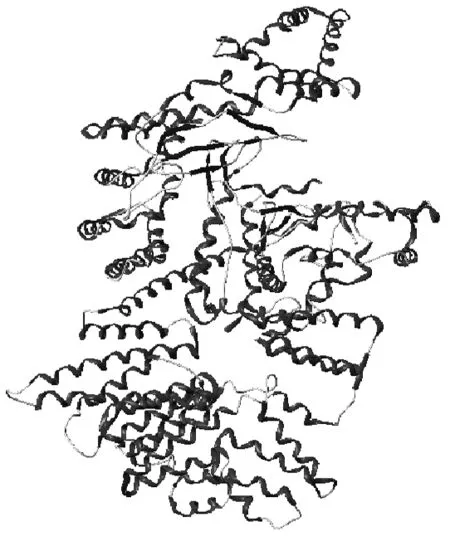
图1 mTOR受体蛋白的结构
配体结构由ChemDraw绘制,使用SYBYL-X2.1进行优化得到能量最低构象。参数设置如下:采用Tripos力场和Gasteiger-Hückel电荷,最大迭代次数为10000,最小能量梯度为0.005kcal/(mol·Å),其它参数为默认设置[7]。
1.3 分子对接
采用SYBYL-X2.1对接小分子配体与受体蛋白,以原配体结合位点生成活性口袋,对接方式为Surflex-Dock GeomX模式,分子构象改变保留20个。利用Surflex-Dock模块的CScore和Total-Score对小分子与靶标相互作用进行打分。CScore组合了G_Score,PDF_Score,D_Score,Chem_Score和F_Score多个打分函数,用来评价小分子与受体结合的好坏,CScore的分值为1-5,最好的CScore为5[8-9]。Total-Score函数综合考虑了极性、疏水、焓和溶剂化等作用,该值愈大说明药物分子与蛋白质晶体的相互作用越好,一般认为Total-Score大于或等于7活性较好[9-11]。
2 结果与讨论
2.1 化合物C3与mTOR对接
由图2和表2可见,化合物C3与mTOR对接的CScore和Total-Score打分均很高,化合物C3能够较好地结合在mTOR活性口袋中,并与mTOR形成多处氢键:(1) VAL2240主链上的NH作为氢键给体与噻唑环上的N原子之间形成氢键,主链上C=O作为氢键受体,与噻唑环上的氨基之间形成氢键。(2) GLU2190残基上的羧基作为氢键受体与苯并噁唑环上的氨基形成氢键。(3) ASP2357主链上的NH作为氢键给体与噁唑环上的N原子之间形成氢键,残基上的羧基作为氢键受体与苯并噁唑环上的氨基形成氢键。(4) ASP2195残基上的羧基作为氢键受体与苯并噁唑环上的氨基形成氢键。

表2 苯并噻唑衍生物与mTOR对接数据
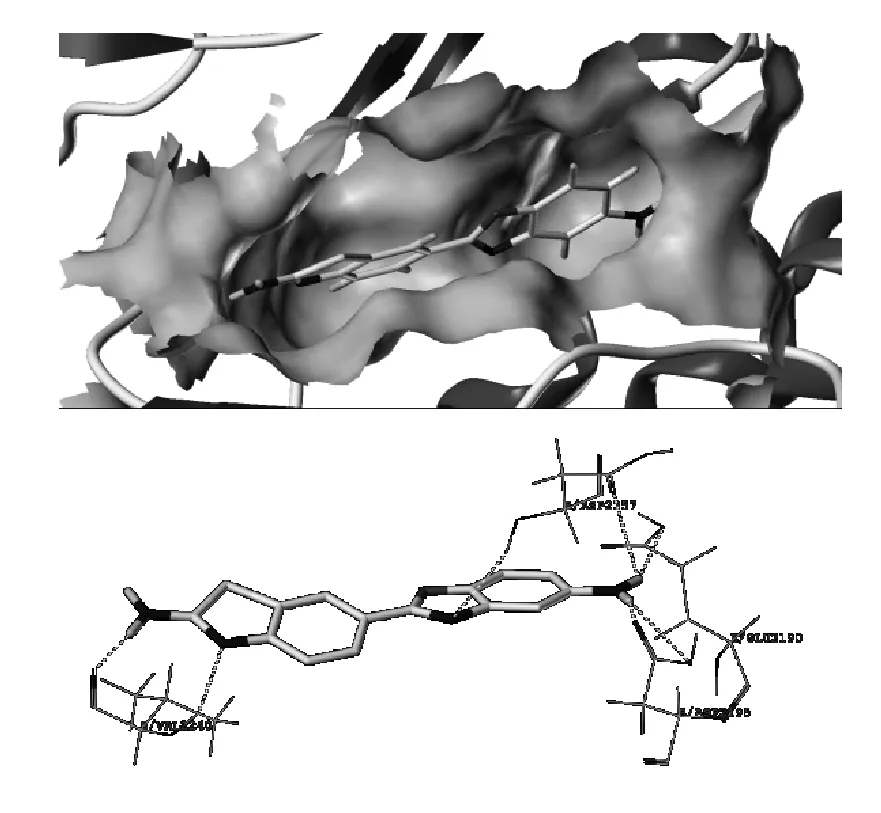
图2 化合物C3与mTOR对接的口袋结合图和氢键作用图
2.2 化合物C3-1与mTOR对接
由图3和表2可见,化合物C3-1与mTOR对接的CScore和Total-Score打分很低,说明化合物C3-1与mTOR的结合较弱。化合物C3-1虽然结合在口袋里,但分子太小,与口袋氨基酸距离太远,只产生了一处氢键相互作用:ASP2357主链上的NH作为氢键给体与噁唑环上的N原子之间形成氢键。
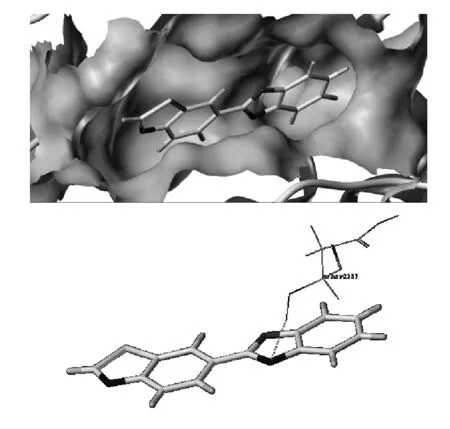
图3 化合物C3-1与mTOR对接的口袋结合图和氢键作用图
2.3 化合物C3-2与mTOR对接
由图4和表2可见,与化合物C3相比,化合物C3-2与mTOR对接的CScore打分较好,但Total-Score打分有所下降,说明化合物C3-2与mTOR的结合减弱。化合物C3-2苯并噻唑环部分能够与口袋结合较好,但苯并噁唑环与口袋结合较弱,共有两处氢键相互作用:(1) VAL2240主链上的NH作为氢键给体与噻唑环上的N原子之间形成氢键。(2) GLY2238主链上的C=O作为氢键受体与苯并噻唑环上的氨基之间形成氢键。
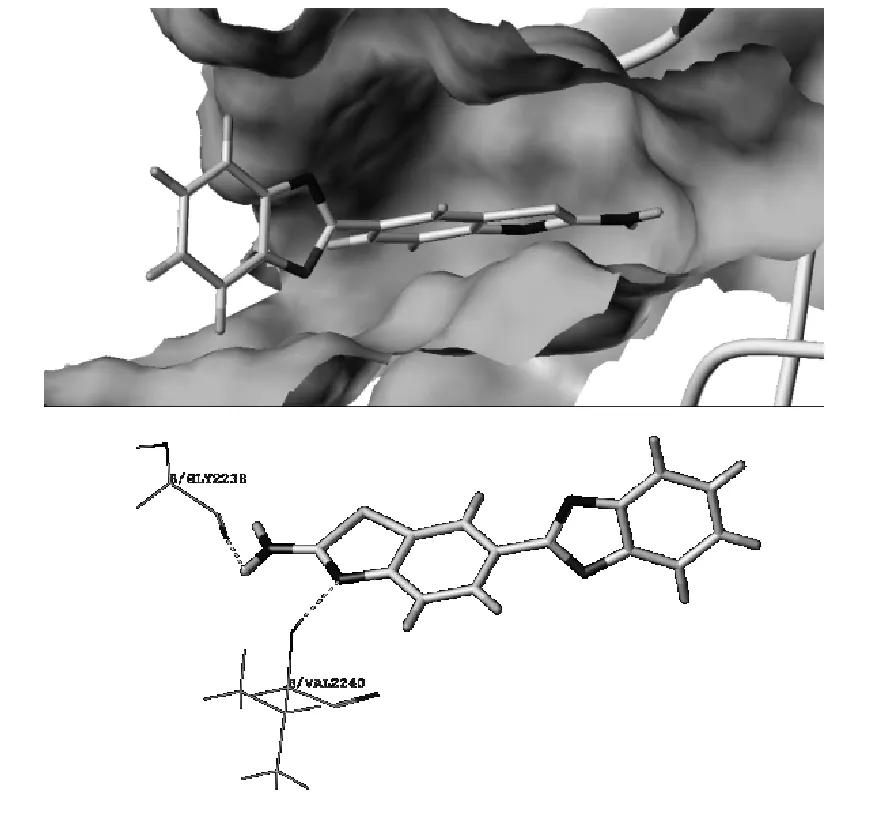
图4 化合物C3-2与mTOR对接的口袋结合图和氢键作用图
2.4 化合物C3-3与mTOR对接
由图5和表2可见,与化合物C3相比,化合物C3-3与mTOR对接的CScore和Total-Score打分均较低,说明化合物C3-3与mTOR的结合很弱。化合物C3-3苯并噁唑环部分能够与口袋结合,但苯并噻唑环与口袋结合较弱,共有两处氢键相互作用:GLY2190残基上的羧基作为氢键受体与苯并噁唑环上的氨基之间形成两处氢键。
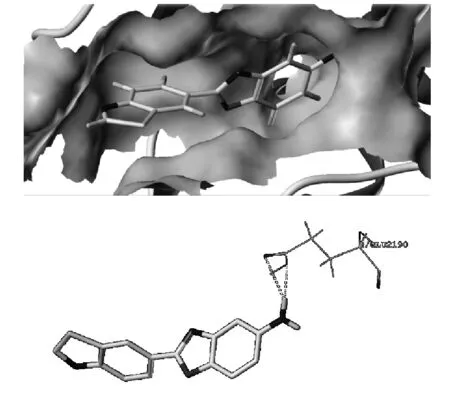
图5 化合物C3-3与mTOR对接的口袋结合图和氢键作用图
2.5 化合物C3-4与mTOR对接
由图6和表2可见,化合物C3-4与mTOR对接的CScore和Total-Score打分均较高,说明化合物C3-4与mTOR能够较好地结合。化合物C3-4插入到mTOR的活性位点口袋中,与周围的氨基酸形成三处氢键相互作用:(1) VAL2240主链上的C=O作为氢键受体与苯并噻唑环上的氨基形成氢键。(2) CYS2243主链上的C=O作为氢键受体与苯并噻唑环上的氨基之间形成氢键。(3) THR2164主链上的C=O作为氢键受体与苯并噁唑环上的氨基之间形成氢键。
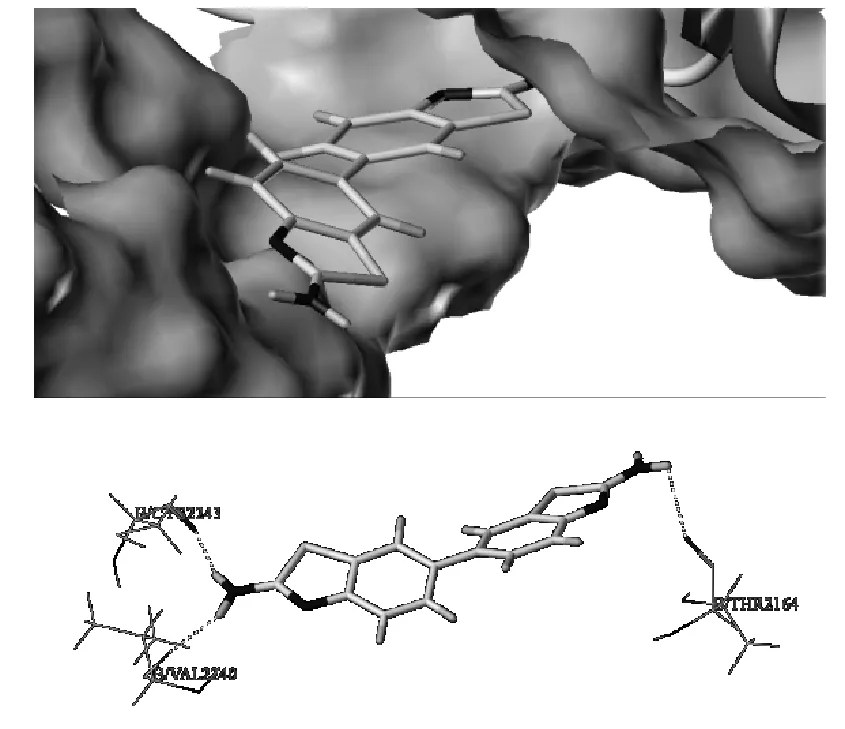
图6 化合物C3-4与mTOR对接的口袋结合图和氢键作用图
2.6 化合物C3-5与mTOR对接
由图7和表2可见,化合物C3-5与mTOR对接的CScore和Total-Score打分均较低,说明化合物C3-5与mTOR结合弱。化合物C3-5虽然能形成部分氢键相互作用,但分子中间链的空间取向,使得分子部分结构伸出口袋,削弱了活性。化合物C3-5与周围氨基酸形成两处氢键相互作用:(1) VAL2240主链上的C=O作为氢键受体与苯并噻唑环上的氨基形成氢键。(2) HIS2340残基的咪唑环上的N作为氢键受体与另一个苯并噻唑环上的氨基之间形成氢键。
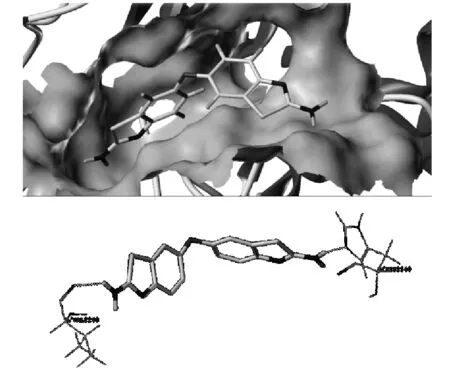
图7 化合物C3-5与mTOR对接的口袋结合图和氢键作用图
3 结论
(1)苯并噻唑衍生物与mTOR蛋白的结合强弱影响其对mTOR的抑制活性。结合好有利于活性保持,结合减弱使得抑制活性减弱。
(2)苯并噻唑环上的氨基对活性保持起着重要作用,其对活性的影响大于苯并噁唑环上的氨基。
(3)化合物与氨基酸VAL2240间的氢键作用是影响苯并噻唑衍生物活性的重要因素。
(4)两个稠杂环之间的连接链原子数不宜过多,原子数增加容易改变配体结合时的空间取向,从而影响活性。
——以高中化学“氢键”的教学为例

