间充质干细胞治疗危重型新型冠状病毒肺炎患者的疗效分析
周娟,胡玲俐,谭英征,刘欢欢,贺潇瑾,袁婷,龙云铸
新型冠状病毒肺炎(COVID-19)在短期内迅速席卷全球。随着基因测序技术的进步,研究者很快得到了新型冠状病毒基因序列,明确了致病原是与重症急性呼吸综合征(SARS)、中东呼吸综合征(MERS)同属的冠状病毒。2020-02-11,世界卫生组织(WHO)将新型冠状病毒正式命名为严重急性呼吸综合征冠状病毒 2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[1]。
2020-01-10鉴定出病原体,但人们对这种病毒的认知非常有限[2],且目前尚无有效的抗病毒药物,据WHO预计疫苗研发至少需要12~18个月[3],寻找有效的救治方案对重症、危重症COVID-19患者十分重要。为了提高重症、危重症COVID-19患者的救治成功率,研究提出,间充质干细胞可通过调节免疫、抗纤维化、抑制炎性因子风暴等机制修复COVID-19患者受损器官,并发挥营养保护的作用[4-5]。根据现有研究,可用于监测COVID-19患者病情进展的指标包括外周血淋巴细胞计数、D-二聚体、C反应蛋白、乳酸脱氢酶等,其中淋巴细胞计数减少与疾病的严重程度密切相关[6-7]。本研究探讨间充质干细胞治疗危重型COVID-19患者的临床疗效及预后,并分析患者治疗前后淋巴细胞计数、C反应蛋白及影像学变化情况,为今后的临床诊疗提供参考。
1 对象与方法
1.1 研究对象 选取2020-02-20至2020-03-20株洲市中心医院收治的危重型COVID-19患者5例,均符合《新型冠状病毒肺炎诊疗方案(试行第六版)》[8]中的危重型COVID-19诊断标准。患者基本信息见表1。本研究经株洲市中心医院医学伦理委员会审核批准(批准号:2020029),患者对本研究知情并签署知情同意书。
1.2 间充质干细胞治疗 患者均采用人脐带间充质干细胞悬液(湖南省长沙市中信湘雅医院人类干细胞国家工程研究中心提供)治疗,每次剂量为1×106~5×106cell/kg,每次治疗间隔时间≥3 d,且治疗次数≤3次。间充质干细胞治疗适应证:呼吸衰竭、休克或合并其他器官功能衰竭入住ICU治疗者。禁忌证:(1)既往有肺栓塞病史者;(2)人类免疫缺陷病毒(HIV)感染者;(3)恶性肿瘤及既往有子宫颈原位癌、皮肤非转移性鳞状细胞癌或基底细胞癌者;(4)妊娠期及哺乳期妇女;(5)临床医师认为其他不适宜应用的情形。
1.3 病历简介
病例1:男,80岁,因“发热、咳嗽2 d”及SARSCoV-2核酸检测阳性于2020-02-14入住株洲市中心医院感染内科隔离病房,予以吸氧、胸腺肽以增强机体免疫力,并给予阿比多尔联合干扰素、抗凝药物及营养支持治疗。2月20日,因“呼吸衰竭”转入ICU,并行胸部CT检查,结果显示:两肺磨玻璃样病灶较前明显增多(见图1a)。第2天,患者因呼吸困难行气管插管并给予俯卧位有创机械通气治疗;第5、10天,患者行床旁胸部CT检查示:双肺多发磨玻璃样渗出病灶持续进展。第9天,患者肺泡灌洗液培养结果出现G-不动杆菌、鲍曼不动杆菌等,因此进一步强化抗感染治疗。在临床治疗中,患者均于入住ICU第5、8、11天输入间充质干细胞悬液100 ml,无不良反应发生;第12天,患者病情有所好转,遂脱机行高流量吸氧治疗;第14天,拔出气管插管,采用鼻导管吸氧,待患者呼吸平稳后转入普通病房进行隔离治疗。第15天,复查胸部CT检查示:两肺渗出病灶较前吸收,密度减低,较多纤维化(见图1b)。且在第5天输入间充质干细胞悬液后,外周血淋巴细胞计数、C反应蛋白逐渐恢复正常(见图2a),患者病情出现好转。
病例2:女,80岁,因“咽痒、轻咳2 d”及SARSCoV-2核酸检测阳性于2020-02-14入住株洲市中心医院感染科隔离病房,治疗方案同病例1。2月14日,患者胸部CT检查结果示:双肺内可见斑片状高密度影,病灶范围进展明显(见图1c),因其年龄大且一般情况差而转入ICU治疗,并予以无创呼吸机辅助通气。入住ICU后第2、5天,患者均输入间充质干细胞悬液共200 ml,无不良反应发生;第6天,床旁胸部CT检查示:两肺渗出病灶较前仍有进展;第7天,患者经鼻导管吸氧后氧合指数达 389 mm Hg(1 mm Hg=0.133 kPa),且呼吸平稳,故转入普通病房进行隔离治疗;第10天,再次复查胸部CT检查示:肺部病灶较前减少,密度降低(见图1d)。另外,患者在入住ICU第5天后,外周血淋巴细胞计数和C反应蛋白逐渐恢复至正常(见图2b)。
病例3:女,65岁,因“畏寒5 d”及SARS-CoV-2核酸检测阳性于2020-02-08入住株洲市中心医院感染科隔离病房,治疗方案同病例1。2月12日,患者因严重低氧血症而行胸部CT检查,结果示:双肺内斑片状高密度影(见图1e),遂转入ICU监测病情;第2天,患者因低氧血症而行气管插管并给予无创机械通气;第3、6天分别给予间充质干细胞悬液100 ml,未发现不良反应;第4天,患者床旁胸部CT检查示肺部病灶仍进展,但患者呼吸机支持力度不高,故下调参数;第5天,患者可间断自主呼吸;第7天,拔除气管插管,并撤除呼吸机行鼻导管高流量氧疗,复查胸部CT检查示:双肺感染病灶较前有所减少(见图1f);第9天,患者在鼻导管吸氧状态下呼吸平稳,且外周血淋巴细胞计数和C反应蛋白恢复至正常(见图2c),遂转至普通病房进行隔离治疗。
病例4:男,66岁,因“咳嗽、咳痰1月余,腹泻6 d,发热2 d”于2020-02-12入住株洲市中心医院感染内科,次日SARS-CoV-2核酸检测阳性,转入隔离病房治疗。2月14日,因呼吸困难行胸部CT检查,结果显示两肺斑片状高密度影较前进展迅速(见图1g),故转入ICU予高流量氧疗,余治疗同病例1。在ICU治疗第4天,患者床旁胸部CT检查示肺部病灶较前明显增多,高流量(氧浓度为34%,氧流量为 40 L/min)吸氧状态下氧合指数为 182 mm Hg;入院第4、7天,患者均输入间充质干细胞悬液100 ml,治疗过程中患者无明显不适;入院第6天,复查患者胸部CT检查示双肺渗出病灶持续增多,但俯卧位氧合指数明显改善;第9天,患者呼吸平稳,在鼻导管吸氧状态下氧合指数为240~260 mm Hg,复查胸部CT检查示双肺病灶较前有所吸收(见图1h),且外周血淋巴细胞计数和C反应蛋白明显好转(见图2d),遂转入普通病房继续隔离治疗。

表1 患者基本信息Table 1 Basic information of patients
病例 5:女,46岁,因“发热、乏力 6 d,咳嗽2 d”和SARS-CoV-2核酸检测阳性于2020-01-28入住株洲市中心医院感染内科,有甲状腺功能亢进症病史并长期服用甲硫咪唑。胸部CT检查结果示:双肺弥漫多发磨玻璃影并部分实变(见图1i),治疗同病例1。2月10日,因呼吸困难转入ICU,予以气管插管并呼吸机辅助通气治疗;第3天,因患者氧合指数持续下降而给予有创体外膜肺氧合(ECMO)治疗;患者均于ICU治疗第10、11、12天输入康复者血浆共800 ml;第14天,予以脱机拔管,行清醒ECMO+高流量氧疗;患者均于ICU治疗第17、20天分别输入间充质干细胞悬液100 ml,无不良反应发生;第19天,更换ECMO可见血栓;第22天,患者意识清楚,达到撤除ECMO指征,遂拔管予以对症支持治疗;第24天,患者复查胸部CT检查示两肺病灶较前吸收(见图1j),因此转入普通病房继续隔离治疗。1周后,患者复查胸部CT检查示肺部病灶吸收减少,大部分出现纤维化改变。且在第1次间充质干细胞治疗后,患者外周血淋巴细胞计数、C反应蛋白出现好转(见图2e)。
2 结果
5例患者治疗后肺部病灶有所改善,呼吸功能明显改善,且外周血淋巴细胞计数、C反应蛋白均在短期内恢复至参考范围,均于2周内达到出院标准并出院。出院标准依据国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》[8]:体温正常3 d以上;连续2次核酸检测阴性;胸部CT检查提示肺部病灶明显吸收、减少。患者出院以后进行居家隔离,并定期到医院进行复查。在随访期内,患者健康状况恢复良好。
3 讨论
截至目前,全球COVID-19疫情仍未得到明显遏制,感染病例接近200万人,且在治疗上尚无特效药物,尤其是重症与危重症患者更加迫切需要有效的治疗措施以挽救生命。间充质干细胞是源于中胚层的一类多能干细胞,存在于多种组织中,并具有自我更新和多向分化的能力[9]。有研究表明,外源性间充质干细胞能够迁移到受损的组织部位,通过影响炎症微环境而参与受损组织的修复[10]。本研究结果表明,5例重症和危重症COVID-19患者经间充质干细胞治疗后预后良好,提示间充质干细胞疗法可能是重症和危重症COVID-19患者治疗的有效手段[11]。
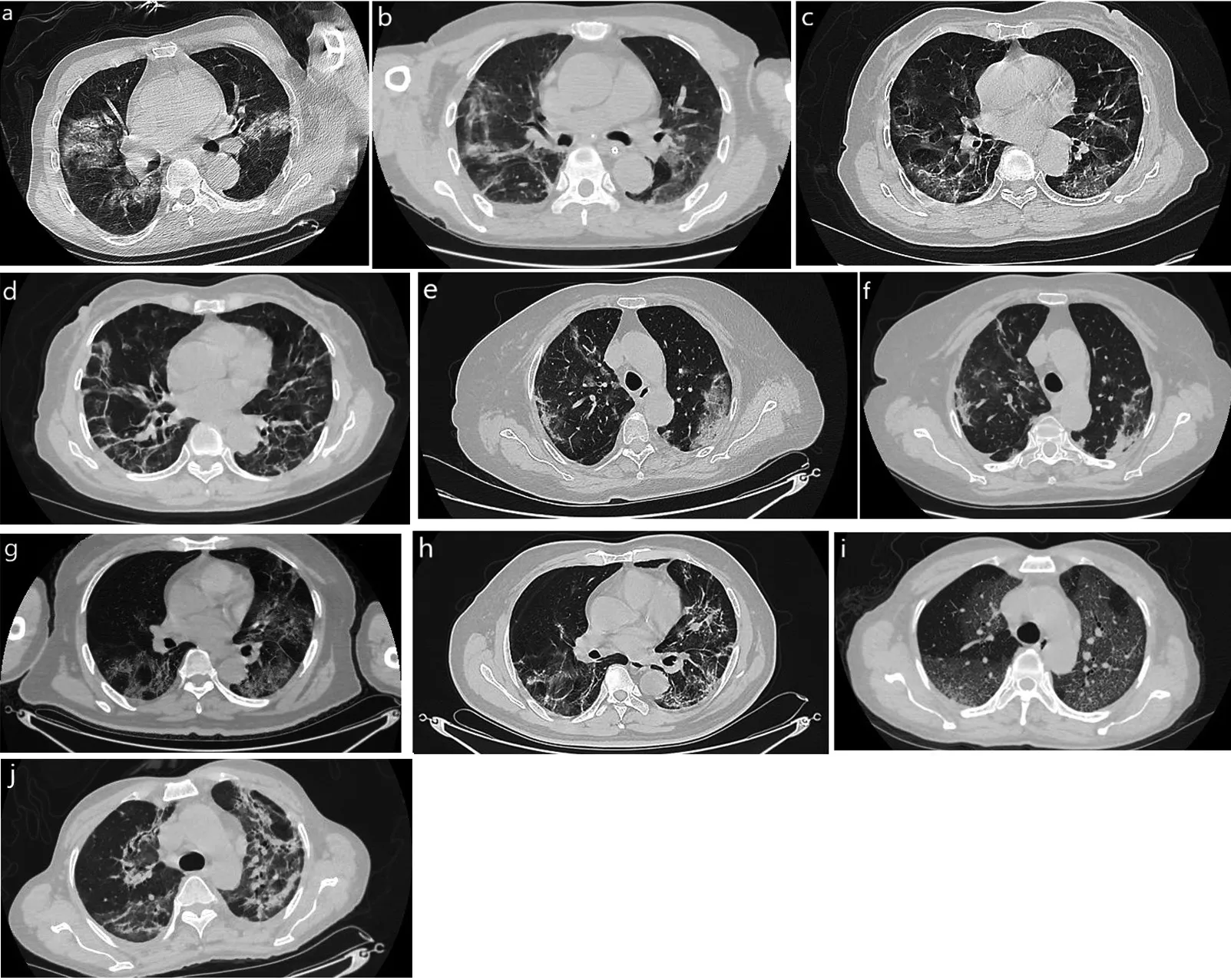
图1 5例患者间充质干细胞悬液治疗前后肺部CT检查变化Figure 1 Changing of lung CT examination before and after treatment with mesenchymal stem cell suspension of 5 patients

图2 5例危重型COVID-19患者在ICU治疗期间CRP及外周血淋巴细胞计数变化Figure 2 CRP and peripheral blood lymphocyte count in 5 critical COVID-19 patients during ICU treatment
既往研究报道,SARS-CoV-2的病理、致病机制与SARS相似,均是通过血管紧张素转换酶2(ACE2)受体感染宿主细胞[12-13]。因此,关于SARS患者的治疗方案对于COVID-19治疗的研发极具借鉴价值。有研究对部分SARS死亡患者肺组织活检进行蛋白共定位,结果表明,SARS抗原阳性的细胞不仅表达ACE2受体,还表达干细胞标志物如CD34、Oct-4,而非SARS患者肺组织活检中的CD34+、Oct-4+细胞可在体外被SARS-CoV-2感染[14]。此外,其他研究也发现了位于支气管-肺泡导管交界处的Oct-4+、ACE2+上皮集落细胞群是SARS-CoV-2感染宿主肺组织的主要靶标[15-16]。可见支气管肺泡干细胞损伤和死亡是导致COVID-19患者肺组织修复能力受损的主要原因,也进一步提示干细胞治疗可能会促进COVID-19患者快速康复[14]。对脂多糖(LPS)诱导的急性肺损伤小鼠模型静脉注入干细胞可明显改善其肺部微血管的渗透性和组织损伤,还可减轻炎性反应,提高存活率[17-18]。此外,在急性呼吸窘迫综合征(ARDS)发生过程中,间充质干细胞通过介导线粒体转移而促进抗炎作用,有效减轻肺部损伤[19]。可见干细胞治疗在SARS-CoV-2引起急性肺损伤和ARDS中亦具有潜在的应用价值。
目前,间充质干细胞已被开发用于多种免疫性疾病的治疗,其既可抑制机体免疫反应,也可增强免疫力,但其在诱导差异治疗效果的机制并不明确[20]。WU等[21]研究表明,多数普通型COVID-19患者(约85%)预后良好,但危重型患者病死率接近50%。ZHANG等[22]研究表明,呼吸衰竭是CPVID-19患者死亡的主要原因,而病毒本身引起的细胞因子风暴致器官功能损伤也是不可忽略的因素。另有研究指出,COVID-19可导致严重免疫系统损伤,包括淋巴滤泡耗竭、脾结节萎缩、组织细胞增殖和淋巴细胞计数减少等[23]。本研究通过对5例危重型COVID-19患者静脉注射间充质干细胞治疗,病情均明显好转,肺部病灶有所吸收,且C反应蛋白、淋巴细胞计数均在短期内恢复至参考范围,可见间充质干细胞治疗危重型COVID-19患者具有一定疗效;但有1例在间充质干细胞治疗前接受了康复者血浆治疗,由于样本量较少,并不能评估两种方法在COVID-19治疗中的疗效差异,二者联合应用是否会有更好的治疗效果还有待于进一步研究。
综上所述,间充质干细胞治疗危重型COVID-19患者安全有效,且预后良好。但本研究缺乏可靠的对照组来阐明间充质干细胞的应用价值;此外,本研究样本量较小,提供的信息有限。因此,间充质干细胞治疗危重型COVID-19患者的有效性及安全性还有待于大量数据研究证实。
作者贡献:龙云铸进行文章的构思与设计,结果分析与解释,负责文章的质量控制及审校,并对文章整体负责、监督管理;胡玲俐、谭英征、刘欢欢、贺潇瑾、袁婷进行研究的实施与可行性分析;周娟进行数据收集、整理、分析,撰写论文;胡玲俐、谭英征进行论文的修订。
本文无利益冲突。

