新型冠状病毒肺炎患者心脏损伤机制及表现研究进展
贾硕,程功
由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)现已成为世界流行性疾病。SARS-CoV-2是一种正链RNA病毒,是已被临床证实的感染人类的第7种冠状病毒。据美国约翰斯·霍普金斯大学实时统计,截至2020-06-02,全球COVID-19累计确诊病例超630万例,累计死亡病例超37万例[1]。
心脏损伤是COVID-19继发性损伤的主要表现,其可能会使COVID-19患者死亡风险增加3~5倍[2]。武汉的一项研究显示,416例COVID-19住院患者中有82例并发心肌损伤,在排除年龄及其他合并症影响后,该患者病死率仍然较高[3]。一项荟萃分析结果表明,COVID-19病情越严重,则患者急性心脏损伤发生风险越高,而该并发症与患者病死率密切相关[4]。COVID-19常见心脏并发症包括心律失常(包括心房颤动、室性心动过速和心室颤动)、急性心肌炎、心肌梗死和心力衰竭。研究表明,与肌钙蛋白I(TnI)或肌钙蛋白T(TnT)水平正常的COVID-19患者相比,出现心脏并发症者的年龄较大,其高血压、冠心病、心力衰竭和糖尿病发病率较高[5]。本文就COVID-19对心脏损伤的作用机制及表现进行综述。
1 SARS-CoV-2及COVID-19命名
冠状病毒是冠状病毒科家族的一部分,其命名来自于该病毒在电子显微镜下的冠状外观,其外观是由装饰病毒的表面糖蛋白引起的。冠状病毒科包括冠状病毒亚科和Leto亚科。冠状病毒亚科包括α冠状病毒属、β冠状病毒属、γ冠状病毒属和δ冠状病毒属,其中α冠状病毒属和β冠状病毒属通常仅感染哺乳动物,而γ冠状病毒属和δ冠状病毒属通常感染禽类,有时也感染哺乳动物。目前已知的Leto亚科是一种可感染小雨蛙的病毒,如姬蛙甲型勒托病毒1型(MLeV)。冠状病毒是人类常见的病原体,两种α冠状病毒(229E、NL63)和两种β冠状病毒(OC43、HKU1)感染可导致人类发生上呼吸道感染,而对人类更具致病性的冠状病毒是严重急性呼吸综合征冠状病毒1(SARS-CoV-1)、中东呼吸综合征冠状病毒(MERS-CoV)及目前流行的SARSCoV-2,均属于β冠状病毒属。2020-02-11,国际病毒分类学委员会的冠状病毒科研究小组(CSG)正式将新型冠状病毒命名为SARS-CoV-2,世界卫生组织(WHO)也正式将由SARS-CoV-2引发的肺炎正式命名为COVID-19[6]。
2 COVID-19影响心脏的可能机制
2.1 血管紧张素转换酶2(ACE2)功能丧失 周细胞是一种血管周围壁细胞。与位于冠状动脉或小动脉的平滑肌细胞不同,周细胞分布于毛细血管内皮细胞及部分小静脉,可能在心肌微循环中具有重要作用。人类心脏单细胞图谱显示,周细胞是SARS-CoV-2在人类心脏中潜在的靶向宿主细胞,而心脏中的周细胞又可表达ACE2,可见心脏对SARS-CoV-2具有本身的易感性[7]。
SARS-CoV-2基因组与MERS-CoV基因组的同源性高达75%~80%,二者使用相同的ACE2受体,但相较于MERSCoV,SARS-CoV-2与人ACE2受体更具亲和力[8],这可能是SARS-CoV-2致病性较MERS-CoV更强的原因,细胞表面ACE2受体耗尽也是COVID-19的重要病理结果。ACE2及其受体可能在COVID-19合并心血管疾病(CVD)患者中具有重要意义,一方面,ACE2可对抗高血压、心肌纤维化、心肌肥大、心律不齐、动脉粥样硬化及水钠潴留[9];另外,ACE2受体是SARS-CoV-2感染的“大门”,随着SARS-CoV-2病毒颗粒的内吞,导致了ACE2介导的心血管保护作用丧失。GHEBLAWI等[8]研究发现,ACE2/血管紧张素 1-7(Ang1-7)驱动的通路激活可使血管紧张素Ⅱ(Ang Ⅱ)水平升高,进而导致心肌纤维化、心肌肥厚、活性氧(ROS)含量增加、血管收缩和肠道菌群失调;同时,肾素-血管紧张素系统(RAS)过度激活可引起去整合素-金属蛋白酶17(ADAM17)介导的ACE2蛋白水解和胞外结构域脱落,进而导致心力衰竭、心房颤动、冠状动脉疾病发生。
2.2 细胞因子风暴 细胞因子风暴综合征是一种严重威胁人类生命的疾病,主要临床症状包括全身性炎症、高铁血红蛋白血症、血流动力学不稳定和多器官功能衰竭[10]。细胞因子风暴综合征的特点是免疫反应失控,涉及淋巴细胞和巨噬细胞的持续激活和增殖。一项针对心脏损伤与病死率关系的研究表明,心脏损伤患者炎性反应标志物如C反应蛋白、降钙素原和白细胞计数明显升高[3]。SARS-CoV-2感染呼吸道尤其是2型肺细胞,可表现为全身炎症和免疫细胞过度激活、T辅助分子1和T辅助分子2反应不平衡,从而导致“细胞因子风暴”[11],进而导致白介素(IL)-6、IL-7、IL-22和干扰素诱导蛋白10(CXCL10)等细胞因子水平升高。随后,活化的T细胞和巨噬细胞可能渗入感染的心肌,导致急性心肌炎和严重心脏损伤[12]。
2.3 内皮细胞感染与内皮炎 COVID-19可导致心内膜炎,进而造成COVID-19患者心脏微循环功能受损。一项针对COVID-19患者的病理结果表明,内皮细胞内存在病毒成分和炎性细胞的积聚[13]。因此,无论通过直接感染心脏内皮细胞还是免疫介导均可能导致与细胞凋亡相关的心脏内皮功能障碍。
2.4 低氧血症 严重COVID-19可导致肺透明膜形成,引起肺通气和换气功能障碍,从而导致低氧血症,而心肌细胞对缺氧较敏感。低氧导致外周血管收缩,同时增加了心脏前后负荷,改变了心室复极,并增加了左心室心内膜钙离子通道表达,导致细胞凋亡在内的一系列细胞损伤[14]。同时,低氧状态还可刺激机体产生过多的氧自由基,使内皮生长因子增加,并能诱导炎性反应,如炎性细胞浸润和细胞因子释放等,导致血管内皮功能障碍和心肌缺血,也可进一步发展为心肌梗死[15]。
2.5 应激反应 COVID-19患者均存在一定程度的焦虑,尤其是重症患者,焦虑、恐惧情绪及应激反应较明显。应激途径是由焦虑和睡眠剥夺/分裂所致,在应激状态下,下丘脑-垂体-肾上腺皮质轴(HPA)及交感神经系统的神经元激活,进而刺激机体产生并释放大量的儿茶酚胺[16],通过直接心脏毒性和间接微循环障碍而损伤心肌,而这些精神情绪的应激反应又会进一步损伤人体免疫功能,加重心肺损伤。
2.6 药物心脏毒性
2.6.1 氯喹和羟氯喹 氯喹和羟氯喹被广泛用于COVID-19患者的抗病毒治疗。最新发表于《柳叶刀》的一项9 600多例COVID-19住院患者治疗结果的研究发现,氯喹和羟氯喹治疗COVID-19患者无效,反而会增加患者室性心律失常和院内死亡风险[17],分析原因为:氯喹和羟氯喹可积聚在溶酶体中,直接抑制磷脂酶活性,诱导胞质包涵体的形成,增加溶酶体pH值,并导致蛋白质失活。氯喹和羟氯喹主要心脏毒副作用是引起心肌传导障碍,还可抑制窦房结功能,降低心率,导致心动过缓,严重时可引发阿-斯综合征甚至死亡;其他非特异性心脏事件包括心肌肥厚、心力衰竭、瓣膜功能障碍等。但值得注意的是,停药后部分患者心脏功能能够恢复正常[18]。
2.6.2 阿奇霉素 阿奇霉素被认为可与氯喹、羟氯喹联合治疗COVID-19[19]。阿奇霉素是一种半合成的大环内酯类抗生素,也是美国最常见的处方抗生素,其治疗革兰阳性菌、革兰阴性菌及非典型病原菌感染有效。既往研究表明,阿奇霉素无心脏毒性作用,但可能导致QT间期延长、室性心动过速及增加心房颤动和心脏骤停风险[20]。
3 COVID-19患者心脏损伤表现
3.1 心律失常 心动过速是COVID-19患者最常见的心律失常类型,因低血流灌注、发热、缺氧、焦虑等多种原因导致,但通常具有自限性[21]。另外,COVID-19可引发低氧血症,进而诱发心房颤动,可持续到肺部病灶改善前。此外,全身炎性反应会使心房颤动的抗凝治疗变复杂[22]。
3.2 急性心肌炎 与其他冠状病毒一样,SARS-CoV-2可诱导机体释放多种细胞因子和趋化因子,不仅可导致血管炎症和斑块不稳定,还会导致心肌炎[23]。在CVD患者中,COVID-19相关心肌损伤可能以急性心肌炎的形式表现出来[24]。心肌炎会导致局灶性或整体性心肌炎症、坏死,最终导致心室功能障碍[25]。
首次对1例COVID-19死亡患者的尸检样本进行病理学检查显示,患者心肌间质中有单核细胞炎性浸润,但并未对心脏组织造成实质性损伤[26],表明COVID-19可能引起心肌炎。一项分析危重症COVID-19患者心肌损伤临床特点的研究发现,患者心肌肌钙蛋白I(cTnI)、肌酸激酶(CK)、α羟丁酸脱氢酶(α-HBDB)和乳酸脱氢酶(LDH)均有不同程度升高[27]。儿童COVID-19也存在心肌损伤[28]。《儿童新型冠状病毒感染诊断、治疗和预防专家共识(第二版)》[29]指出,心肌酶、LDH水平进行性升高提示COVID-19患儿病情加重或恶化,部分患儿可见肌钙蛋白水平升高。INCIARDI等[30]报道了1例53岁的意大利女性COVID-19患者发生急性心肌炎,但患者无呼吸道体征及感染症状,实验室检查指标及心脏磁共振成像检查均提示严重左心室功能障碍和急性心肌炎。可见COVID-19无症状患者也可能发生心脏损伤。
3.3 心肌梗死 心脏血管壁中的周细胞在SARS-CoV-2感染期间发生局部微血管炎症[7],引起严重微血管功能障碍,导致非梗阻性冠状动脉心肌梗死,这就解释了近期关于COVID-19患者发生心肌梗死的临床报道[31]。此外,细胞因子风暴可促进内皮功能障碍[32]。研究表明,SARS-CoV-2可能通过全身炎性反应、细胞因子风暴及免疫细胞极化向更不稳定表型发生特定变化,从而导致心肌损伤、内皮功能障碍、微血管功能障碍、斑块不稳定和心肌梗死[5]。首次COVID-19相关的心肌受累的报告是武汉对41例COVID-19确诊患者的研究,其中5例(12%)高敏肌钙蛋白I>28 ng/L,且7%~17%的轻症COVID-19患者和22%~31%的重症COVID-19患者可能会出现肌钙蛋白水平升高[11]。意大利一项针对28例因急性ST段抬高型心肌梗死(STEMI)行急诊冠状动脉造影术的COVID-19患者研究表明,STEMI可能是COVID-19的首发症状,同时也指出1型心肌梗死可通过冠状动脉造影术识别罪犯血管,而约40%的合并STEMI的COVID-19患者考虑为2型心肌梗死或心肌炎所致,这种情况下不应完全采用溶栓治疗,因为此类患者尚无需再灌注治疗[33]。
3.4 心力衰竭 呼吸困难、乏力是心力衰竭尤其是重症COVID-19患者的常见症状[11]。研究表明,23%的COVID-19患者在首次发病时出现急性心力衰竭[34],而并发心力衰竭可能会增加患者死亡风险[35]。在心力衰竭患者中,约50%无已知的高血压病史或CVD病史,因此目前尚不清楚心力衰竭是由新发的心肌病所致,还是由于未诊断出的心力衰竭进一步恶化所致[36]。值得注意的是,在合并急性呼吸窘迫综合征(ARDS)和急性肺损伤的COVID-19患者中,右心衰竭也可能发生[37]。通过分析检索的COVID-19心脏并发症的 13 篇[3,11,21,27,34-35,38-44]文献结果表明,合并 CVD 的COVID-19患者心脏受累发生率更高,院内病死率也较高,详见表1。
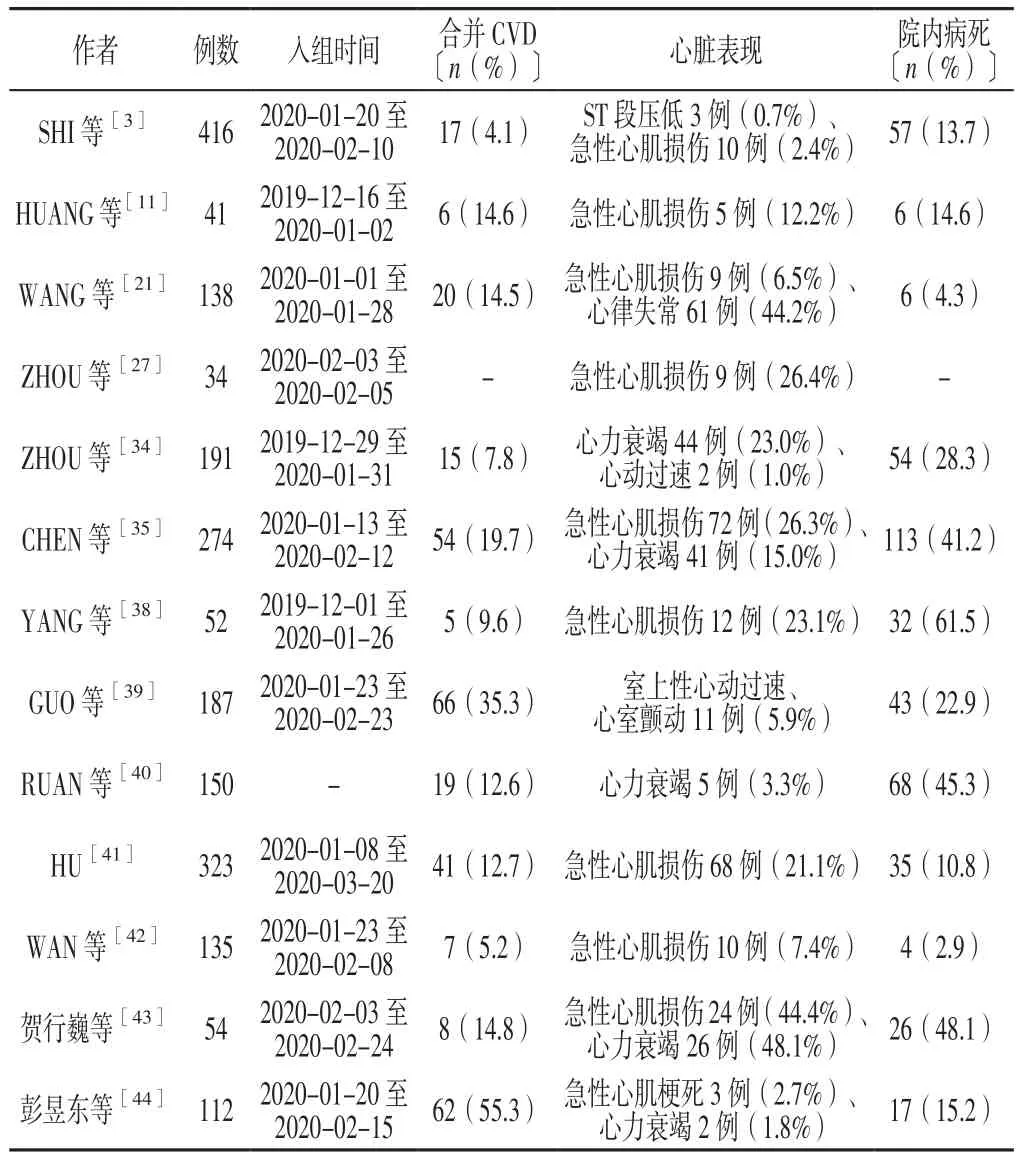
表1 COVID-19对心脏影响的不同研究对比Table 1 Comparison of different studies of impact on the heart in COVID-19
4 小结与展望
COVID-19患者心脏损伤的主要症状包括胸痛、心悸、气促和乏力,与单纯COVID-19呼吸道表现相似。已有研究表明,SARS-CoV-2可引起心脏免疫激活和心功能障碍,导致靶组织纤维化和微血管病变,从而对心血管系统造成慢性损伤[45]。因此,建议最初有心脏损伤的COVID-19患者每1~3个月随访1次,并详细记录患者病史及体格检查结果,通过12导联心电图和多普勒超声心动图评估心脏情况。期待今后更多的研究从机制、治疗等各方面进行更深入的探索,为COVID-19患者治疗提供参考。
作者贡献:贾硕进行资料/文献的收集整理,撰写论文;程功进行审校,并对文章整体负责、监督管理。
本文无利益冲突。
文献检索策略:
计算机检索 PubMed、The Cochrane Library及中国期刊全文数据库、万方数据知识服务平台有关新型冠状病毒肺炎(COVID-19)患者心脏损伤机制及其表现的相关文献,检索时间均为建库起至2020年5月。中文数据库以“新型冠状病毒”“新冠肺炎”“心血管”“心肌”等为主题词,英文数据 库以“coronavirus”“SARS-CoV-2”“COVID-19”“cardiovascular”“cardiac”为主题词,主题词和自由词相结合的方式进行检索。

