抗着丝点抗体阳性的原发干燥综合征临床及实验室特征分析
史洪博,吕俊楠
0 引 言
干燥综合征(Sjögren′s syndrome,SS)是一种主要累及外分泌腺体的慢性炎症性自身免疫性疾病,临床以口干、眼干等症状为主要表现,还可累及其他外分泌腺以及多器官系统。抗着丝点抗体(anti-centromere antibody,ACA)是经典的抗核抗体荧光染色模型,除可见于CREST综合征外,也可见于其他自身免疫病,如原发性胆汁性肝硬化、系统性硬化症、SS、类风湿性关节炎、系统性红斑狼疮等[1]。在临床中,pSS患者ACA阳性检出率3%~27%[2-5];且一般不与抗SSA和(或)抗SSB抗体同时出现。有研究认为ACA阳性可能是SS的亚类[6];但ACA阳性的临床特征尚未明确。本研究对88例包括ACA阳性和ACA阴性的pSS病例资料进行回顾性分析,旨在探索ACA阳性pSS的临床特征。
1 资料与方法
1.1一般资料回顾性分析2015年1月—2018年12月我院风湿免疫科就诊88例pSS患者临床资料,其中ACA阳性pSS患者(阳性组)43例均为女性,年龄33~86岁,平均(63.0±11.1)岁;ACA阴性pSS患者(阴性组)45例,其中女43例、男2例,年龄30~84岁,平均(57.7±12.5)岁。所有患者诊断均符合2016年美国风湿病学会/欧洲风湿病联盟共识中pSS最新的分类(诊断)标准。排除标准:①头颈部放射治疗史;②活动性HCV肝炎(PCR检查);③艾滋病;④结节病;⑤淀粉样变;⑥移植物抗宿主病;⑦IgG4相关疾病[7]。
1.2研究方法抗核抗体(antinuclear antibody,ANA)和抗线粒体抗体(antimitochondrial antibody,AMA)测定采用间接免疫荧光法(欧蒙公司);抗SSA、SSB抗体,抗AMA-M2抗体,抗AMA-M2抗体3E亚型采用免疫印迹法(欧蒙公司);IgG、IgA、IgM、RF以西门子BNⅡ全自动蛋白分析仪进行检测,采用散射比浊法测定。谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBIL)、直接胆红素(direct bilirubin,DBIL)采用日立7600全自动生化分析仪检测,ALT、AST、ALP、GGT测定方法采用速率法检测,TBIL和DBIL测定方法采用酶法检测。

2 结 果
2.1一般资料阳性组pSS患者发病年龄高于阴性组患者,差异有统计学意义(P<0.05)。2组患者性别比例、RBC、WBC、PLT,RDW、ESR、CRP等指标差异均无统计学意义(P>0.05)。见表1。

表 1 入组pSS患者一般资料比较
2.2临床资料阳性组中雷诺现象阳性率高于阴性组,差异有统计学意义(P=0.021)。乏力现象更易见于阴性组,差异有统计学意义(P=0.022)。而两组患者在口干、眼干、呼吸道干燥、皮疹、龋齿、关节肿痛和发热等方面差异无统计学意义(P>0.05)。见表2。

表 2 入组pSS患者临床表现比较[n(%)]
2组pSS患者合并原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)发生率差异有统计学意义(P<0.05);而在低钾血症、间质性肺炎、肺间质纤维化、肾功能异常、贫血、白细胞减少、血小板减少、合并肿瘤方面的发生率差异无统计学意义(P>0.05)。 见表3。

表 3 入组pSS患者系统损害情况比较 [n(%)]
2.3实验室检测结果比较
2.3.1 生化免疫指标阳性组的AST、ALP、GGT、IgM水平高于阴性组,IgG和IgA水平低于阴性组,差异均有统计学意义(P<0.05)。而ALT、TBIL、DBIL水平组间差异无统计学意义(P>0.05)。见表4。

表 4 入组pSS患者生化免疫指标的比较[M(P25,P75)]
2.3.2自身抗体阳性组的抗SSA、抗SSB抗体和RF的阳性率显著低于阴性组,AMA、AMA-M2阳性率高于阴性组,差异有统计学意义(P<0.05);阳性组AMA-M2抗体3E亚型的阳性率高于阴性组,但差异无统计学意义(P=0.058)。见表5。
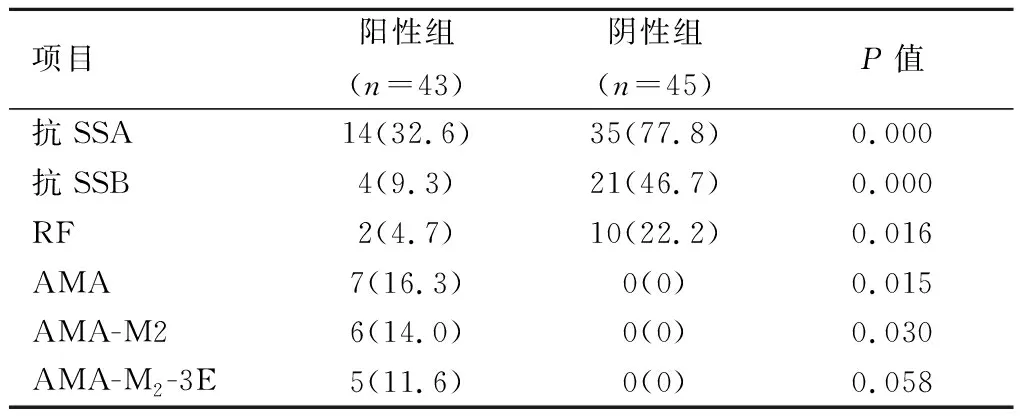
表 5 入组pSS患者自身抗体检测结果的比较 [n(%)]
3 讨 论
ACA是一种针对染色体着丝粒蛋白的抗核抗体,是常见的抗核抗体荧光染色模型。ACA长期被认为是皮肤钙质沉着(Calcinosis, C)、雷诺现象(Raynaud's syndrome, R)、食管张力减低(Esophageal dysmotility, E)、指趾硬化(Sclerodactyly, S)和毛细血管扩张(Telangiectasis, T)—CREST综合征的特异性抗体,阳性率达80%~98%。除CREST综合征,ACA还可见于SLE、SS、RA、PBC等自身免疫病[8]。SS是一种慢性炎症性自身免疫病,主要表现为口眼干燥,也可伴有多器官多系统的损害。有研究发现,ACA阳性pSS患者在发生腺外系统受累[9]和淋巴瘤的风险性增加[10]。还有研究者提出ACA阳性可能是pSS一种独特亚型的假设[11]。本研究选取了43例ACA阳性pSS与45例ACA阴性pSS患者进行回顾性分析研究。
本研究结果显示,两组患者年龄差异有统计学意义。已有较多文献报道ACA阳性pSS患者年龄偏大的特点[4,12-14]。阳性组患者出现雷诺现象多于阴性组,与Tsukamoto等[9]研究一致。Nakamura等[14]认为ACA阳性pSS患者常伴雷诺现象,可能与其具有低细胞浸润和纤维组织增加的病理特点有关。高明等[15]的研究发现,在ACA阳性患者中,雷诺现象的发生率为55.8%,高发可能也与ACA的存在有一定关系。在一般表现上,阳性患者更少出现乏力症状,此结果与颜淑敏等[13]的报道一致。pSS相关性乏力可由血清IgG水平升高、抑郁情绪加重和病程延长等影响因素有关。ACA阳性pSS患者高球蛋白血症发生率较低,故可以解释ACA阳性pSS较少出现乏力的现象[13]。本研究结果显示阳性患者IgG水平低于阴性组。此外,本研究发现两组患者性别比例、血常规(RBC、WBC、PLT、RDW)、CRP和血沉等指标,以及口干、眼干、呼吸道干燥、皮疹改变、龋齿、关节痛和发热等临床表现方面阳性率差异无统计学意义。但Li等[16]通过对pSS患者问卷调查和客观的检测认为与ACA阴性的pSS患者相比,ACA阳性的pSS患者易出现更为严重的眼干和口干。Tanaka等[17]认为ACA抗体水平与小唾液腺唾液流量减少和炎症表现显著相关。目前尚不清楚ACA抗体是否在腺体分泌中起抑制作用。
pSS患者多数可伴有单个或多个器官、系统损害。pSS常合并其他结缔组织病如自身免疫性肝病,最常见即为PBC并存[18]。AMA-M2是PBC特异性和敏感度最强的指标,可在肝功能出现异常前数年出现,也可用于原发干燥综合征合并PBC的早期监测[19]。本研究中ACA阳性pSS患者伴发PBC 6例,发病率为16.3%,而阴性组中并未出现。ACA(+)pSS合并PBC发生率显著高于阴性组。ACA阳性pSS组患者生化指标ALP、GGT显著升高,当pSS患者出现此两项指标异常时,应警惕是否出现了肝受损。
pSS起病隐匿,早期症状缺乏特异性,且患者常在出现其他器官系统受损后才就诊,导致pSS的早期诊断十分困难,自身抗体可于疾病出现症状的几年至十几年即可出现,故自身抗体检测对于早期发现pSS至关重要[20]。本研究发现,与阴性组相比较,阳性组患者抗SSA、SSB抗体阳性率低,且RF异常升高少见,差异有统计学意义(P<0.05),与Li等[16]研究结果相符。按照pSS分类(诊断)标准,这意味着许多仅出现ACA阳性的患者需通过唾液腺活检诊断pSS,且在腺体破坏之前,难以实现与仅与ACA相关的pSS的早期诊断。抗SSA、SSB抗体一直被视为诊断原发干燥综合征的标志性抗体,其诊断pSS的特异性分别为83.8%和97.7%[21];但其敏感性不高,仅为45.5%和30.9%。而近年来,一些研究发现在抗SSA/SSB抗体阴性的pSS患者中,ACA阳性并不罕见,且ACA阳性pSS可能为该病的一种亚型,故ACA也可作为一项诊断pSS的筛选指标。因此,在疾病诊断时,当患者出现口干、眼干、关节痛等一般症状,而抗SSA、SSB抗体阴性时,还应留意是否存在ACA阳性,并结合阳性患者相关临床特征和其他诊断标准,提高pSS诊断的灵敏度和准确性,及早诊断防止该疾病的漏诊和误诊。
总之,ACA阳性pSS在临床表现和实验室指标上与ACA阴性的pSS具有一些不同特点,可能是不同于一般pSS的新的临床特征,但仍需进行大量的临床研究来证明。

