SAMHD1通过调控p27表达抑制肝细胞癌细胞增殖的研究
重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400016
肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的85%~90%,是全球第4大常见的癌症相关死亡原因[1]。虽然目前一些新颖的治疗方法(靶向治疗和生物治疗)越来越受欢迎,但其治疗效果仍不能令人满意[2],并且由于乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)等病毒感染,酗酒和黄曲霉素等多因素,近20年来发病率有所增加[3-5]。因此进一步探寻HCC发生、发展的分子机制及新靶点尤为重要。
不育α基序结构域和组氨酸/天冬氨酸残基双联体结构域包涵蛋白1(sterile alpha motif and histidine/aspartic acid domain-containing protein 1,SAMHD1)是真核细胞中目前发现的唯一可以降解细胞内脱氧核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)的核苷酸水解酶[6],通过降解细胞内dNTP含量来限制HBV、人类免疫缺陷病毒(human immunodeficiency virus,HIV)等病毒的复制而发挥抗病毒作用[7-8]。目前大量研究表明,SAMHD1与肿瘤的发生、发展密切相关,SAMHD1抑制人T淋巴细胞白血病细胞增殖和诱导凋亡水平升高,在结肠癌中发现SAMHD1基因频繁突变导致dNTP池失衡等[9-11]。Shi等[12]研究了HCC中SAMHD1基因的突变,结果提示SAMHD1外显子4的插入可能作为HCC发生的标志。然而关于SAMHD1在HCC中的作用及相关机制尚不清楚,因此本文主要通过构建过表达SAMHD1的稳定细胞系来研究SAMHD1对HCC细胞增殖和凋亡的影响,为阐明SAMHD1在HCC发生、发展过程中的分子机制奠定一定的基础。
1 材料和方法
1.1 细胞、质粒及主要试剂
L02、PLC/PRF/5、Hep3B、Huh7和HepG2细胞系均由重庆医科大学感染性疾病分子生物学教育部重点实验室长期保存。pCDH-CMV-MCSEF1-copGFP-T2A-Puro慢病毒表达载体购自日本SBI公司。胎牛血清(fetal bovine serum,FBS)购自重庆欣洛克生物技术有限公司,SAMHD1抗体购自美国Bioworld公司,p27抗体购自美国CST公司,BamHⅠ限制性内切酶和XbaⅠ限制性内切酶购自美国NEB公司,TRIzol Reagent和LipofectamineTM3000转染试剂购自美国Invitrogen公司。si-SAMHD1质粒[8]、引物和测序由上海英骏生物技术有限公司完成。
1.2 细胞培养和细胞转染
实验所用的细胞正常培养均用含10%FBS的DMEM 培养基,于37 ℃、CO2体积分数为5%的细胞培养箱中培养,细胞转染按照LipofectamineTM3000试剂盒说明书转染至Huh7细胞中。
1.3 过表达SAMHD1重组质粒的构建
SAMHD1表达质粒由北京义翘神州科技有限公司构建,根据SAMHD1基因的cDNA序列和pCDH载体多克隆位点序列,将SAMHD1表达载体的cDNA序列通过PCR扩增,然后BamHⅠ和XbaⅠ进行双酶切,通过T4 DNA连接酶克隆到pCDH载体上,然后采用定点突变方法[13]构建SAMHD1 dNTP酶突变体和T592E磷酸化突变体,测序鉴定。PCR扩增和定点突变引物序列见表1。
1.4 3种过表达SAMHD1稳定细胞系的验证
将3种构建成功的重组质粒SAMHD1-WT、SAMHD1-D207N、SAMHD1-T592E与空载体一起利用慢病毒包装系统,转染HEK293细胞收集病毒,浓缩纯化后感染Huh7细胞,用2 μg/mL的嘌呤霉素筛选阳性细胞,10 d后提取4种细胞系的蛋白,采用蛋白质印迹法(Western blot)验证SAMHD1的表达情况。

表1 目的基因的引物和siRNA序列Tab.1 Sequences of target primers and siRNA
1.5 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测SAMHD1对Huh7细胞增殖的影响
分别将筛选的稳定表达SAMHD1-WT、SAMHD1-D207N、SAMHD1-T592E蛋白的Huh7细胞和对照组,或转染干扰SAMHD1的特异性siRNA与NC组的Huh7细胞种板培养,待细胞长至约90%的融合密度时,消化离心后计数,每孔共计4 000个细胞于96孔板中,MEM培养基补充至100 μL,每个样本重复9个复孔。用细胞计数IncuCyte ZOOM每天依次记录细胞的生长速度。
1.6 流式细胞术检测SAMHD1对HCC细胞周期和凋亡的影响
将上述6种细胞用不含10%FBS的MEM培养基饥饿处理,使细胞大部分处于G0期,然后用10%FBS的MEM培养基刺激,使细胞向S期转换,加入血清2 d后,收集细胞弃上清液,用预冷的70%的乙醇溶液悬浮细胞沉淀,4 ℃过夜后收集细胞沉淀,加入100 μL RNase A液,37 ℃水浴30 min,加入400 μL碘化丙啶(propidium iodide,PI)溶液,4 ℃避光温育30 min,采用流式细胞术检测细胞周期。正常培养4种细胞系至对数生长期,经0.25%胰酶消化细胞后,收集细胞沉淀用100 μL PBS重悬,加入195 μL Annexin V-FITC结合缓冲液再次混匀,加入5 μL Annexin V-FITC摇匀,室温避光温育10 min,离心后再加入190 μL Annexin V-FITC结合液和10 μL PI溶液,冰浴避光放置后用流式细胞术检测细胞的凋亡。
1.7 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测过表达SAMHD1对细胞周期蛋白和相关激酶mRNA水平的影响
4种稳定细胞系加入TRIzol试剂裂解后,加入氯仿离心,上清液加入异丙醇沉淀,风干后用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水溶解得到总mRNA,进一步反转录为cDNA,通过RTFQ-PCR测定目的基因的Ct值,采用2-△△Ct方法计算相对表达水平。
1.8 统计学处理
采用SPSS 20.0统计软件对数据进行处理。实验中所有显示数据为,统计分析运用χ2检验,两组比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SAMHD1在正常肝细胞和HCC细胞系中的表达
首先利用Western blot检测SAMHD1在正常肝细胞L02和4种HCC细胞系(PLC/PRF/5、Hep3B、Huh7、HepG2)中的蛋白水平差异,结果表明,相较于正常肝细胞L02,SAMHD1蛋白表达水平在4种HCC细胞中明显增加,其中HepG2细胞中增加4.3倍,PLC/PRF/5细胞中增加3.7倍、Hep3B细胞中增加2.3倍、Huh7细胞中增加1.7倍(图1)。
2.2 过表达SAMHD1 的稳定细胞系和s i-SAMHD1干扰效率验证
由于SAMHD1在Huh7细胞系中表达较其他3种HCC细胞系相对较低,因此选择在Huh7细胞系中过表达和沉默SAMHD1基因来研究其对细胞增殖的影响。将SAMDH1 cDNA克隆到pCDH表达载体后,进一步通过定点突变构建了SAMHD1-D207N和SAMHD1-T592E突变体,序列比对正确(图2A)后转染Huh7细胞,通过嘌呤霉素筛选得到的稳定细胞系提取蛋白后,采用Western blot对蛋白表达情况进行检测,结果表明,相对于对照组,构建的SAMHD1及突变体能够正常表达(图2B)。将si-NC与si-SAMHD1转染至Huh7细胞,48 h后用Western blot检测SAMHD1的表达,结果表明,与si-NC相比,干扰SAMHD1组蛋白的表达水平显著降低(图2B)。

图1 SAMHD1在正常肝细胞和HCC细胞系中的表达Fig.1 The expression of SAMHD1 in normal liver cells and HCC cell lines

图2 过表达SAMHD1序列比对和si-SAMHD1干扰效率验证Fig.2 The sequence alignment of SAMHD1 and the silencing efficiency of si-SAMHD1 in Huh7 cells
2.3 细胞增殖实验检测SAMHD1对HCC细胞增殖的影响
采用MTT 法检测过表达SAMHD1 或沉默SAMHD1 基因对细胞增殖的影响,结果显示,与对照组(23.51±0.42)相比,从第2天开始,构建的SAMHD1过表达稳定细胞系SAMHD1-WT(19.23±0.44)、SAMHD1-D207N(20.06±1.30)、SAMHD1-T592E(17.74±0.27)增殖速度均减慢,差异有统计学意义(P<0.001);而过表达野生型SAMHD1基因和两个突变体之间的增殖速度差异无统计学意义(P=0.1344)。相反,干扰SAMHD1组增殖速度显著高于对照组(64.44±0.38)(图3A~B),表明SAMHD1可以抑制HCC细胞Huh7的生长,并且这种抑制作用与其dNTP酶活性和T592磷酸化无关。

图3 SAMHD1对Huh7细胞增殖的影响Fig.3 Effect of SAMHD1 on the proliferation of Huh7 cells
2.4 SAMHD1对HCC细胞周期的影响
将构建的过表达稳定细胞系和转染si-SAMHD1的Huh7细胞通过流式细胞术检测SAMHD1对Huh7细胞周期的影响,结果显示,与对照组相比,SAMHD1-WT、SAMHD1-D207N和SAMHD1-T592E在G1/G0期所占的比例均增加,G2/M期减少(图4A);相反,当沉默SAMHD1基因后,与si-NC相比,si-SAMHD1在G1/G0期所占的比例减少,G0/M期明显增加(图4B),说明SAMHD1对细胞周期有影响。
2.5 过表达SAMHD1对细胞凋亡的影响
流式细胞术结果显示,对照组的早期凋亡为(2.12±0.26)%,SAMHD1-WT为(3.16±0.47)%,SAMHD1-D207N为(2.65±0.58)%,SAMHD1-T592E为(2.4 1±0.21)%;对照组的晚期凋亡为(6.05±1.02)%,SAMHD1-WT 为(5.20±1.25)%,SAMHD1-D207N 为(5.23±1.25)%,SAMHD1-T592E 为(6.64±1.48)%,过表达SAMHD1和两个突变体与对照组相比,早期凋亡和晚期凋亡均无明显变化,差异无统计学意义(P>0.05,图5),说明SAMHD1不影响HCC细胞的凋亡。
2.6 过表达SAMHD1后相关基因的mRNA和蛋白水平的变化
由于SAMHD1显著调控HCC细胞周期,因此进一步通过RTFQ-PCR检测了过表达SAMHD1后,细胞周期主要的蛋白激酶、周期蛋白和周期蛋白激酶抑制剂的表达,结果显示,过表达SAMHD1后,p27的mRNA水平明显上调,而其他周期相关基因无明显变化(图6A),进一步采用Western blot检测表明,过表达SAMHD1导致p27蛋白水平明显上调,并且与其dNTP酶活性和T592E磷酸化无关(图6B)。
2.7 p27与SAMHD1的相关性
进一步在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中应用Pearson相关性分析373例HCC患者肿瘤组织中p27与SAMHD1表达的相关性,结果显示,在转录水平上p27与SAMHD1表达呈一定的正相关,差异有显著统计学意义(r=0.2812,P<0.000 1,图7),表明HCC组织中SAMHD1与p27表达存在一定正相关性。
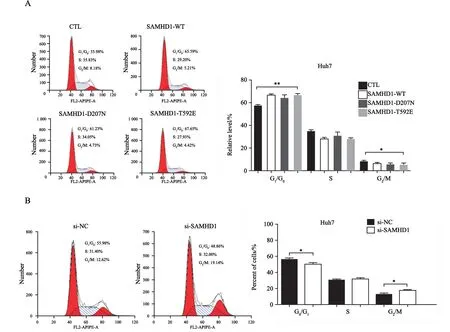
图4 SAMHD1对HCC细胞Huh7周期影响Fig.4 The effect of SAMHD1 on the cycle of Huh7

图5 过表达SAMHD1对HCC细胞Huh7凋亡影响Fig.5 The effect of SAMHD1 overexpression on apoptosis of Huh7 cells

图6 在Huh7中过表达SAMHD1对相关基因的影响Fig.6 The effect of relative genes in Huh7 cells overexpressing SAMHD1
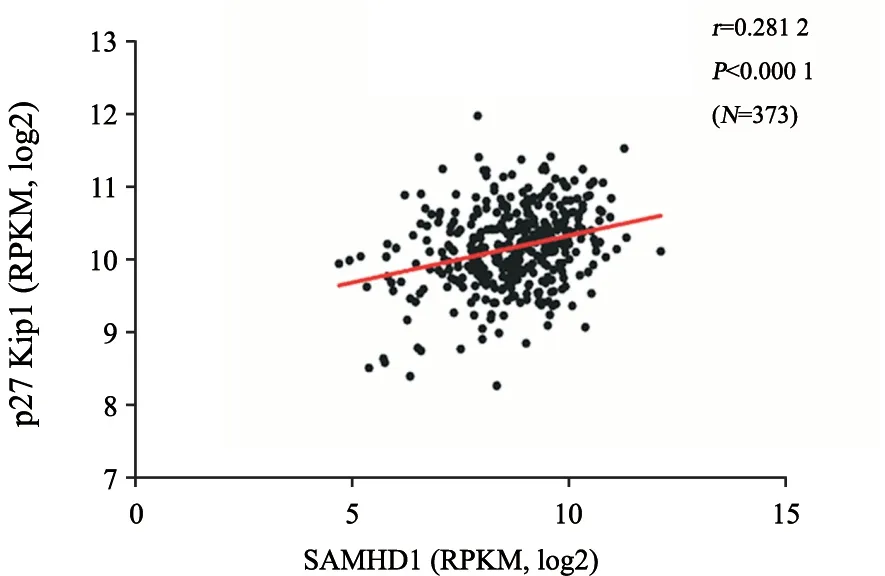
图7 373例HCC肿瘤组织中p27与SAMHD1表达的相关性Fig.7 The Pearson correlation between p27 and SAMHD1 in 373 HCC samples in TCGA database
3 讨 论
HCC作为一种多基因参与的恶性实体肿瘤,具有转移早、浸润/增殖快、高侵袭性、低治疗率、预后差等特点[14]。Wang等[15]发现,在肺腺癌中SAMHD1基因启动子发生甲基化修饰而表达下降,过表达SAMHD1后可以抑制肺肿瘤细胞的增殖。Clifford等[16]发现,在慢性淋巴细胞白血病患者中,有11%发生SAMHD1 突变,且SAMHD1 的表达减少,提示SAMHD1可能参与肿瘤的发生、发展。细胞周期蛋白激酶抑制因子p27是一种肿瘤抑制基因,通过多种机制如作用于CDK2/cyclin E抑制肿瘤的增殖[17]。最近一项研究[18]报道,在急性髓系白血病中,SAMHD1通过PI3K-AKT信号通路调控p27的磷酸化和进入细胞核抑制THP-1细胞增殖,提示SAMHD1与肿瘤密切相关,但是目前关于SAMHD1对HCC发生、发展的影响研究尚少。
本研究首先发现在4种HCC细胞(PLC/PR F/5、Hep3B、Huh7、HepG2)系中,SAMHD1表达明显高于正常肝细胞系L02。进一步通过构建慢病毒包装的SAMHD1和突变体(包括SAMHD1-D207N和SAMHD1-T592E)稳定转染细胞系探索SAMHD1对细胞增殖和细胞周期的影响,结果表明,过表达SAMHD1可抑制HCC细胞Huh7的增殖,导致细胞停滞在G1/G0期。相反,沉默SAMHD1基因后,细胞G2/M期比例增加,细胞增殖加快。SAMHD1依赖于dNTP酶活性和T592E位点磷酸化调控病毒复制,但是SAMHD1的这两种突变仍然具有抑制HCC增殖的功能,表明SAMHD1抑制肿瘤增殖不依赖于其dNTP酶活性和T592E磷酸化。进一步研究发现,SAMHD1过表达导致细胞周期蛋白激酶抑制因子p27表达上调,TCGA数据库分析在HCC临床样本中,SAMHD1和p27的表达存在一定的正相关性,表明SAMHD1抑制HCC增殖是通过调控p27的表达上调。
综上所述,SAMHD1与HCC的增殖密切相关,SAMHD1通过上调p27的表达,导致HCC细胞Huh7停滞在G1/G0期,从而抑制HCC细胞Huh7的增殖,该结果有助于确立基于SAMHD1的HCC防治新策略。

