胰腺癌术后辅助性放化疗的效果及预后因素分析
张晓萌,麻宁一,祝鸿程,艾沓杉,任志刚
1.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032;2.上海市质子重离子医院放疗科,上海 201315
胰腺癌是常见的消化道恶性肿瘤,2015年,胰腺癌发病率居中国恶性肿瘤发病率第9位,肿瘤相关死亡率居第6位[1]。作为恶性程度较高的肿瘤之一,其5年自然存活率低于5%[2]。手术是胰腺癌唯一可能的治愈方式,然而由于术后仍有较高的复发转移率,单纯胰腺癌根治术后的5年存活率不超过20%[3]。因此临床上手术联合放化疗等多学科综合治疗是目前研究的方向。
R0 根治术后的胰腺癌患者远处转移率高达76%[4],术后辅助性放化疗是否能够降低远处转移及进一步提高生存率仍存在争议[5-6]。区域动脉灌注化疗(regional intraarterial infusion chemotherapy,RIAC)作为特殊的化疗方式已经广泛应用于肝癌、胰腺癌等恶性肿瘤的治疗中,通过提高肝脏局部的药物浓度,使减少肝转移率成为可能[7]。然而,其对患者生存及远处转移的影响仍没有定论[8]。
本研究系统回顾了于复旦大学附属肿瘤医院接受辅助性放疗联合化疗(包括系统化疗及RIAC)的88例胰腺癌患者,对其总生存期(overall survival,OS)、无远处转移生存期(metastasis-free survival,MFS)、转移模式及其可能的预后因素进行探讨,以进一步明确辅助性放化疗在多学科综合治疗中的作用。
1 资料和方法
1.1 病例选择
对所有2011年12月—2018年6月在复旦大学附属肿瘤医院接受治疗的胰腺癌患者的病历资料进行分析。入选标准:①病理学检查明确诊断为胰腺癌;②年龄<80岁;③R0切除术后;④术后接受了放疗及系统化疗;⑤放疗前无复发转移。排除标准:①病理学检查为神经内分泌肿瘤及腺鳞癌;②术前接受新辅助化疗;③未行同步放化疗;④失访。排除10例失访,7例术前新辅助化疗,4例未行同步放化疗,3例腺鳞癌及1例神经内分泌肿瘤患者。最后纳入资料完备、随访完整的88例患者进行研究。
1.2 治疗方案
患者的临床病理学特征详见表1。所有患者均接受了术后辅助性放疗联合系统化疗的综合治疗,63例患者术后曾行RIAC。放疗时,患者取仰卧位,采用体部真空垫固定。CT模拟定位时,患者口服2%泛影葡胺200 mL后15 min,行增强CT扫描(肿瘤部位层厚3 mm,其他部位5 mm)。在定位CT图像上勾画靶区,临床靶区(clinical target volume,CTV)包括瘤床(包括手术银夹)、胰肠吻合口及区域淋巴引流区。计划靶区(planning target volume,PTV)在CTV基础上外放5~15 mm。所有患者均采用调强放疗,放疗计划根据剂量体积直方图进行优化,要求95%处方剂量线包括100%PTV,同时十二指肠、胃、小肠、肝脏、肾脏和脊髓等正常组织均在耐受剂量范围内。放射治疗使用直线加速器6 MV X线,中位剂量为50.4 Gy(45.0~50.4 Gy),常规分割照射(1.8~2.0 Gy/次)。RIAC方案:吉西他滨1.0 g/m2,奥沙利铂100 mg/m2,氟尿苷0.5 g/m2,通过Seldinger术经股动脉插入导管,经腹腔干及肠系膜上动脉灌注化疗,其中2/3剂量选择注入腹腔干,1/3剂量注入肠系膜上动脉,每4周1次。系统化疗包括S-1及吉西他滨为基础的联合化疗方案。

表1 胰腺癌患者的一般临床特征Tab.1 Clinical characteristics of pancreatic carcinoma patients
1.3 随访
在治疗期间,患者每周进行1次随访评估,包括常规体检、血常规及血生化。治疗结束后每3个月左右进行1次随访,包括以上的常规检查项目及B超、CT、MRI、正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)、肿瘤标志物等检查。主要的研究终点为OS、MFS及预后因素。次要的研究终点为不良反应[美国国立癌症研究所(National Cancer Institute,NCI)通用不良事件术语标准(Common Terminology Criteria Adverse Events,CTCAE)3.0版]及转移模式。
1.4 统计学处理
采用SPSS 20.0统计软件对数据进行处理。生存分析采用Kaplan-Meier法,两组间的生存率差异比较采用log-rank检验。将单因素分析中P<0.20的因素纳入后续的多因素分析中,采用COX回归模型。两组间转移率比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 OS及MFS
末次随访时间为2019年12月,中位随访时间23.5(4.9~64.1)个月。31例患者死亡,57例存活。中位OS为27.0个月,1、3及5年OS率分别为85.1%、30.4%及24.6%。中位MFS为19.9个月,1、3年MFS率分别为77.5%、28.0%,5年MFS率未达到(图1)。共68例患者治疗失败,其中局部复发10例,远处转移38例,局部复发伴远处转移20例。远处转移部位依次为肝(23/88)、大网膜和腹腔(15/88)、肺(10/88)、腹壁(6/88)、骨(4/88)。
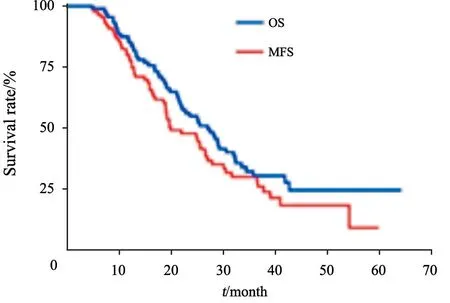
图1 胰腺癌患者OS及MFS生存曲线Fig.1 Estimates of OS and MFS in pancreatic carcinoma patients
2.2 预后因素
单因素及多因素分析结果详见表2~3。单因素分析显示,术后辅助性放疗联合RIAC较未联合RIAC获得更好的MFS(25.4个月vs14.9个月,P=0.036)。多因素分析显示,RIAC是MFS的保护性因素(HR=1.888,95% CI:1.042~3.422,P=0.048)。同时,联合RIAC患者较未联合RIAC患者显示出降低肝转移率的趋势,但差异无统计学意义(表4)。
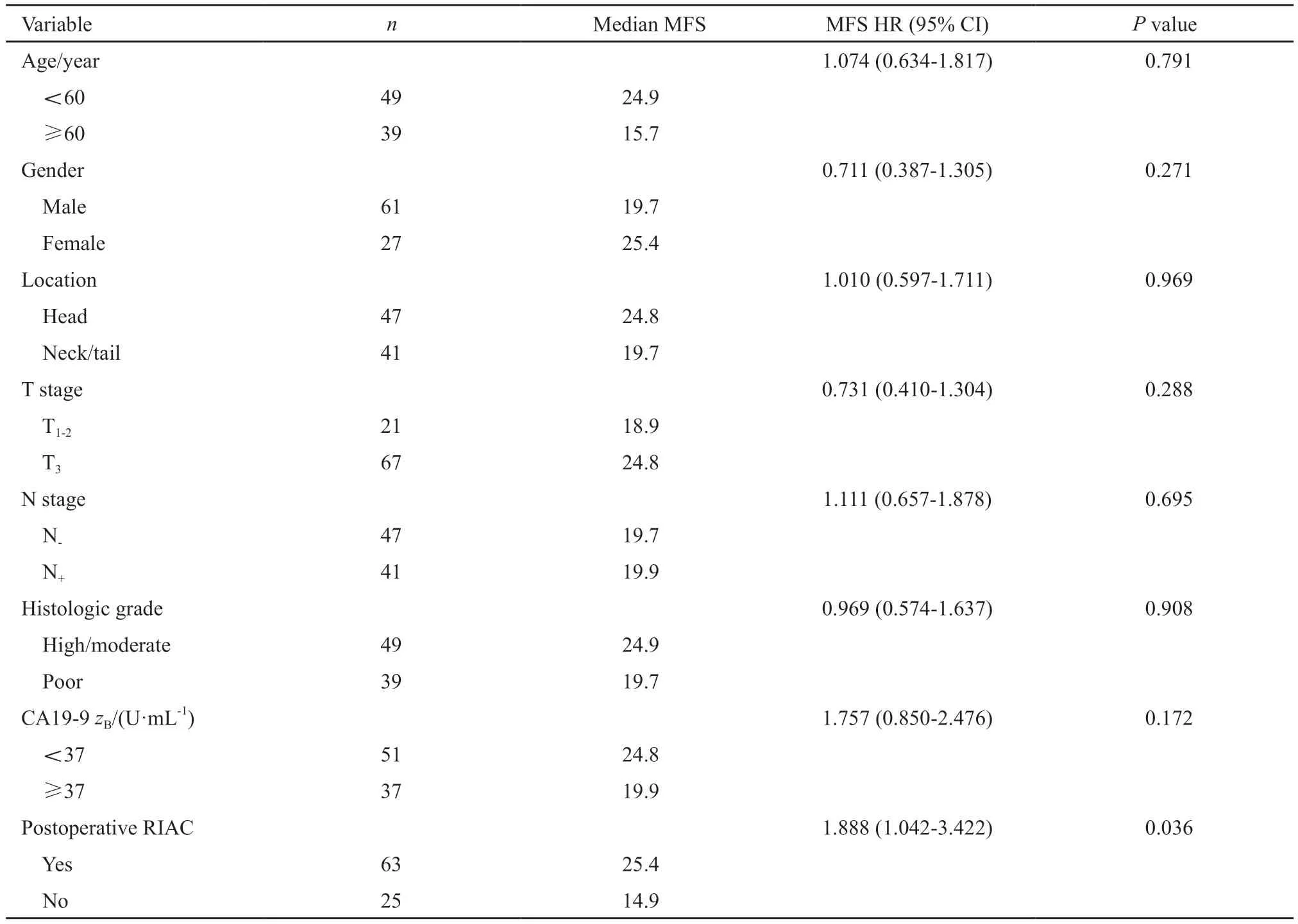
表2 影响胰腺癌患者MFS的单因素分析Tab.2 Univariate analysis for prognostic factors affecting MFS in pancreatic carcinoma patients
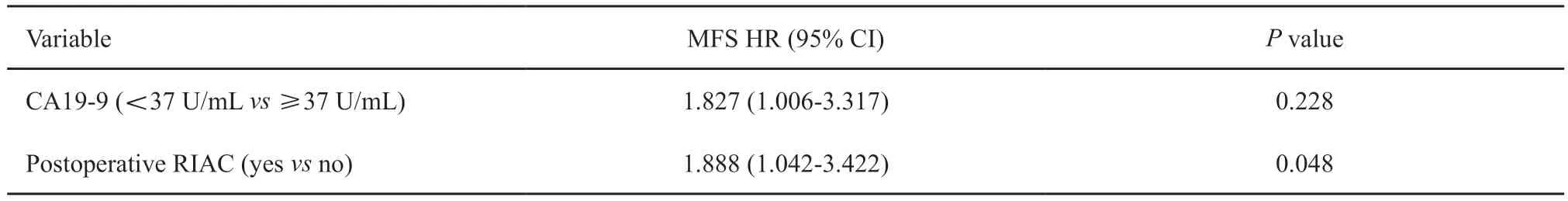
表3 影响胰腺癌患者MFS的多因素分析Tab.3 Multivariate analysis for prognostic factors affecting MFS in pancreatic carcinoma patients

表4 RIAC对总体远处转移及肝转移的影响Tab.4 Effect of RIAC on total distant metastasis and liver metastasis
2.3 不良反应
总体上患者对术后辅助性放化疗耐受性良好,治疗相关不良反应详见表5。不良反应主要为血液学毒性,其次是胃肠道反应和肝肾功能损伤。发生0、1、2、3、4和5级不良反应的患者分别为0例(0.0%)、3例(3.4%)、11例(12.5%)、53例(60.2%)、21例(23.9%)和0例(0.0%)。3~4级治疗相关不良反应主要为血液学毒性,未见4级非血液学毒性,无治疗相关性死亡发生。
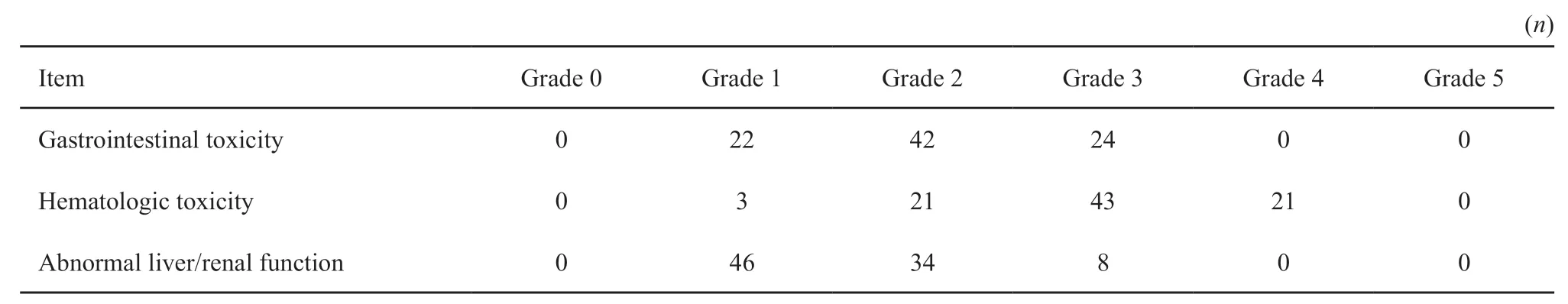
表5 胰腺癌患者治疗后不良反应Tab.5 Treatment-related toxicities in pancreatic carcinoma patients
3 讨 论
CONKO-001研究[9]证实,术后辅助化疗组胰腺癌患者的5年OS率达到20.7%,明显高于术后观察组,从而使术后辅助化疗成为胰腺癌术后辅助治疗的标准治疗方法,然而术后辅助性放疗的价值还有待进一步论证。Kamarajah等[10]回顾性分析美国国家癌症数据库(National Cancer Database,NCDB)中7 720例R0切除的胰腺癌患者,接受术后辅助放疗的患者中位OS为25.8个月,明显优于未接受术后辅助放疗的患者。本研究的88例胰腺癌患者中位OS为27.0个月,1、3及5年OS率分别为85.1%、30.4%及24.6%,中位MFS达19.9个月,1、3年MFS率达77.2%、28.8%,结果令人鼓舞,也显示出辅助性放疗在胰腺癌术后综合治疗中的重要作用。
胰腺癌治疗后最主要的失败方式为远处转移,尤其是肝转移。术后辅助性放疗的价值之所以一直未被肯定,可能与放疗提高局部控制率对OS的贡献被过高的远处转移率所抵消有关,减少胰腺癌术后患者的肝转移率有可能进一步提高辅助性放疗的价值。因此,本研究尝试术后辅助性放疗联合系统化疗的同时,部分患者给予RIAC。理论上,RIAC可以明显提高瘤床局部的药物浓度,从而提高肿瘤的局部控制率及减少肝等远处转移可能[11]。一项随机临床研究[7]显示,胰腺癌患者术后行RIAC,其肝转移率降低到17%,并且OS较未行RIAC患者明显提高。但也有研究[8]显示,术后RIAC未能明显降低肝转移发生。本研究显示,术后辅助性放疗联合RIAC的患者显示出与前者类似的趋势,未联合RIAC患者的肝转移率为32%,联合RIAC则下降到23.8%,而差异未达到统计学意义考虑可能是样本量较少所致。进一步分析,联合RIAC的患者明显延长了MFS,中位MFS达25.4个月,远高于未联合RIAC患者的14.9个月(P=0.036)。多因素分析也明确RIAC是MFS的保护性因素(P=0.048),说明术后辅助性放疗联合RIAC不但有减少肝转移的趋势,也能够明显延缓远处转移发生的时间。由于本研究为回顾性研究,有必要进行前瞻性随机对照研究来进一步证实RIAC在术后放疗胰腺癌患者中的有效性。
已有研究[12]显示,同步放化疗较单纯放疗会导致更多的治疗相关不良反应。本研究的所有患者均接受了同步放化疗及系统化疗,部分患者也接受了RIAC,结果显示,患者整体对同步放化疗耐受性良好。所有患者均没有发生4级非血液学毒性及治疗相关性死亡,这与其他研究结果[13]一致。
综上所述,胰腺癌根治术后患者接受放疗联合化疗是安全的,并取得了令人鼓舞的疗效。术后放化疗后的治疗失败仍以远处转移为主,其中最常见为肝转移。术后辅助性放化疗联合RIAC较未联合RIAC治疗有降低肝转移率的趋势,并且明显延长患者的MFS,推荐其作为胰腺癌术后综合治疗模式的一种选择。

