小野寺预后营养指数与食管鳞癌同步放化疗不良反应的相关性研究
山东大学齐鲁医院放疗科,山东 济南 250012
世界卫生组织公布的2018年全球癌症发病率和死亡率的统计资料表明,全球食管癌的发病率在癌症占比中位居第7位,新发病例572 034例,总死亡人数达508 585例,在癌症占比中位居第6位,约70%的食管癌患者为男性,东亚地区发病率最高[1]。在中国,食管癌每年新发病例307 359例,其中男性食管癌的发病率位居世界前5位;近283 000例患者死亡,是仅次于肺癌、胃癌、肝癌的第4大杀手[2]。食管癌发病隐匿,早期缺乏特异性症状,大部分患者确诊时已进展至中晚期,失去了手术根治性切除的机会[3]。对于这些不能手术的患者,同步放化疗是标准治疗方案[4-6],可以显著提高患者的局部控制率和总生存率[7-9],但不良反应尤其是骨髓抑制、放射性食管炎的发生率也较高[10-11]。不良反应的发生会迫使患者降低化疗剂量、延迟化疗时间,甚至中断放化疗,从而影响患者的预后。因此,为提高放化疗的效果,改善患者的预后,探讨患者放化疗不良反应的影响因素尤为重要。
小野寺预后营养指数是日本学者Onodera等[12]在1984年建立的营养评估和风险预测指标,这个简单的评分系统包括血清白蛋白和淋巴细胞计数,最初用于预测胃肠手术后并发症的风险,随着研究的进展,发现其还可以预测晚期肿瘤患者的预后,包括肺癌、食管癌、胃癌、肾癌、结直肠癌和肝癌等[13-19]。但探讨非手术治疗的食管鳞癌患者的小野寺指数与同步放化疗不良反应的相关性研究较少。本研究通过分析80例非手术治疗的食管鳞癌患者的小野寺指数、临床病理学特征与放化疗不良反应的关系,探讨小野寺指数在食管鳞癌同步放化疗中的临床应用价值。
1 资料和方法
1.1 研究对象
本研究选取2017年1月—2019年12月于山东大学齐鲁医院放疗科接受同步放化疗的食管鳞癌患者80例,纳入标准:①胃镜病理学检查证实为食管鳞状细胞癌;② 不能手术切除,且影像学检查显示无远处转移;③患者入院前未行手术、化疗及放疗;④ 患者均接受同步放化疗,放疗期间接受1~2个周期的化疗,且未因不良反应以外的其他原因中断放化疗。
1.2 小野寺指数的计算
根据患者入院后首次血常规和生化检查结果,计算小野寺指数。小野寺指数=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L)。根据Onodera等[12]制定的标准,本研究将入组病例分为营养良好组(小野寺指数≥45)和营养不良组(小野寺指数<45)。
1.3 肿瘤的临床分期
参考第五届全国食管癌放疗研讨会上讨论(2009年,石家庄)并通过的中国非手术治疗食管癌的临床分期修改方案[20]。
1.4 不良反应分级及定义
急性不良反应中食管炎、肺炎按照肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准分为0~4级,其余按照常见不良反应事件评价标准(Common Terminology Criteria Adverse Events,CTCAE)5.0版标准分为0~5级,≥3级为重度反应。
1.5 统计学处理
所有统计分析均采用SPSS 22.0软件,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
本项研究共纳入80例患者,其中营养良好组42例,营养不良组38例。患者临床病理学特征见表1,营养良好组和营养不良组在性别、年龄、临床分期、放疗方式、放疗剂量和化疗方案等方面差异均无统计学意义(P均>0.05)。
血液不良反应中白细胞减少的发生率较高,营养不良组白细胞减少的发生率高于营养良好组(55.3%vs50.0%,P=0.638),与此相反,营养良好组血小板减少的发生率高于营养不良组(45.2%vs36.8%,P=0.446),但差异均无统计学意义。在胃肠道不良反应中,恶心呕吐、食管炎的发生率均较高,其中营养不良组食管炎的发生率明显高于营养良好组(68.4%vs45.2%,P=0.045);腹泻的发生率较低,但营养不良组的发生率明显高于营养良好组(15.8%vs2.4%,P=0.034),差异有统计学意义。营养良好组放射性肺炎的发生率高于营养不良组(40.5%vs28.9%,P=0.280),但差异无统计学意义(表2)。
本研究所列6项不良反应中,仅有白细胞减少、血小板减少、恶心呕吐、食管炎和肺炎出现了3级的重度反应。营养不良组重度食管炎的发生率高于营养良好组(34.2%vs16.7%,P=0.070),但差异无统计学意义。营养不良组重度白细胞减少的发生率与营养良好组无明显差别(21.1%vs21.4%,P=0.967)。与此相反,营养良好组重度放射性肺炎、血小板减少、恶心呕吐的发生率高于营养不良组(9.5%vs2.6%,P=0.362;7.1%vs5.3%,P=0.729;9.5%vs5.3%,P=0.678),但差异均无统计学意义(表3)。
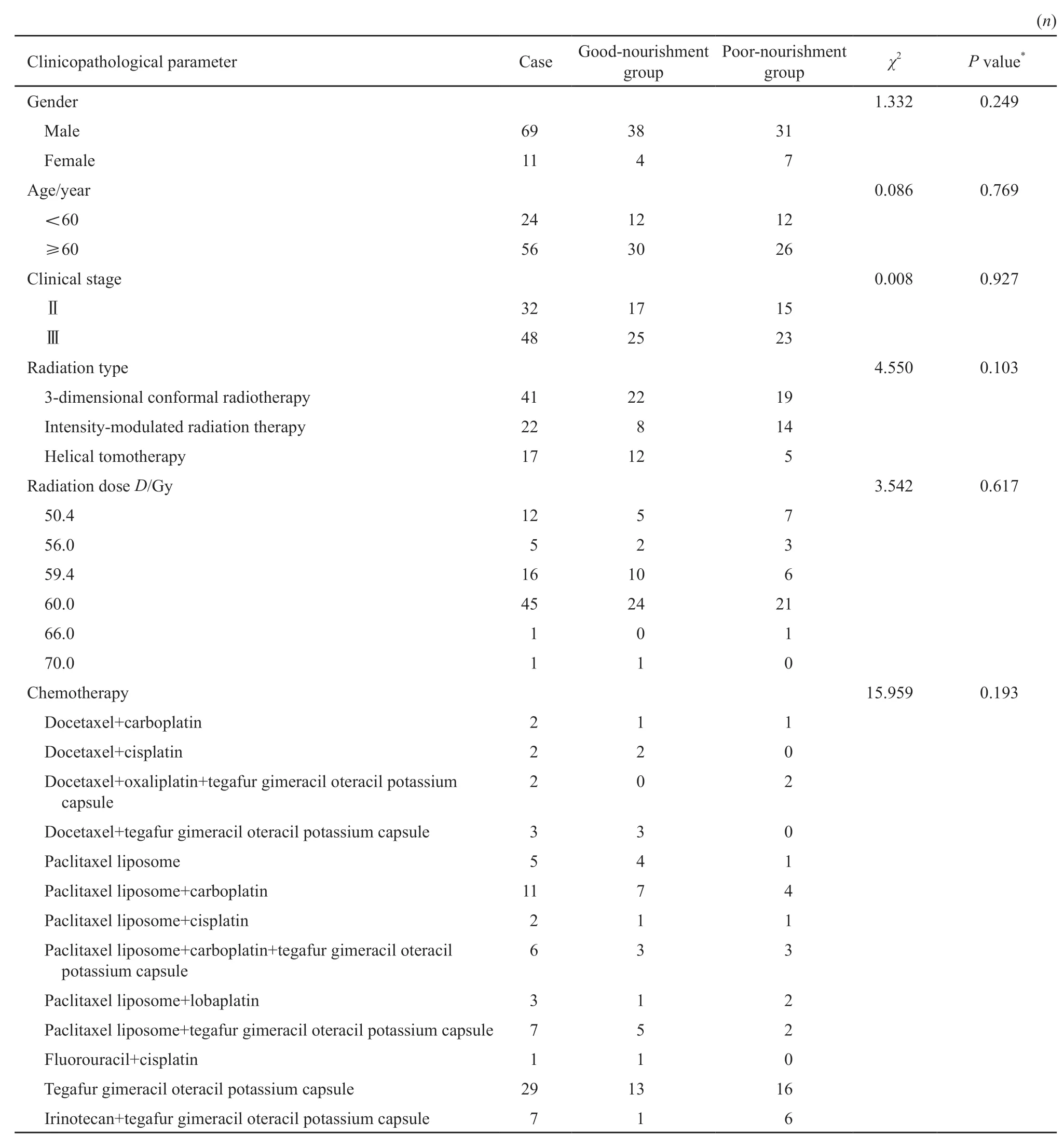
表1 营养良好组和营养不良组临床病理学参数间的相关性分析Tab.1 Association between the nourishment state and clinicopathological parameters among esophageal cancer patients with concurrent chemoradiotherapy
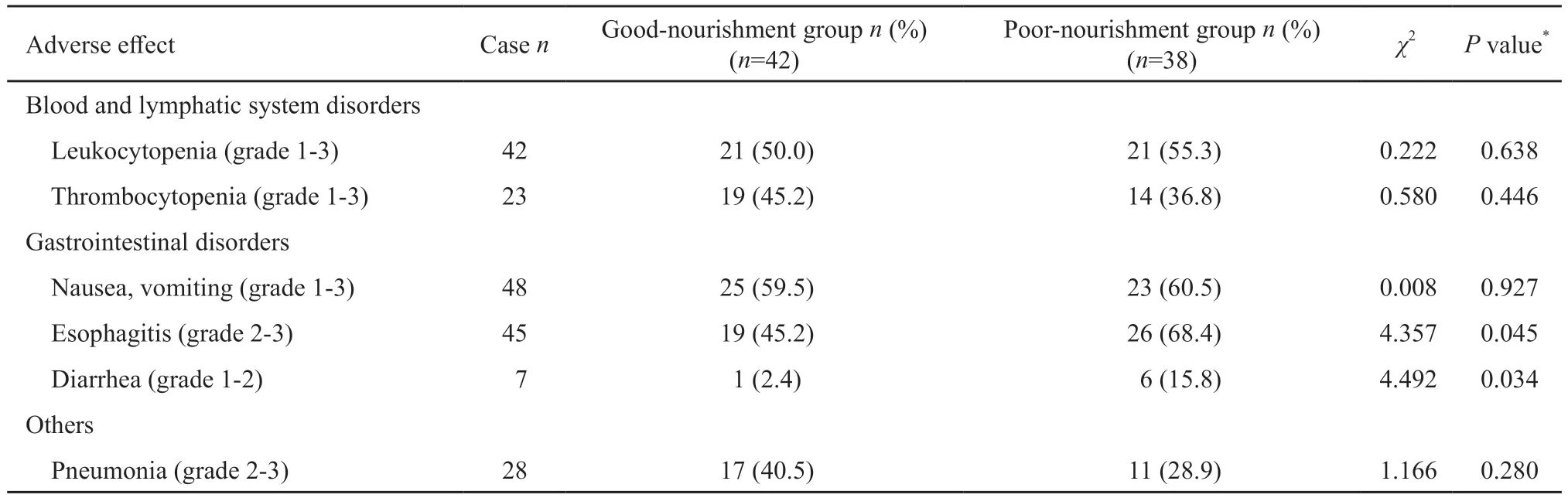
表2 营养良好组和营养不良组的不良反应比较Tab.2 Comparison of the adverse effects between good-nourishment group and poor-nourishment group among esophageal cancer patients with concurrent chemoradiotherapy
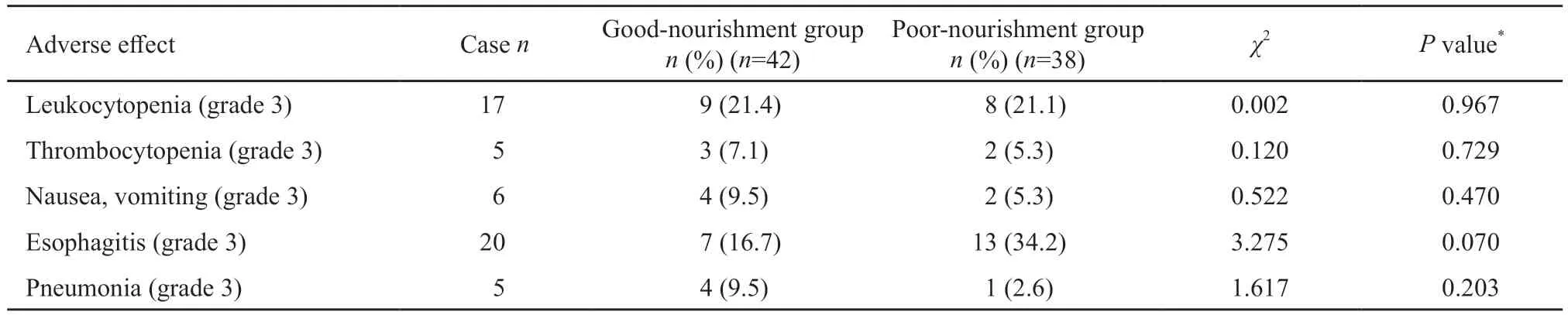
表3 营养良好组和营养不良组重度不良反应比较Tab.3 Comparison of the severe adverse effects between good-nourishment group and poor-nourishment group among esophageal cancer patients with concurrent chemoradiotherapy
3 讨 论
食管癌是一种高度侵袭性的恶性肿瘤,其发生发展与年龄、性别、职业、种族、地域、生活环境、饮食习惯和基因易感性等因素密切相关。长期饮用烈性酒,习惯性吸烟,吃太硬、过热的食物或进食太快均会引起食管慢性炎症,进而导致食管癌。食管癌主要有两种病理学类型即鳞癌和腺癌,鳞癌是中国食管癌患者最常见的病理学类型。手术是食管癌治疗的首选,但超过50%的患者在确诊时就失去了手术机会[21]。对于这些不能手术治疗的食管癌患者,可以选择放疗、化疗、同步放化疗、靶向治疗和免疫治疗[22],其中同步放化疗已成为共识,被多个国家食管癌治疗指南推荐。同步放化疗与单纯放疗、序贯放化疗相比,均显示出较好的疗效[23-24],但不良反应尤其是骨髓抑制、放射性食管炎的发生率也较高[10-11]。小野寺指数是由血清白蛋白和外周血淋巴细胞总数计算得出,血清白蛋白水平可以反映患者的营养状况,而淋巴细胞计数是反映患者免疫和炎症状态的一个指标。研究[25-26]表明,小野寺指数可以预测食管癌术后患者的生存,小野寺指数高的患者生存时间明显长于小野寺指数低的患者。此外,Matsumoto等[27]研究发现,对于未行手术治疗而进行了化疗或同步放化疗的食管癌患者,小野寺指数低的患者生存时间明显短于小野寺指数高的患者,并且小野寺指数可作为未行手术治疗的食管癌患者的独立预后因素。
肿瘤的放化疗常引起不良反应,包括血液学毒性和非血液学毒性。这些不良反应不仅会降低放化疗强度、推迟放化疗时间,甚至是中断放化疗,还会降低患者的生活质量和治疗效果[28]。因此,探索与放化疗不良反应相关的危险因素,以便进行妥善管理至关重要。研究[29]表明,在进行新辅助化疗的晚期胃癌患者中,小野寺指数低的患者更容易出现血液学毒性。对于未行手术治疗而进行了化疗或同步放化疗的食管癌患者,Matsumoto等[27]研究发现,小野寺指数低的患者血液学毒性的发生率明显高于小野寺指数高的患者,但Matsumoto等的研究中所用化疗方案为氟尿嘧啶联合顺铂,而本研究所用方案多数为单药口服替吉奥胶囊或联合紫杉醇类药物化疗。在一项比较卡铂联合紫杉醇和顺铂联合氟尿嘧啶的回顾性分析[30]中,顺铂联合氟尿嘧啶组有19%的患者出现了3~4级的血液学毒性,而卡铂联合紫杉醇组只有4%。因此,本研究并未发现血液学毒性在两组中有明显差异,可能与研究中所用化疗方案不同有关,但仍需扩大样本量进一步研究。本研究还发现,营养不良组食管炎及重度食管炎的发生率明显高于营养良好组,与杨圣思等[31]的研究结果一致,提示小野寺指数能有效地预测食管癌患者放疗所致食管炎的发生及严重程度。此外,在本研究中,虽然腹泻的发生率较低,但营养不良组腹泻的发生率明显高于营养良好组,主要发生在伊立替康及紫杉醇化疗组,考虑为化疗相关性腹泻(chemotherapyinduced diarrhea,CID)。虽然目前对于CID的病理生理学机制还不是很明确,但有组织病理学证据显示,CID是一个多因素影响的过程,化疗药物可以导致胃肠道黏膜层破坏和肠上皮脱落,杯状细胞和隐窝细胞不成比例增加和非典型增生,破坏微绒毛细胞的重吸收功能,导致肠腔液体增加,最终导致小肠内吸收和分泌功能失去平衡[32]。其损害程度不仅与正常细胞对放化疗的耐受差异有关,还与机体的自我修复能力密切相关。本研究结果提示,良好的营养储备和正常的免疫功能有助于正常组织在受到损伤后及时恢复增殖并修复继发的炎性反应,但仍需扩大样本量进一步研究。
综上所述,小野寺指数可以有效地预测食管鳞癌患者同步放化疗过程中不良反应的发生风险,通过评估治疗前的小野寺指数并及时纠正患者的不良营养状态,有助于降低同步放化疗不良反应的发生率,进而提高患者放化疗的效果,改善患者的预后。

