紫外线照射对成人原代肝细胞免疫原性及蛋白合成性的影响
邓 兰,唐世刚
邓兰,唐世刚,湖南省人民医院/湖南师范大学第一附属医院感染科湖南省长沙市 410005
0 引言
近年随着细胞生物工程技术的发展,肝衰竭的细胞治疗也取得了一定的进展,肝细胞移植(hepatocyte transplantation,HCT)也被认为是一种可替代整肝移植的可行方法[1,2].目前肝细胞主要来源于不适合原位肝移植的供体肝、异种肝细胞、肝干细胞[3,4],本研究中的肝细胞来源于外科肝切除的良性病变组织标本.
由于成熟肝细胞只表达MHC Ⅰ类分子,而无MHCⅡ类分子,因此理论上免疫原性相对较弱[5,6],但分离后的单个肝细胞MHC Ⅰ类分子依然具有识别和提呈内源性抗原肽的功能,而诱发免疫排斥反应; 肝细胞分离过程中肝细胞膜损伤,导致细胞表型改变,细胞间表面粘附分子被受体免疫系统识别而受到细胞毒性T细胞的攻击,导致移植后的肝细胞凋亡[7]; 有动物实验证实移植的肝细胞在未使用免疫抑制剂的情况下仅能存活7-10 d[8],所以如何降低移植肝细胞免疫原性,提高移植细胞的存活是值得进行探讨的方向[9].
本研究通过紫外线照射,探讨不同强度和照射时间对成人原代肝细胞免疫原性及对细胞稳定性的影响.
1 材料和方法
1.1 材料
1.1.1 主要试剂配制及仪器:(1)胶原酶IV型、胎牛血清,Sigma公司; (2)CCK-8检测试剂盒,DOGINDO公司; (3)膜电位试剂盒,碧云天公司; (4)荧光显微镜,ASONE公司; (5)紫外灯,飞利浦公司.
1.2 实验方法
1.2.1 实验对象:取本院手术切除的成人肝组织.入选标准:(1)肝脏良性病变(胆管结石、血管瘤、囊肿、外伤等),病理无明显萎缩及纤维化; (2)年龄<60岁,血白蛋白(serum albumin,ALB) >30 g/L; (3)无胆道急性感染; (4)乙肝、丙肝、艾滋、梅毒等检测为阴性.尽量在肝叶离体后30 min内分离肝细胞.
1.2.2 实验分组:根据紫外线照射强度将肝细胞分为对照组(0 J/m2),4个实验组(分别为200、350、550和750 J/m2),紫外灯功率固定,照射强度由照射时间调控,对照组和4个实验组照射强度所对应的照射时间分别为0、2、4、6和8 min.
1.2.3 肝细胞分离和纯化:无菌条件下将肝叶组织称重,4 ℃ D-Hanks液漂洗,去除结石或损伤组织,封闭胆管.改良的两步胶原酶灌注法分离肝细胞[10].
1.2.4 淋巴细胞提取:淋巴细胞分离液标准流程分离提取.
1.2.5 紫外线处理肝细胞:将肝细胞接种在96孔板[CCK-8和混合淋巴细胞肝细胞培养(mixed lymphocyte hepatocyte culture,MLHC)实验]或放有盖玻片的六孔板(细胞跨膜电位检测)中,以窄谱中波紫外线灯(波峰为311 nm,光源距离实验细胞垂直距离为10 cm),按分组要求的照射剂量进行照射后,换新鲜培养基置37 ℃5%CO2恒温箱24 h,每组3个平行孔,OD值以3孔的平均值表示.
1.2.6 紫外光照射后检测:CCK-8法检测活率:(1)在96孔板中接种肝细胞悬液(104/mL) 100 μL/孔,每孔>1000个细胞; (2)于培养的1、3、5 d,按各组紫外线处理后的肝细胞,避光加入10 μLCCK-8溶液,恒温箱孵育1.5 h; (3)酶标仪(450 nm)检测.
跨膜电位检测:按线粒体膜电位检测试剂盒(JC-1)操作步骤进行:(1)紫外线处理的六孔板培养的肝细胞,按1:1加完全培养基和JC-1工作液,5%CO2孵育30 min,冰浴1×JC-1染色缓冲液洗后取出爬满肝细胞的盖玻片翻转覆盖在滴有甘油载玻片上; 设置阳性对照; (2)荧光显微镜观察:绿色荧光提示细胞处于凋亡早期,线粒体膜电位下降,红色荧光提示细胞线粒体膜电位正常,细胞状态较好.
MLHC:(1)96孔板中每孔接种5000个肝细胞,经紫外线处理后,加入5×105个淋巴细胞,设空白肝细胞、淋巴细胞各一组,37 ℃,72 h; (2)每孔加入5 ng/mL的CCK-8 10 μL,4 h; 加100% DMSO 100 μL/孔; (3)酶标仪(450 nm)检测.
细胞分泌功能的变化:肝细胞培养液3500 g/min离心8 min,取上清自动生化仪检测ALB水平.
统计学处理所有实验数据均以mean±SD表示,采用SPSS 17.0统计软件进行数据分析,各组间差异比较采用方差分析,各时间点组间比较采用t检验,P<0.05有统计学差异.
2 结果
2.1 分离的肝细胞台盘蓝计数和培养后细胞形态变化新分离的肝细胞调细胞数为1×105/mL,台盼蓝拒染法检测活率>90%.
光镜下:细胞透亮,呈圆形或球形,边界清楚,胞质丰富,大小均匀.2 h后细胞开始贴壁,细胞由圆形向多边形伸展.同时细胞体积增大,48 h后可达到80%-90%的融合,培养第5天,肝细胞融合成岛状.小剂量紫外线照射(200 J/m2)处理的肝细胞与对照组比较形态无明显差异,贴壁率无明显下降(图1).
2.2 CCK-8法检测各组肝细胞活力变化 CCK-8检测结果(表1):200 J/m2照射后的肝细胞活率最高,与未照射组无明显区别,明显高于其他组.肝细胞处理后培养时间对肝细胞活率有影响; 与对照组比较,不同强度紫外线照射后培养第1天活率最高,到第5天200 J/m2组活率与对照组相比无显著差异,而其他组则显著下降.
2.3 紫外线处理后膜电位检测 线粒体膜电位正常时,JC-1在线粒体的基质中聚集,呈红色荧光; 反之则形成单体,呈绿色荧光.实验显示对照组和紫外线照射200 J/m2的肝细胞以红色荧光为主,随着照射强度的增大,而呈现棕色(350 J/m2)、黄绿色(550 J/m2)、绿色(750 J/m2)的变化.细胞培养第一天,细胞状态良好,膜电位检测以红色荧光为主(图2); 随着培养时间的延长,第3天细胞贴壁融合达到80%,细胞凋亡率也随着时间的延长而上升,膜电位以棕色为主(图3); 培养第5天膜电位以黄绿色为主(图4); 说明随着培养时间的延长,细胞膜电位呈下降趋势.

表1 不同强度紫外线处理后不同培养时间肝细胞活率

图1 对照组和紫外线处理组肝细胞形态及贴壁情况图(200×).A,B,C:分别为对照组培养的第1、3、5天; D,E,F:分别为接受200 J/m2紫外线照射后培养的第1、3、5天.
为进一步阐明紫外线对肝细胞的影响,以酶标仪检测红色荧光(590 nm)和绿色荧光(530 nm),计算出红色荧光的OD值比上绿色荧光的OD值的比值(表2).紫外线照射200 J/m2后的比值最高,说明肝细胞膜电位稳定,细胞活性最好,随着照射强度增大,细胞膜电位随之下降,差异显著.随着培养时间延长,细胞性有所下降,但在200 J/m2照射强度下无显著性差异.
2.4 MLHC实验 CCK-8实验得出紫外线照射后培养第1天活率最高,在进行紫外线照射后选定第1天进行MLHC.共培养3 d后检测不同照射强度下的OD值分别为0 J/m2,1.45±0.06; 200 J/m2,0.80±0.04; 350 J/m2,1.77±0.03; 550 J/m2,1.76±0.10; 750 J/m2,1.71±0.07.本实验结果表明,经紫外线照射后的肝细胞,用MLHC检测受体淋巴细胞对供体肝细胞反应,显示其并未丧失对同种MHC抗原的免疫应答能力,但发现200 J/m2照射组的肝细胞引起淋巴细胞增值能力下降,与对照组有显著区别(t=2.787,P=0.012),而350 J/m2、550 J/m2、750 J/m2组则引起淋巴细胞增殖能力有所增强.
2.5 对照组和紫外线处理组肝细胞在不同培养时间分泌合成功能的变化 检测第1、3、5天各实验组上清液白蛋白(表3),200 J/m2紫外线组白蛋白水平稍高于对照组,随着照射强度的增大,肝细胞合成分泌功能下降.
3 讨论
自上世纪90年代Alessandri等[11]与Ribbert等首次进行HCT以来,HCT技术有了较大进展,目前HCT在人体的临床报道仅有140例,部分患者胆红素水平下降,症状改善,但没有临床资料证实患者进行HCT后得到完全的临床愈合[12],主要是作为等待原位肝移植的过度治疗.有研究认为移植细胞的稳定性和移植细胞抗宿主的免疫排斥反应是导致移植疗效欠佳的主要原因[13].
表2 不同强度紫外线处理后不同培养时间肝细胞膜电位变化

表3 紫外线照射后肝细胞分泌功能测定

图2 不同强度紫外线照射后培养第1天肝细胞膜电位的变化(100×).
研究证实通过调节免疫细胞的功能可以诱导免疫耐受[14],包括B细胞、T-reg细胞、树突状细胞和巨噬细胞都可以通过细胞直接接触或通过可溶性介质而起到这一调节能力.免疫耐受分为中枢耐受和外周耐受,可以诱导效应细胞的死亡或抗原表观的改变而阻止或减少激活自身反应性淋巴细胞,这也为移植后免疫耐受的诱导提供了思路[15,16].
新分离的单个肝细胞较易受损,轻微损伤即可导致凋亡,移植供体进入受体通过门静脉后仅有30%的肝细胞存活[17].因此如何保证新分离并经紫外线照射的成熟肝细胞的质量和稳定的生物学功能是非常必要的.本研究采用改良两步胶原酶灌注法新分离的成人原代肝细胞台盼蓝拒染检测活率>90%.以含有肝细胞生长因子[18]的新配制的完全培养基连续培养后发现肝细胞的形态和贴壁良好,细胞的凋亡明显改善,且发现小剂量紫外线照射(200 J/m2)处理的肝细胞与对照组比较形态无明显差异; 同时通过检测ALB来评估细胞的合成功能,结果发现紫外线照射200 J/m2的肝细胞在培养第3天的白蛋白合成处于最佳状态,稍高于对照组,随着照射强度的增大而下降.
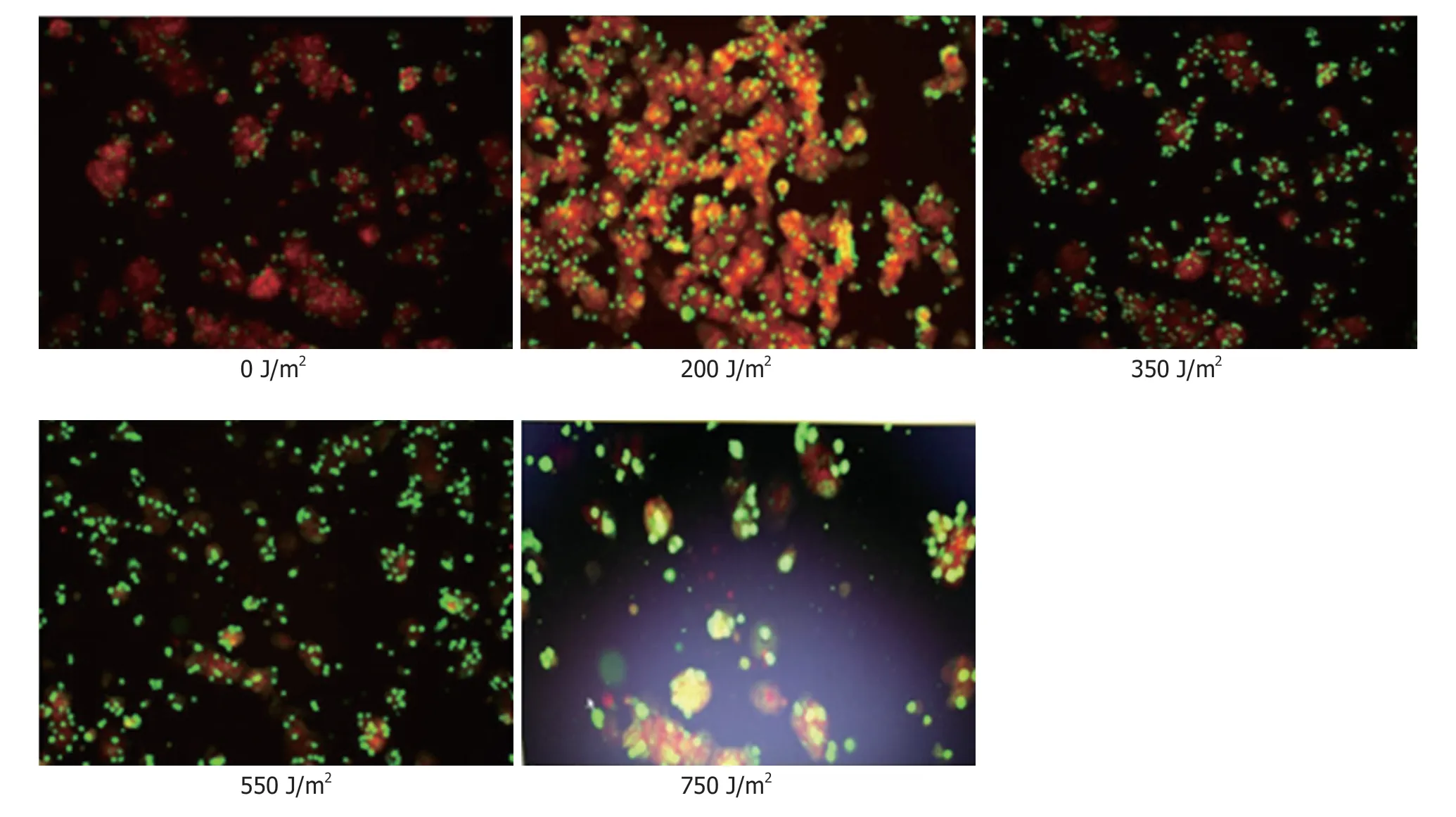
图3 不同强度紫外线照射后培养第3天肝细胞膜电位的变化(100×).

图4 不同强度紫外线照射后培养第5天肝细胞膜电位的变化(100×).
由于紫外线可以导致肝细胞DNA损伤,本研究为了确认紫外线照射对肝细胞稳定性影响的安全强度,以CCK-8法检测细胞活力,表明200 J/m2紫外线照射对细胞活力影响不大,与对照组无明显差别,但随着照射强度的增加和培养时间的延长细胞活力逐渐降低,说明紫外线的强度对肝细胞有一定的损伤,而随着时间的延长肝细胞的凋亡也可能增加.
细胞凋亡早期,细胞形态并不会发生明显的改变,然而细胞膜电位的改变与细胞物质转运功能又是息息相关的,能反应细胞的功能状态[19].因此检测细胞的膜电位变化,发现肝细胞膜电位在紫外线照射强度200 J/m2时膜电位稳定,细胞状态良好,且培养到第五天也没有明显变化,说明经过低剂量照射的肝细胞膜稳定性较好; 随着照射强度增大,膜电位的差距变大,细胞膜损伤,细胞稳定性明显下降.
有文献[20,21]采用MLHC实验评价体外培养细胞的免疫原性大小.本研究中的肝细胞是蛋白质抗原,无供体抗原提呈细胞(antigen presenting cells,APC)的存在,是受体T细胞间接识别供体肝细胞.将处理后的肝细胞与T淋巴细胞混合培养,通过T细胞的增值评价不同照射强度下肝细胞的免疫原性大小,结果显示经紫外线照射后的肝细胞,并未丧失对同种MHC抗原的免疫应答能力.但不同的照射强度对肝细胞免疫原性的影响是有差异的,发现200 J/m2照射的肝细胞引起淋巴细胞增值能力下降,说明经过小剂量紫外线处理的肝细胞免疫原性下调; 但350 J/m2、550 J/m2、750 J/m2组却有升高,可能与肝细胞膜受损伤,表达了相应的抗原成分有关.Venkateshan等体外研究发现紫外线照射肝细胞后引起T细胞活化,产生的CD4+T细胞分泌细胞因子IL-10,但不分泌IL-4和IFN-Y; 另外,单核细胞/巨噬细胞和树突状细胞作为APC,供体肝细胞植入后,被APC识别并提呈给T细胞,是免疫应答发生的基础.通过紫外线照射诱导肝细胞表观遗传改变,使APC无法识别,T细胞活化受阻,从来导致免疫耐受[22].
综上所述,200 J/m2的紫外线照射可以降低成人原代肝细胞的免疫原性,且在这个强度下,肝细胞的活力和合成功能得到较好保留,该研究结果或许在今后的HCT临床应用中减少免疫排斥有一定意义.
文章亮点
实验背景
肝细胞移植(hepatocyte transplantation,HCT)是治疗肝衰竭非常有前景的手段,虽然很多因素影响其有效性,但受体的免疫排斥反应是影响HCT疗效的主要因素,为了减少其排异反应,临床不得不应用大量的免疫抑制剂而增加其风险; 有实验证实紫外线可引起免疫抑制,不过紫外线也能导致细胞DNA损伤,那么如何寻求一种平衡,既能降低肝细胞免疫原性,又能避免紫外线对肝细胞的过度损伤,从而较好保存肝细胞的稳定性和细胞合成功能.所以寻找适合的紫外线照射强度或许可以达到这样的效果.
实验动机
本研究的主题就是通过不同的实验证实适合的紫外线强度既能引起相应的免疫抑制,又不至于引起肝细胞的稳定性的破坏而影响细胞功能.拟解决的问题是原代肝细胞的经紫外线照射对细胞活力、线粒体膜、蛋白合成功能和引起淋巴细胞增殖活性的影响.这些问题的解决对HCT的临床应用有较好的促进作用.
实验目标
通过实验确定适合的紫外线照射强度,在这一强度下可以抑制肝细胞的免疫反应,且实验肝细胞的生物学活性不受或较少受影响.实现这一目标可以提高移植细胞的存活效率,减少或避免免疫抑制剂的应用.
实验方法
本研究取外科手术切除的良性病变肝组织,经改良的胶原酶灌注法分离得到成人原代肝细胞,分为对照组(0 J/m2)和四个不同强度紫外线照射组(分别为200、350、550和750 J/m2),台盘蓝拒染和CCK-8法检测肝细胞的活力; JC-1检测线粒体膜电位的变化,通过荧光显微镜可以观察膜电位变化导致的细胞凋亡,并通过酶标仪读取OD值进一步量化膜损伤程度; 直接混合淋巴细胞肝细胞培养(mixed lymphocyte hepatocyte culture,MLHC)检测紫外线对肝细胞的引起淋巴细胞增殖的效率,全自动生化分析仪检测肝细胞的白蛋白的合成功能.从不同角度检测紫外线对肝细胞的影响.
实验结果
本研究基本达到实验目的,首先成功分离来源于成人良性病变手术切除肝组织的肝细胞,胎盘蓝拒染活率在90%以上,在200 J/m2紫外线强度照射组,CCK-8检测肝细胞的活率和形态学上与对照组无差异; JC-1法无论从荧光显微镜下观察所见还是酶标仪量化计算结果都展示了较好的线粒体膜稳定性; 生化结果也证实了在这一强度下肝细胞有较好的白蛋白合成功能; MLHC实验也表现出了肝细胞引起淋巴细胞增殖抑制现象,且有统计学意义.而增大照射强度则肝细胞则显示肝细胞的活力衰退、膜电位下降,细胞凋亡,从而细胞的蛋白合成能力减弱,并且发现肝细胞引起淋巴细胞增殖能力加强,这可能与因肝细胞受损表达了肝细胞相表观藏的抗原有关.
实验结论
发现低剂量的紫外线照射可降低肝细胞引起淋巴细胞增殖活性; 同时还能较好的保存肝细胞的活力、线粒体膜电位的稳定性,从而保证了细胞功能的正常发挥,通过本研究也证实了适当的紫外线照射可引起免疫抑制现象.这些发现或许对HCT的临床实践有一定的应用价值.
展望前景
本研究的教训是做增殖实验只用了经典的MLHC实验检验肝细胞引起淋巴细胞增殖活力下降,而应该选用更多的方法证实这一现象,比如EdU实验检测细胞增殖过程中的DNA来进一步说明其增殖效应.未来的研究方向是探索更好的肝细胞培养技术减少和组长肝细胞凋亡,并一步研究紫外线对肝细胞表观生物学性状的影响,说明其导致免疫抑制的机制.

