转玉米PEPC和PPDK基因杨树苗期的光合生理特性
孙伟博 宫新栋 周 燕 李红岩
(南京林业大学生物与环境学院 南京 210037)
杨树(Populus)是世界上中纬度平原地区主要的人工种植速生树种之一,也是我国重要的经济林木,具有生长快、产量高、成林早、易加工等众多优势,是人工速生丰产林的主要树种(赵桂华, 2011)。杨树作为木本植物与草本植物相比较,生长周期长,并且属于光合效率较低的C3植物,其光能利用率低(Yuanetal., 2017),与理想的光能利用率差距较大,因此,提高光合作用的效率对于木本植物尤其是杨树等速生树种的生长具有促进作用。在自然界中,玉米(Zeamays)、高粱(Sorghumbicolor)等作物属于C4植物,具有较高的光合效率,能够有效浓缩CO2,这些植物的CO2补偿点低、光合补偿点高,使得它们在适宜环境中和逆境条件下均能有更高的光合效率。因此,将C4植物光合作用的关键基因引入C3植物进行表达,是解决相关问题的热点研究领域(Ishimaruetal., 1998; Huoetal., 2017; Sivarametal., 2018)。
对C4植物光合能力具有重要作用的磷酸烯醇式丙酮酸羧化酶(phosphoenol pyruvate carboxylase,PEPC),其酶活性强,是1,5-二磷酸核酮糖羧化酶活性的60倍,对CO2亲和力大(Singhetal., 2012); 另外一个关键的限速酶即磷酸丙酮酸二激酶(phosphopyruvate dikinase,PPDK),该酶主要分布于叶肉细胞的叶绿体中,催化CO2最初受体PEP的再生(Wangetal., 2012)。二者是C4植物具有高效光合作用的关键。在拟南芥(Arabidopsisthaliana)、小麦(Triticumaestivum)等C3植物中也成功获得了转C4型PEPC基因的植株,并相应提高了其光合效率(Lebouteilleretal., 2007; Chenetal., 2004); 将玉米PPDK基因转化到水稻(Oryzasativa)中,叶片总N含量明显升高(严建民等, 2003); 使用共转法获得的转PEPC和PPDK基因水稻株系,其孕穗期叶绿素荧光参数及相关生理生化指标等均有显著提高(崔红云等, 2012)。本研究选取C4植物玉米中的PEPC和PPDK基因,并通过基因工程手段将这2种基因转化南林895杨(P.deltoides×P.euramericana‘Nanlin 895’),获得稳定高效表达的转基因植株,并对转基因植株进行分子检测、生理生化检测以及相关功能分析,为培育杨树高光效新品种提供依据。
1 材料与方法
1.1 试验材料
选取玉米植株(B73品系)的叶片用于基因克隆,南林895杨植株作为转化的目的材料并进行分子及生理检测。
1.2 玉米PEPC及PPDK基因信息挖掘及分析
选择ZeamaysEnsembl-18和ZeamaysPH207 V1.1数据库(https:∥phytozome.jgi.doe.gov/pz/portal.html#)进行PEPC和PPDK基因的相关信息挖掘,分别以phosphoenolpyruvate carboxylase和pyruvate phosphate dikinase为关键词进行搜索,对搜索结果依据功能注释、保守功能域结构及家族标签进行筛选。
1.3 玉米PEPC和PPDK表达分析
利用real-time qPCR技术对PEPC和PPDK基因在玉米中时空表达差异进行分析。PEPC基因real-time qPCR引物为: 正向: 5′-TCACACATGCT GATCCTGGC-3′,反向: 5′-GTCAGGACGAGGTCAAC AGT-3′;PPDK基因real-time qPCR引物为: 正向: 5′-GCTCAAAATGCACCAGGGAC-3′,反向: 5′-TTGT TGCCCTCGCTCTTGCC-3′。
1.4 目的基因的克隆及载体构建
使用多糖多酚RNA提取试剂盒(北京天根生化)进行RNA提取; cDNA的合成使用反转录试剂盒(Takara); 目的基因克隆及扩增所使用菌株为大肠杆菌(Escherichiacoli)Trans1-T1菌株(Transgen)和大肠杆菌TOP10菌株(北京天根生化); 扩增所使用载体为pTOPO-T(Transgen)。根据目的基因保守区设计3′及5′端引物(PEPC引物序列: 正向: 5′-CCTCTCGCTCCGTCC-3′,反向: 5′-CCATAGATAT GATCCCCTACAGA-3′;PPDK引物序列: 正向: 5′-ATGGCGGCATCGGTTTCC-3′,反向: 5′-CAAGCACC TGAGCTGCAG-3′),进行PCR扩增并回收目的片段,经擎科公司测序正确后,利用Gateway系统将目的基因分别构建到植物表达载体pGWB406中(图1),目的基因通过重组反应连接到attR1和attR2之间,启动子为花椰菜花叶病毒35S启动子。
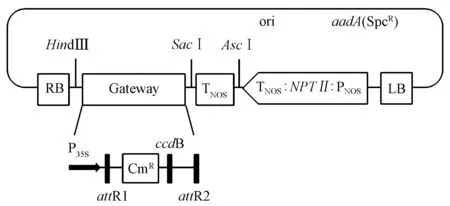
图1 pGWB406载体图谱Fig.1 Vector map of pGWB406P35S: 花椰菜花叶病毒35S启动子; attR1和attR2: 重组反应识别位点; CmR: 氯霉素抗性基因; ccdB: Gateway载体自杀序列; ori: 复制起始位点; aadA(SpcR): 壮观霉素抗性基因; PNOS: 胭脂碱合酶NOS启动子; NPTII: 卡那霉素抗性基因; TNOS: 胭脂碱合酶NOS终止子; LB: T-DNA左边界; RB: T-DNA右边界。P35S: CaMV 35S promoter; attR1 and attR2: Recognition sites of recombination reaction; CmR: Chloramphenicol resistant gene; ccdB: Suicide sequence at Gateway vector; ori: Origin of repulication; aadA(SpcR): Spectinomycin resistant gene; PNOS: Nopaline synthase NOS promoter; NPTII: Kanamycin resistant gene; TNOS: Nopaline synthase NOS terminator; LB: T-DNA left border; RB: T-DNA right border.
1.5 杨树遗传转化及分子检测
将含有目的基因的表达载体分别转入农杆菌(Agrobacterium)EHA105,采用南林895杨叶盘进行侵染,预培养1天,侵染菌液OD值为0.8。侵染结束用无菌滤纸吸干多余菌液,将叶盘置于分化培养基(MS + 6-BA 0.5 mg·L-1+ TDZ 0.002 mg·L-1+ 蔗糖 30 g·L-1+ 琼脂 6.5 g·L-1+ 头孢霉素 100 mg·L-1),暗培养3天,将叶盘置于分化筛选培养基(分化培养基 + 卡那霉素25 mg·L-1+ 特美汀 100 mg·L-1),长芽后转入芽生长筛选培养基(MS + 6-BA 0.2 mg·L-1+ TDZ 0.001 mg·L-1+ 蔗糖 25 g·L-1+ 琼脂 6.5 g·L-1+ 卡那霉素20 g·L-1+ 头孢霉素 100 mg·L-1+ 特美汀 100 mg·L-1),最后转移至生根培养基(1/2 MS + 蔗糖 20 g·L-1+ 琼脂 6.5 g·L-1+ 卡那霉素 10 mg·L-1+ 头孢霉素 100 mg·L-1+ 特美汀 100 mg·L-1),于温室培养,每隔20天更换培养基至获得完整抗性植株。
筛选抗性植株,进行PCR检测,PEPC基因的引物为PEPC35S-F: 5′-GCAAGACCCTTCCTCTATAT-3′,PEPC-C-R: 5′-CTTAAGAGCAGTGTCAACCC-3′,检测片段长度851 bp;PPDK基因的引物为PPDK35S-F: 5′-GCAAGACCCTTCCTCTATAT-3′,PPDK-C-R: 5′-GTAGACCTCCTTGTACTGAC-3′,检测片段长度为832 bp。
1.6 转基因杨树植株的表达分析
选用actin为内参基因,分别以组培瓶中生长3个月的组培苗和移栽温室中2个月约60 cm高的盆栽苗为试验材料,对PEPC和PPDK基因在南林895杨中表达量进行分析,具体试验参照1.3 所述方法。蛋白表达分析选取组培瓶中生长3个月的南林895杨转基因植株和对照组植株的叶片,分别提取总蛋白并利用Bradford方法测定蛋白浓度,根据蛋白浓度对待检测蛋白样品进行定量,通过SDS-PAGE进行蛋白电泳,检测分析转基因植株与对照组蛋白表达差异。
1.7 转基因杨树光合作用相关参数及叶绿素指标测定
使用GFS-3000便携式光合仪测定已在温室中生长2个月的南林895杨盆栽苗的光合参数,选择6、7月份晴朗无云的天气条件下7:00—19:00之间的整点时刻进行测定。测定植株选择相同时间移栽、长势相同且健壮的幼苗,每个株系取5株,测定从植株顶端数第3—5片长势相同的叶片,每个植株测定3片,每个处理重复3次。测定数据包括光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)及对CO2响应、对光照响应及光合效率(LUE)等。光合效率的计算: 净光合速率与光合有效辐射的比值。
CO2响应的测定条件: 光合有效辐射1 200 μmol·m-2s-1,叶室温度30 ℃,相对湿度60%; 相关参数通过回归分析获得。CO2浓度在0~1 000 μmol·mol-1范围内,每隔100 μmol·mol-1,设定若干梯度,测定对应的光合速率值。
光响应的测定条件: 叶室CO2浓度350 μmol·mol-1,叶室温度30 ℃,相对湿度60%; 相关参数通过回归分析获得。光合有效辐射在0~1 400 μmol·m-2s-1范围内,每隔100 μmol·m-2s-1,设定若干梯度,测定对应的光合速率值。
1.8 转基因杨树生长指标测定
对南林895杨转基因株系和对照组的生长状况进行测定记录,在转入花盆中生长60天后对株高、地径进行测量记录,分别选取不同植株相同位置的叶片进行面积和质量测定,每个植株选取生长状态一致的8片叶片。生长量测定,每个株系选定3个样本,40天后从花盆中取出清洗干净,75 ℃干燥至恒重后进行测量。
1.9 数据处理
使用Excel 2007进行数据整理,利用SPSS 16.0对试验数据进行误差计算及差异显著性分析。
2 结果与分析
2.1 玉米PEPC及PPDK基因序列
利用生物信息学工具对玉米PEPC和PPDK基因编码蛋白进行分析和预测,蛋白理化性质及亚细胞定位如表1所示,PEPC蛋白定位于细胞质中,PPDK蛋白定位于叶绿体中,与其家族蛋白亚细胞定位一致,2个蛋白与各自家族蛋白成员相同均不含有信号肽和跨膜结构,并各自具有本家族蛋白保守的结构基序和活性位点。PEPC基因编码蛋白序列中,具有形成与PEPC蛋白家族功能密切相关的典型裂缝结构的4个保守基序(FHK-x-W,SWYKWP,TAHPT-x-R,M-x-GYSDS-x-K-x-G,其中x为非保守位点),并具有保守的活性催化位点K和H;PPDK基因编码蛋白序列中,具有与PPDK蛋白家族催化作用密切相关的3个保守基序(K-x-P-x-DL-x-N-x-YK,G-x-NDL-x-Q-x-R,G-G-x-H-x-R)及保守的活性催化位点K和H。通过对蛋白结构进行的生理生化、结构域基序、信号肽、功能位点等相关分析和预测,表明玉米PEPC和PPDK基因编码蛋白均具有其相关家族高度保守的功能域,2个基因均为光合作用关键酶的编码基因。

表1 PEPC和PPDK蛋白理化性质及亚细胞定位Tab.1 Physicochemical properties and subcellular localization of PEPC and PPDK proteins
2.2 玉米PEPC和PPDK基因的表达模式
对PEPC和PPDK基因在玉米中的表达进行分析(图2),发现2个基因在植株发育的不同阶段及不同组织中表达量均存在差异。在拔节期、穗期和花粒期3个发育阶段,PEPC和PPDK2个基因在叶片中表达量明显高于茎中表达量。随着发育生长,2个基因在叶片中表达量呈上升趋势,即花粒期>穗期>拔节期。在茎中这种趋势并不明显,PEPC基因花粒期在茎中的表达量低于穗期,PPDK基因在花粒期和穗期的表达量无明显差异。在不同生长阶段中,PEPC基因的表达量均高于PPDK基因。PEPC和PPDK基因在叶片中表达占优势,与其参与光合作用的生理过程相一致。
2.3 转基因杨树分子检测及基因表达
2.3.1 杨树遗传转化及分子检测 侵染的叶盘在共培养3天后转移到分化筛选培养基,待抗性芽生长健壮后转入芽伸长培养基,最后将幼苗置于生根培养基进行培养获得完整的转化植株。幼苗培养3个月后可转移到土壤中生长。具体过程如图3a-f所示。

图3 转基因南林895杨的获得及分子检测Fig.3 Obtainment and molecular detection of transgenic ‘Nanlin 895’ poplarsa-f: 转基因植株获得; g: PCR检测; h, i: 叶片内蛋白含量分析。CK: 对照组; M: Marker; PEPC1-5: 转PEPC基因5个株系; PPDK1-3: 转PPDK基因3个株系。a-f: Process of transformation; g: PCR detection; h, i: Analysis of protein content of leaves. CK: Control lines; M: Marker; PEPC1-5: 5 PEPC transgenic lines; PPDK1-3: 3 PPDK transgenic lines.

图2 PEPC和PPDK基因在不同发育阶段玉米茎、叶中的表达量Fig.2 Relative expression of PEPC and PPDK gene in stems and leaves of Zea mays at different developmental stages
对筛选获得的阳性植株进行PCR检测,结果表明PEPC获得5个转基因株系,PPDK获得3个转基因株系(图3g)。对转基因植株蛋白表达进行分析,结果表明在转PEPC基因植株和PPDK基因植株中,均有目的蛋白条带(PEPC基因编码蛋白约110 kDa,PPDK基因编码蛋白约103 kDa)存在,对照组中没有表达(图3h、i),表明基因已转化到南林895杨中并正常表达。同时,电泳结果表明各转基因株系间叶片中蛋白含量无显著差异。
2.3.2 转基因杨树的基因表达 对转基因植株进行real-time qPCR检测,比较转基因株系间的基因表达水平,对基因表达组织特异性进行分析,并对不同时期转基因植株的相关基因表达量进行比对。
在转基因植株组培苗中,PEPC和PPDK基因在叶片中表达量显著高于茎中。PEPC在不同株系间表达量差异明显,PEPC-3株系表达量最低,PEPC-5株系表达量最高,是PEPC-3株系表达量的1.79倍;PPDK基因在3个转基因株系中表达量无显著差异(图4a)。未转基因南林895杨中无目的基因,故没有其表达量分析结果。
对转基因植株盆栽苗表达分析结果表明,PEPC基因表达量比PPDK基因表达量高,同时叶片中的基因表达量高于茎中(图4b),这与组培苗时期(图4a)相同,但差距更为明显。以组培苗叶片基因表达量最低值(即PPDK-2)作为基数,分别计算组培苗和盆栽苗植株叶片中基因表达量的平均值与此基数的比值(图4c),比对结果表明,盆栽苗叶片中2个基因的表达量显著高于组培苗时期,与生长时间呈正相关关系,这可能与植物叶片生长、光合作用提高有直接关系。
另一方面,对转基因的盆栽苗进行了不同光照处理(图5),结果表明2个基因表达量均在高光照条件下升高,高光照下基因表达量是低光照条件下的2~3倍,基因表达受光照条件调控作用明显。

图4 PEPC和PPDK基因在转基因南林895杨茎叶中的表达Fig.4 Relative expression of PEPC, PPDK genes in stem and leaf of transgenic ‘Nanlin895’ poplarsa: 组培苗; b: 盆栽苗; c: 组培苗与盆栽苗叶片中表达量比对,以组培苗叶片基因表达量最低值(即PPDK-2)作为基数。a: Tissue culture plantlets; b: Potted young plants; c: Comparison of expression in leaves between tissue culture plantlets and potted young plants, taking the lowest gene expression value(PPDK-2) in leaves of tissue culture plantlets as the base value.

图5 转基因南林895杨在不同光照条件下PEPC和PPDK基因的相对表达量Fig.5 Relative expression of PEPC and PPDK gene in transgenic ‘Nanlin895’ poplars under different light conditions
2.4 转基因杨树的光合作用水平
2.4.1 光合速率日变化 南林895杨转基因株系及对照植株的净光合速率(图6)在一天当中均呈现先升高后降低的趋势。PEPC-1、PEPC-2株系呈现单峰状态,对照组和PEPC-3、PEPC-4和PEPC-5株系均呈现双峰变化趋势,其中PEPC-5株系双峰状态最为明显且最大值高于对照组16.2%。转PPDK基因株系均未出现双峰状态,且净光合速率的最大值低于转PEPC基因植株。与对照组相比,转基因株系在早晨及傍晚低光照条件下净光合速率出现低于对照组的情况。

图6 南林895杨转基因株系和对照组的净光合速率(Pn)日变化Fig.6 Diurnal change of net photosynthetic rate(Pn) in transgenic ‘Nanlin895’ poplars and control不同小写字母表示不同株系间数据差异显著(P<0.05),下同。Different lowercase letters represent significant difference among lines(P<0.05), the same below.
2.4.2 气孔导度日变化 所有植株的气孔导度在一天当中的变化趋势相同,均呈现先上升后下降的趋势。转PEPC基因植株在中午高光照条件下,气孔导度均显著高于对照组(P<0.05); 在早晨和傍晚,大部分转基因株系的气孔导度低于对照组(图7)。5个PEPC株系的气孔导度日变化也存在差异性:PEPC-1和PEPC-2株系的气孔导度在10:00后一直呈现逐步上升的趋势,在15:00出现大幅下降(PEPC-1下降27.6%,PEPC-2下降31.3%);PEPC-3和PEPC-4株系及对照组植株的气孔导度在10:00—14:00之间出现波动趋势,具有双峰值,其中对照组植株的谷值出现在13:00而转基因株系PEPC-3和PEPC-4的谷值出现在12:00且均高于对照组谷值;PEPC-5株系的气孔导度在13:00之前一直维持较低水平,在14:00出现峰值后一直到16:00均维持较高水平。转PPDK基因植株的气孔导度在10:00之前与对照组无显著差异(P<0.05),在13:00—16:00之间高于对照组,各株系间差异不显著。另一方面,与气孔导度相关的蒸腾速率的测定结果表明,转基因植株与对照组之间无显著差异。

图7 转基因南林895杨和对照组的气孔导度(Gs)日变化Fig.7 Diurnal change of stomatal conductance(Gs) in transgenic ‘Nanlin895’ poplars and control
2.4.3 胞间CO2浓度日变化及光合速率对CO2浓度的响应 南林895杨转基因株系与对照组的胞间CO2浓度均在7:00出现峰值,在中午时间段出现下降趋势。除PPDK-2株系外,转基因株系都检测到比对照组更高的胞间CO2浓度,表明转基因株系比对照组有强的CO2固定能力。在CO2浓度为0~700 μmol·mol-1的区间中,转基因株系及对照组的光合响应强度均呈线性增长,之后随CO2浓度的升高,逐渐达到饱和状态(图8)。除PEPC-4株系外,转PEPC和转PPDK基因株系的光合响应在任何CO2浓度下均高于对照组,表明转基因植株光合能力较对照组增强。

图8 转基因南林895杨和对照组对CO2浓度的光合响应变化Fig.8 Changes of photosynthetic response to CO2 concentration of transgenic ‘Nanlin895’ poplars and control
2.5 转基因杨树的生长性状及生物量
尽管光合作用参数表明转PEPC和PPDK基因的南林895杨植株具有更高效的光合作用,但是植物生长并不是单一的生理过程。因此,评价转基因株系的优劣需要进行生物学性状的比较。对同一批次的转基因植株及对照组植株进行株高、地径、叶片质量及叶片面积的测量,结果表明转基因植株在多个指标上优于对照组(图9),但是具有显著差异的仅有PEPC-3和PEPC-4株系,这2个株系在株高与叶片质量指标上显著优于对照组(P<0.05)。其中,PEPC-3和PEPC-4株系平均株高分别高于对照组5.6%和2.9%,叶片面积分别高于对照组13.8% 和8.9%,叶片质量分别高于对照组23.6%和19.8%,地径分别高于对照组13.5% 和5.4%,证明在PEPC-3和PEPC-4株系中,PEPC基因的表达对植株的生长性状产生了显著影响。

图9 转基因南林895杨和对照组的生长性状Fig.9 The growth of transgenic ‘Nanlin895’ poplars and control*表示转基因植株与对照组数据差异显著(P<0.05),下同。* represents significant difference between transgenic poplars and control(P<0.05), the same below.
进一步对转基因植株和对照组植株的生物量进行测定比较,结果如图10所示。所有植株的根生物量没有明显差异; 转基因株系的茎生物量均高于对照组,生长优势最为显著的为PEPC-3,其茎生物量为对照组的1.2倍,与之前株高测量的结果基本一致; 叶生物量优势明显的依次是PEPC-3、PEPC-5和PEPC-4株系,分别高于对照组34.8%、15.4%和6.3%。生物量测定结果进一步验证了转基因植株光合作用的增强,但转基因株系间差异显著,优势最为明显的为PEPC-3株系,且生物量的增长主要在茎和叶。
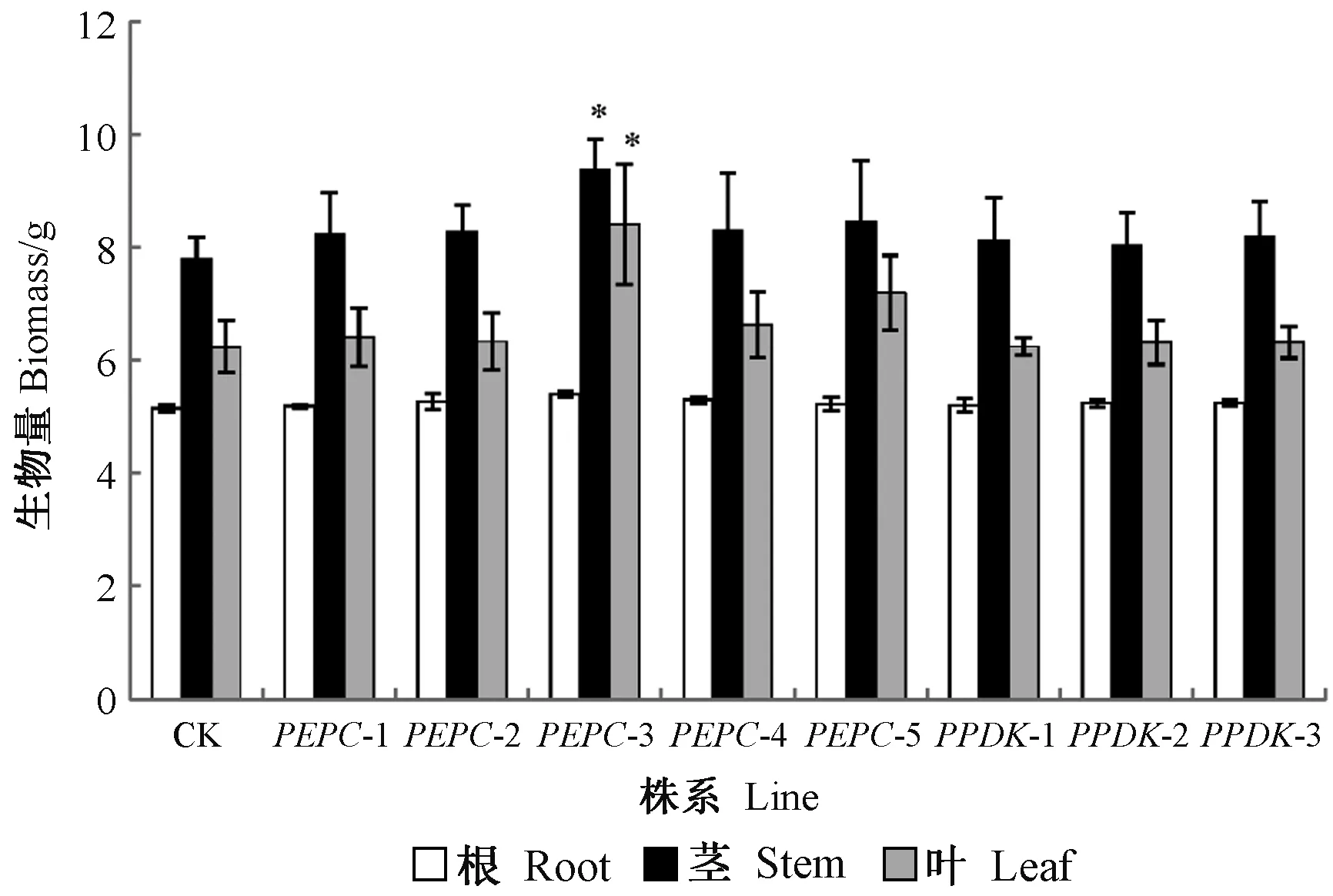
图10 转基因南林895杨和对照组的生物量Fig.10 Biomass of transgenic ‘Nanlin895’ poplars and control
3 讨论
PEPC和PPDK是C4植物光合作用中的关键酶,直接关系到CO2固定和浓缩,在光合作用初级代谢阶段发挥重要作用,C4植物具有的高效的光合作用主要是因为PEPC及PPDK等关键的光合酶系统,使其在光能和CO2利用率以及抗光抑制性上更具优势(Tangetal., 2017)。将C4植物PEPC和PPDK基因转入到C3植物进行表达被认为是提高C3植物光合作用的重要手段,目前在水稻中已广泛应用,并有效地提高了水稻的光合能力及耐旱能力(Sethietal., 2016)。将玉米PEPC基因构建到籼稻当中,PEPC酶能够显著提高转基因植株叶片细胞对于CO2的固定能力,并能够增强高温条件下转基因籼稻的光合能力(Bandyopadhyayetal., 2007); 水稻中过量表达玉米PEPC基因能够降低高氧浓度对光合作用的氧抑制,该生理过程并非通过与CO2的高效结合完成,而是通过调控与O2结合水平实现,在此过程中,PEPC基因的表达影响了转基因水稻植株内2种参与糖类代谢的关键酶SPS和FBPase的合成(Agarieetal., 2002); 在转PEPC+PPDK双基因的水稻中,转化基因能够提高植株对CO2的固定和浓缩能力,加速光合循环,同时降低活性氧对质膜的损伤,从而提高植株对水分的利用率及光合效率(姜蓓蓓等, 2018)。
综上所述,外源PEPC和PPDK基因表达主要通过影响细胞对CO2结合及浓缩能力和相关下游基因的表达调控来提高转基因植物的光合作用。本研究从玉米中克隆获得的PEPC和PPDK基因与各自基因家族成员具有高度保守性,在PEPC基因编码蛋白序列中,具有4个保守基序,能够形成与羧化酶功能密切相关的典型裂缝结构,PPDK基因编码蛋白序列中具有3个参与催化功能的保守基序,且在2个蛋白中均存在保守的活性催化位点K和H。保守基序及保守功能位点的存在能够推测玉米PEPC和PPDK基因在杨树光合作用调控中发挥作用。另一方面,PEPC和PPDK序列分析结果表明,尽管研究中采用35S启动子进行转基因表达,但在光照条件下,转化基因表达量出现升高现象,推测与PEPC和PPDK基因中可能存在的调控元件有密切关系。克隆获得玉米PEPC及PPDK基因序列中具有多种调控元件的编码序列,如调控因子MYBCORE和WRKY710S等,光诱导型G-box、GATA-box等,以及热敏型AT-rich及CATT-motif等,这些序列可能在不同条件诱导下发挥作用,影响启动子活性,从而影响转化基因的转录水平和表达特性(Chuetal., 2002),对转基因杨树光合作用调控发挥作用。同时,2个基因表达水平的差异可能与基因插入的拷贝数等因素有关。
通过对转基因杨树光合生理相关指标测定结果分析,可以发现转基因杨树胞间CO2浓度在10:00—18:00期间明显高于对照植株,在CO2浓度为0~700 μmol·mol-1的区间中,转基因杨树的光合响应强度均呈线性增长,且高于对照组,同时CO2饱和点均低于对照组,表明与转基因水稻相同,转化的C4植物光合酶提高了杨树对CO2的利用能力。C4途径不仅能够提供一个更高效的CO2浓缩机制,并能够提高植物对水分和光照的利用效率,从而保障C4植物在干旱或强光环境下具有更高的光合效率(Liuetal., 2017)。转C4光合基因的作物也表现出相应的优势。转PEPC基因的水稻在PEG胁迫条件下较对照组有更好的耐旱能力(Qianetal., 2015); 在干旱条件下转PEPC水稻气孔关闭减少植物体内水分流失,使转基因植株表现出较强的耐旱性,并在施加外源糖类物质的条件下恢复气孔导度,维持较高的光合水平(张金飞等, 2018); 在水稻中过量表达PEPC基因能够同时提高转基因植株的耐旱能力和对高光强的耐受能力(Dingetal., 2012)。与转基因水稻相同,本研究中的转基因南林895杨光合效率显著高于对照组,主要是由于对强光的利用率明显增强,转基因株系在中午时段净光合速率高于对照组,以及第1峰推迟及单峰状态都表明转基因植株具有对高光照更强的耐受性。这与转其他光合基因杨树提高光合能力的途径并不完全一致,例如转PtRCA基因的杨树通过提高耐光氧化性达到提高自身光合能力的目的(尹吴等, 2017)。另外与水稻等植物转PEPC和PPDK基因的相关研究结果不同,本研究中转基因杨树的蒸腾速率较对照组并没有表现出明显的优势,表明杨树蒸腾速率在CO2浓度、空气湿度、光照等多条件的影响下,并未因PEPC和PPDK基因的插入而出现显著的变化。
玉米PEPC和PPDK基因的导入提高了转基因南林895杨对CO2的固定能力和对于高光强的利用能力,与目前转PEPC和PPDK基因植物的相关研究结果一致,并且最终体现为植物生长量优势;但转基因南林895杨生物量增长与基因表达水平并不完全呈正相关,且在蛋白水平上,转基因植株与对照组之间差异不显著,可能与PEPC和PPDK基因下游产物的合成、翻译水平的调控及翻译后修饰有关(Ciereszkoetal., 2001; Zhangetal., 2018),表明光合作用是一个多基因调控的生理过程,单个关键基因的转化不能稳定地形成生长优势,转基因植株需要进一步筛选优化。
4 结论
玉米PEPC和PPDK基因的转入能够提高转基因南林895杨的光合能力,用于转化的玉米PEPC和PPDK基因具有其家族成员的典型保守基序和功能位点,使转基因植株能够增强对CO2的固定能力和对强光的利用能力,在光合生理参数上表现为影响转基因植株的净光合速率、气孔导度、CO2饱和点等。另一方面,通过对植株生长性状及生物量的测定,表明转基因植株的生长在一定程度上优于对照组,且转PEPC基因株系明显优于转PPDK株系,转基因植株光合能力的提高最终转化为植物生长优势。

