基于“异类相制”的马钱子复方配伍减毒的代谢组学研究
张娜,赵良友,刘永武,王宇,安柏松,刘树民*
(1.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040;2.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040)
马钱子,为马钱科植物马钱(Strychnosnux-vomicaL.)的干燥成熟种子,味苦,性寒,有大毒,具有通络止痛,散结消肿的功效,治疗风湿顽痹、麻木瘫痪、疽痈肿痛疗效非常显著[1]。张锡纯谓马钱子“能润动神经,使之灵活”,表明马钱子对神经肌肉疾病有独特的药效作用,尽管马钱子临床疗效确切,但近年来对马钱子毒性的病例报道也屡见不鲜,尤其是马钱子碱致肾衰竭的临床报道居多,影响马钱子及其复方的临床安全使用及国际准入。“异类相制”理论是指有毒中药与不同性味、不同功效药物的合理配伍,以调其偏性、制其毒性、起到全面兼顾病情、增强药效、减轻或消除毒性的作用[2]。近年来代谢组学技术成为研究中药毒性成分很好的工具,它能够通过定量表征生物体内源性小分子的动态变化从整体角度评价生物体产生的毒性变化,预测毒性产生,寻找毒性相关的生物标志物,从整体角度阐明中药毒性机制作用以及复方配伍减毒可能干预的代谢通路[3-4]。
基于中医理论健脾通络理论和的临床经验“治痿独取阳明”的思想[5-8],以大剂量黄芪与马钱子、地龙配伍组成健脾通络复方,三者配比(24:2:1),三药配伍治“痿证”,具有行补而不滞邪,通而不伤正之功。采用血液生化检测马钱子与其复方血液中有关肾脏损伤的金指标肌酐(CREA)和尿素氮(UREA)[9],通过HE染色观察肾组织病变程度,代谢组学技术获取血清差异代谢产物,寻找内源性肾毒性生物标志物,探讨“异类相制”理论指导下对含有马钱子中药复方配伍减毒的物质基础,阐明配伍减毒的效应机制。
课题组前期考察了马钱子不同炮制方法的量效关系和毒性关系,确定了油炸马钱子LD50值为192.05 mg/kg[10],药典中马钱子成人每日最大用量为0.6 g,是临床指导的22倍,而士的宁是马钱子中最主要的毒性成分,测定制马钱子中士的宁含量为1.6%,加入适量淀粉,配研,制成含有士的宁含量为0.8%的马钱子调和粉,以下实验均采用马钱子调和粉。
1 材料
1.1 实验动物
SPF级雄性SD大鼠,体质量(200±20)g,购于黑龙江中医药大学实验动物中心,许可证号:SCXK(黑)2018-007。饲养地点:黑龙江中医药大学实验动物中心屏障系统实验室。饲养条件:12 h光照、12 h避光循环饲养,室内温度为(22±1)℃,相对湿度为40%~50%,饲喂标准饲料、饮用水。
1.2 药物与试剂
中药饮片制马钱子、地龙、黄芪(均购于黑龙江雪灵峰中药饮片有限公司,批号:D8030101、180301、181201);马钱子碱、士的宁混合对照品(中国食品药品检定研究院,批号:112030-201601);色谱级乙腈(美国Thermo Fisher科技公司);色谱级甲酸(美国Dikma科技公司);亮氨酸脑啡肽(美国Sigma-Aldrich公司);微晶尿酸钠结晶(monosodium urate crystal,MSU,美国Sigma-Aldrich公司);蒸馏水(屈臣氏)。
马钱子粉制备:称取制马钱子粉6.4 g,加0.3%CMC水溶液至500 mL,制成马钱子生药的质量浓度为12.8 mg/mL,呈混悬液,置于4℃冰箱。
健脾通络方实验室制备:称取黄芪768 g加水4 L,提取2次,每次2 h,合并2次提取液,过滤,浓缩至400 mL。称取制马钱子粉6.4 g,地龙粉3.2 g,与黄芪水煎液混合定容至500 mL,制成健脾通络方(方中马钱子质量浓度为12.8 mg/mL,黄芪:马钱子:地龙=24∶2∶1),置于4 ℃冰箱,保存在药物安评价中心,编号:20180601。
1.3 仪器
QI软件(Waters3.0);超高液相色谱-飞行时间-质谱(UPLC-TOF-MS)仪(美国Waters公司);KDC-160HR高速冷冻离心机(科大创新有限公司中佳分公司);MassLynx V4.1工作站(美国Waters公司);电子天平AB265-S电子分析天平(梅特勒-托利多仪器有限公司); SIM-F124制冰机(日本三洋公司);BX41TF光学显微镜(OLYMPUS);LKB-8800超薄切片机(瑞典);超纯水仪(美国Millipore公司);超净工作台(中国上海精密仪器仪表公司);高压灭菌器(德国BMT有限公司);罗氏COBAS c311生化分析仪。
2 方法
2.1 分组及给药
将SD大鼠30只,随机分为空白对照组( control group)、马钱子组(Strychnos group)和健脾通络复方组(Formulation group),每组10只。给药体积为10 mL/kg体质量,马钱子组给药量为128 mg/kg体质量,含有士的宁量为1.02 mg/kg,相当于LD50值的1/3,相当于药典中临床指导用量7倍;健脾通络复方组给药量为1 728 mg/kg体质量,给药周期1次/d,连续30 d,每周称体质量,重新换算给药量。对照组给予0.3%CMC水溶液。
2.2 血清样本的收集与制备
末次给药24 h后,将大鼠麻醉,腹主动脉取血,将取出的血液常温下静置30 min,4 ℃,13 000 r/min离心10 min,取上清液,一部分做生化指标检测,一部分冻存-80 ℃冰箱中做代谢组学备用。
采用速率A法测定血清中UREA的含量,采用两点终点法测定血清中CREA的含量。
2.3 组织病理学检查
动物以3%戊巴比妥钠麻醉安乐死后,将肾脏置于10%中性福尔马林固定液固定,充分固定的组织制片后进行HE染色,光学显微镜检查,记录病变。
2.4 代谢组学样本分析方法的建立
2.4.1 UPLC条件
色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm),进样量:3 μL,流速:0.4 mL/min,流动相:0.1%甲酸乙腈(A)-0.1%甲酸水溶液(B),洗脱梯度:1%~10%A(0~2.5 min);10%~40%A(2.5~3.5 min);40%~70%A(3.5~11 min);70%~80%A(11~12 min);80%~100%A(12~13 min),柱温40 ℃。
2.4.2 MS条件
电喷雾离子源(ESI),采用正、负离子模式下检测,Lock Mass采用全扫描方式,质量扫描范围为质荷比m/z100~1 500,喷雾频率为10 s,采用美国Waters公司LockSprayTM校正系统进行在线质量校正。亮氨酸脑啡肽准分子离子峰[M+H]+556.277 1及[M-H]-554.261 5,锁定质量浓度为1 ng/mL,体积流量为30 μL/min。检测条件详见表1。
2.4.3 多元数据分析
通过UPLC-TOF-MS技术对所得离子产生的质谱峰进行分析,制得总离子流色谱图并同时开展对离子峰的提取、对齐和匹配,将数据导入Progenesis QI并联合使用Marker Lynx XS软件进行分析,即可确定数据中代谢物的分子质量。将所获得数据筛选内源性成分后进入Ezinfo 2.0软件处理分析,将原始数据可视化处理,对大鼠血清中代谢物组进行无监督的主成分分析(PCA)来检查异常值和分类趋势,并且绘制Scores plot图,以反应组间离散度情况,同时对获得的复杂多维数据进行降维处理,其中每个点代表准确的保留时间,X轴代表变量,距离原点越远的数据的相对贡献度越大,探讨各自组内的代谢物轨迹相似度情况及是否呈现聚类效应。结合各组间各离子点量的变化趋势,在S-plot图中选择潜在的生物标志物,采用变量投射重要性(VIP)>4的离子作为投射筛选条件,且t检验P<0.05的变量作为显著差异物质的候选变量,找出重要性生物标志物,结合软件中代谢物数据库检索、人类代谢组学数据库(HMDB)和京都基因与基因组百科全书数据库(KEGG),最终鉴定出代谢产物及相关代谢通路。

表1 质谱检测条件
3 结果
3.1 外观行为学观察
空白对照组大鼠给药期间外观无异常,背毛有光泽,口鼻干净无分泌物;饮食、水正常体质量呈增加趋势;马钱子组大鼠给药中期有震颤、流涎、烦躁等症状,后期出现活动较少等症状,饮食、水减少,体质量呈平稳趋势略有增加;健脾通络复方组给药中期有脱毛、稀便、活动减少等现象,给药后期恢复正常,饮食、水减少,怀疑是由给药量过大,导致大鼠食欲减少,体质量呈平稳增长趋势(见图1)。
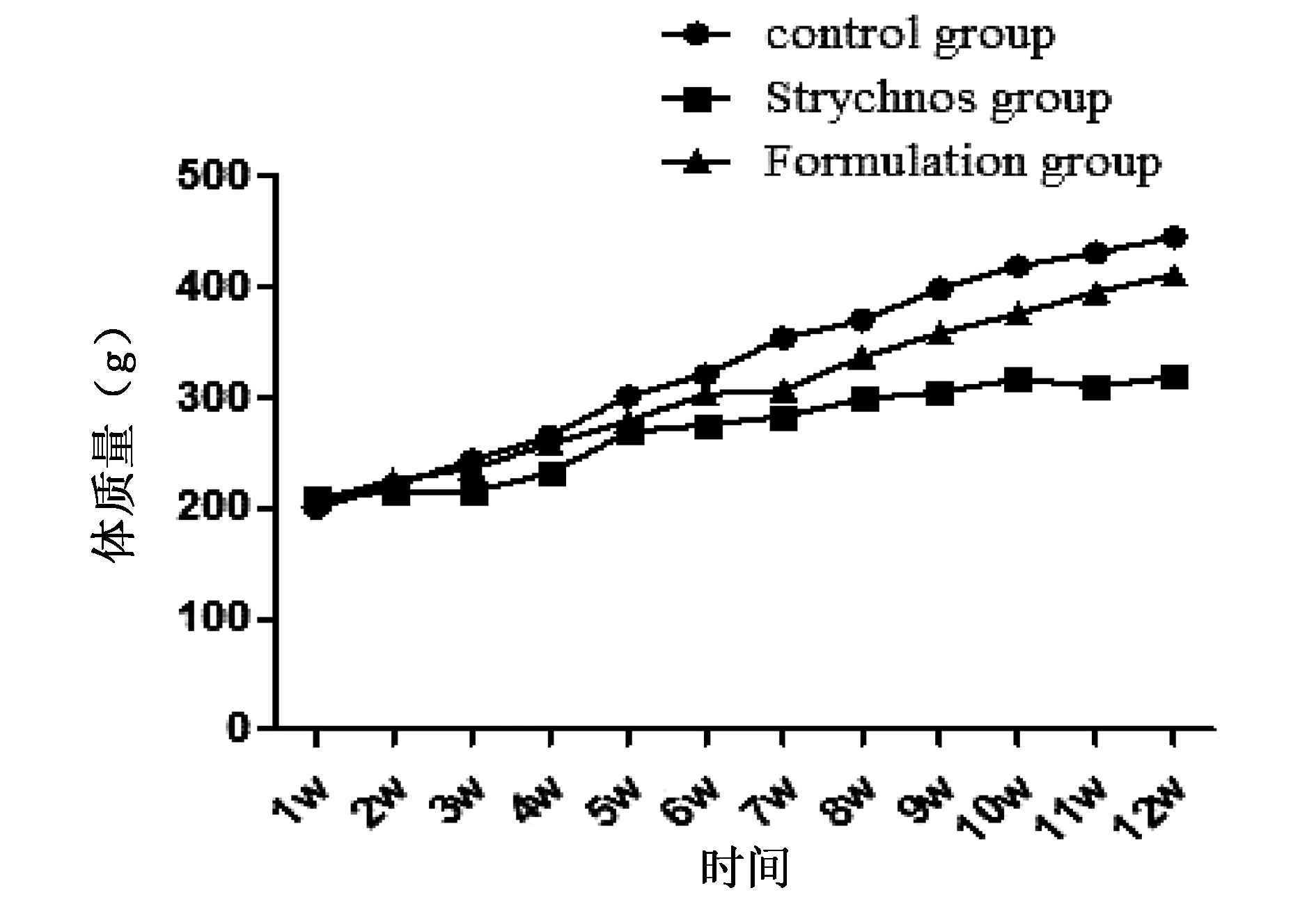
图1 大鼠体质量趋势图
3.2 生化指标检测
大鼠给药90 d时,马钱子组大鼠血清中CREA和UREA水平与空白组对照比较都有极显著性升高(P<0.01);健脾通络复方组大鼠血清中CREA水平与空白对照组比较有显著性升高(P<0.05),与马钱子组比较有显著性降低(P<0.05);UREA水平与空白对照组比较无显著性差异,与马钱子组比较有极显著性降低(P<0.01)(见图2,表2)。

注:与对照组比较,*P<0.05,**P<0.01;与马钱子组比较,#P<0.05,##P<0.01图2 大鼠血清中CREA(A)和UREA(B)表达水平

表2 大鼠血清中CREA 和UREA表达水平
3.3 组织病理学检测
肾脏经HE染色镜下观察可以发现:马钱子组大鼠肾脏组织部分肾小管肿胀管腔变窄(见图3A)、上皮细胞细胞核肿胀(见图3B)、明显的肾小管上皮变性萎缩(见图3C)、皮髓交界处伴有纤维增生(见图3D),并伴有炎性细胞浸润(见图3B)和管型(见图3E)等组织病理学变化;与马钱子组相比,健脾通络复方组大鼠肾脏在肾小管上皮变性(见图3H)、上皮细胞细胞核肿胀(见图3F)、肾小管肿胀(见图3G)、炎性细胞浸润等组织病理学变化程度较轻,未见管型;空白对照组大鼠肾脏肾小球大小无明显变化,肾脏肾小球毛细血管未出现扩张充血,上皮细胞未观察到萎缩、肿胀、变性或脱落,肾小管内无红细胞、白细胞以及管型,肾脏组织未见明显异常(见图3 I)。

注:A、B、C、D、E为马钱子组;F、G、H为健脾通络复方组;I为空白对照组图3 大鼠肾脏组织病理切片HE染色(×400)
3.4 大鼠血清代谢轮廓分析
为了阐明健脾通络方中黄芪、地龙对马钱子的贡献,通过对UPLC-TOF-MS产生的数据进行分析,应用非监督性3D-PCA和多维与降维的处理,以此比较马钱子组、健脾通络复方组与空白组三组样本点之间大鼠血清代谢轮廓状态。结果表明马钱子组与空白对照组可以完全区分开,说明马钱子组大鼠机体生理及物质代谢状况已经发生了明显的改变,而健脾通络复方组向空白组接近,表明由马钱子产生的偏离得到了明显的改善。模型的得分图见图4。
3.5 差异代谢物筛选和鉴定
通过VIP-plot结合S-plot参数获取差异变量,筛选VIP>4的差异变量,且t检验P<0.05的差异变量才被认为是潜在的差异性生物标志物,见图5。获取差异变量,共筛选出9个对影响马钱子配伍减毒贡献大的潜在生物标志物(见表2),热图(图6)展示了这9个差异代谢物在马钱子组和健脾通络组的变化规律,喹啉酸(Quinolinic acid)、L-脯氨酸(L-Proline)、肌酸酐(creatinine)、吲哚乙酸(indoleacetic acid)、胍基丁二酸(Guanidinosuccinic Acid)、同型半胱氨酸(Homocysteine)呈上调趋势,L-精氨酸(L-Arginine)、柠檬酸(Citric acid)、牛磺酸(Taurine)呈下调趋势。

图4 马钱子组和空白对照组正(A)、负离子(B)模型,三组之间正(A)、负离子(B)模型的3D-PCA图

注:A、B正离子模式;C、D负离子模式图5 VIP得分图(A、C);S-plot图(B、D)

表2 血清代谢组学结果

注:竖列:样品;横排:代谢物,颜色越深代表代谢物表达量越高,反之则越低;M为马钱子组;Z为健脾通络复方组图6 血清样品可视化热图
3.6 血清中潜在生物标志物的通路分析
将被筛选出来的生物标志物进行富集,以此作为马钱子配伍减毒的大鼠血清代谢组学中标志性生物标志物,通过通路分析来寻找相关的代谢途径。潜在代谢通路的临界值大于0.10,结果显示出10个代谢通路(见表3和图7)。关键代谢途径主要富集于牛磺酸和次牛磺酸代谢(Taurine and hypotaurine metabolism)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、精氨酸生物合成(Arginine biosynthesis)、三羧酸循环(TCA cycle)、色氨酸代谢(Tryptophan metabolism)。在健脾通络复方给药干预后,代谢通路紊乱的现象明显改善,代谢产物的含量出现回调趋势,在代谢通路的水平上,显示出马钱子配伍后对大鼠肾毒性有明显的减轻作用。

注:1代表牛磺酸和次牛磺酸代谢;2代表精氨酸和脯氨酸代谢;3代表精氨酸生物合成;4代表三羧酸循环;5代表色氨酸代谢图7 代谢通路对减毒影响分析

表3 代谢通路对减毒的影响
4 结果与讨论
血液的生化指标肌酐(CREA)和尿素氮(UREA)被认为是传统的肾功能损伤标志物,CREA是人体肌肉中代谢产物,在外源性摄入量与体内生成量基本恒定的前提下,血清CREA浓度主要取决于肾小球滤过功能,当肾功能受到损伤时,血清肌酐浓度由于蓄积会迅速上升;UREA也是评价肾功能的主要指标,各种肾实质性病变均可使血清中UREA增高。其作为血清生化指标在临床诊断中被广泛应用,但当生化指标出现改变时,往往已经造成了器质性病变[9],当肾脏受损伤时,生物合成和分解代谢之间平衡已被破坏,积极评估早于临床生化指标变化的内源性敏感肾毒性生物标志物更为重要。本文基于血清生化、组织病理学结合血清代谢组学,从整体和微观角度描述了马钱子复方配伍前后大鼠血清代谢轮廓的变化及肾脏组织之间的病理状态,阐明马钱子肾毒性的机制作用以及健脾通络方配伍减毒可能干预的代谢通路。在血清代谢组学研究中,各组3D-PCA图结果显示,对照组和马钱子组呈不同聚类,而健脾通络方组能够使代谢轨迹从马钱子组向对照组转移,提示了健脾通络方配伍减毒的作用,通过VIP-plot结合S-plot参数获取差异变量,鉴别出9个对影响马钱子配伍减肾毒贡献大的潜在生物标志物主要参与牛磺酸和次牛磺酸代谢、精氨酸和脯氨酸代谢、精氨酸生物合成、三羧酸循环、色氨酸代谢。
牛磺酸(taurine)是半胱氨酸的代谢产物,在细胞质中由黄丙氨酸在谷氨酸脱羧酶1和半胱氨酸亚磺酸脱羧酶作用下脱去二氧化碳转化形成,次牛磺酸(hypotaurine)是牛磺酸的直接前体。牛磺酸是内源性抗氧化剂,具有抗氧化、抗炎和免疫调节等广泛生物效应,可提高氧化酶活性,改善肾组织氧化损伤程度[11]。代谢通路富集分析发现牛磺酸与次牛磺酸代谢是马钱子引起肾损伤最重要的代谢通路之一(见图6、7),有研究表明牛磺酸和次牛磺酸代谢可以对T2DM模型引起的肾损伤有保护作用[12]。马钱子组大鼠血清中牛磺酸含量呈下降趋势,引起明显的肾功能损伤,血清生化检测和肾脏组织病变相互佐证,推测健脾通络复方通过牛磺酸和次牛磺酸代谢途径调节脂质过氧化改善氧化损伤,有效抑制马钱子引起的肾毒性。
L-脯氨酸(L-Proline)参与谷氨酸的合成,是一种潜在的内源性神经毒素,可对神经细胞和组织造成损害。L-精氨酸(L-Arginine)是一种半必需氨基酸,但在某些病理状态下则为必需氨基酸,是mTOR的诱导剂,通过mTOR途径诱导蛋白合成,很多分解代谢性疾病如损伤、癌症等都会导致精氨酸耗竭[13]。其代谢产物为多胺、一氧化氮(NO)和氧化氮,研究表明NO具有广泛的生化活性,可消除活性氧自由基,改善组织微循环;通过精氨酸酶-1将精氨酸分解为聚胺,参与合成和稳定细胞外基质[14];本实验证明马钱子组大鼠血清中L-脯氨酸升高、L-精氨酸浓度降低,这与该组大鼠症状观察体现的抽搐、烦躁、活动减少等神经毒性症状相呼应。另外,肌酸酐(creatinine)由血清转移到肾脏,通过肾小球滤过和肾小管排泄排出体外,通常被作为肾功能损伤评价指标[15]。
柠檬酸(Citric acid)参与三羧酸(TCA)循环,是机体获得能量的主要方式之一,常在线粒体中进行[16],受线粒体功能及体内能量产生、利用的影响,TCA循环作为物质和能量代谢的总枢纽,是三大营养素的最终代谢通路。然而TCA 循环需要丙酮酸的参与,当TCA循环受到抑制,使得丙酮酸积累导致α-酮戊二酸脱氢酶系统活性增强,促进活性氧(ROS)产生,使氧化应激反应增加,从而产生炎症反应[17]。有研究证明TCA循环异常可以导致线粒体功能失调,从而导致肾脏组织损伤[18]。本实验血清代谢组学显示,马钱子组中柠檬酸含量呈下降趋势,推测健脾通络复方可能通改善三羧酸循环,抑制线粒体、细胞凋亡,改善肾功能损伤。
吲哚乙酸(indoleacetic acid,IAA)是色氨酸代谢的分解产物,色氨酸能够减少应激和炎症反应。色氨酸代谢的主要方式是犬尿酸原代谢途径,该途径可以产生乙酰辅酶A,其是TCA循环的起始底物,可以进入TCA循环进行彻底氧化供能,有研究表明黄芪可以显著降低大鼠吲哚乙酸的含量,使乙酰辅酶A产量正常,可以有效调节能量代谢紊乱情况[19]。本实验发现马钱子组大鼠血清吲哚乙酸含量明显升高,健脾通络复方干预后可以逆转此趋势。推测黄芪配伍马钱子可以通过调节色氨酸代谢途径,减少氧化应激和炎症反应从而改善肾损伤,这与色氨酸的另一个代谢产物喹啉酸(Quinolinic acid)生物效应一致,喹啉酸常被激活的巨噬细胞释放,作为内源性脑兴奋毒素[20]。健脾通络复方中马钱子通过配伍黄芪调节精氨酸生物合成与色氨酸代谢,抑制巨噬细胞产生内源性兴奋毒素,提高抗氧化能力,减少氧化应激从而制约马钱子毒性。
胍基丁二酸(Guanidinosuccinic Acid,GSA)是由尿素水平升高刺激精氨酸琥珀酸(ASA)被自由基氧化产生的,它和IAA被认为是尿毒症毒素[21],在此代谢过程中还会导致同型半胱氨酸(Homocysteine,Hcy)的积累,Hcy是由蛋氨酸去甲基化形成的,肾脏组织中含有丰富的甲基化酶,当发生肾损伤时,甲基化酶的缺失会导致Hcy的甲基化减速引起Hcy水平升高,进而造成肾功能恶化,所以Hcy常被看作肾功能标志物[22-23]。
本实验采用代谢组学技术结合血清生化和组织病理学手段,从整体微观角度描述了马钱子复方配伍前后机体变化,提示健脾通络方配伍减毒的作用。代谢通路结果提示,马钱子主要影响了机体的氨基酸代谢、能量代谢以及线粒体功能障碍,而健脾通络复方则能逆转这些异常发挥配伍减毒的作用,从而揭示了“异类相制”的科学内涵。

