蜂房哈夫尼菌胞外蛋白酶的特性
李 英, 张 公 亮, 毕 景 然, 侯 红 漫
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
蜂房哈夫尼菌(Hafniaalvei)是革兰阴性菌,存在于人和动物的粪便、自然界水和土壤中。该菌属于条件致病菌,在特定的条件下可引起多种肠道感染疾病[1-2]。冷藏储存温度在4 ℃左右,其他非低温耐受细菌的生长受到损害抑制,而蜂房哈夫尼菌仍能正常生长繁殖,且数量急速增加[3],是导致食品腐败变质、影响风味和贮藏时间的重要因素。在真空包装食品中,哈夫尼菌属和沙雷氏菌属是肠杆科菌属的优势腐败微生物[3-4]。蜂房哈夫尼菌在冷冻牛肉、生牛奶等食品腐败期间,是一种优势腐败菌,在微生物腐败中起重要作用[5]。
由微生物分泌的在食品腐败过程中起关键作用的酶包括蛋白酶或蛋白水解酶(EC 3.4)、氨基酸脱羧酶(EC 4.1.1)和脂肪酶(EC 3.1.1)[6]。蛋白酶是一类可以水解蛋白质肽键的酶的总称,也是生命活动中一类极重要的水解酶,可以水解蛋白质产生小肽或氨基酸[7]。根据活性中心不同,可以将蛋白酶分成四大类:丝氨酸蛋白酶、金属蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶。
目前,对气单胞菌、假单胞菌等的胞外蛋白酶已有较深入研究[8],嗜水气单胞菌的胞外蛋白酶(Extracellular proteases,ECPase)是一种致病因子[9],荧光假单胞菌(Pseudomonasfluorescens)分泌的耐热胞外蛋白酶是影响高钙奶品质的重要因素之一[10]。Gill等[11]研究指出,水产品冷链流通中高水分蛋白食品的特定腐败菌是假单胞菌属(Pseudomonas)和希瓦氏菌属(Shewanella)。但对蜂房哈夫尼菌是否分泌胞外蛋白酶迄今未见报道。本实验对蜂房哈夫尼菌产胞外蛋白酶进行了初步研究,为该菌株所产胞外蛋白酶的进一步分离、纯化和性质研究奠定基础。
1 材料与方法
1.1 材料与试剂
蜂房哈夫尼菌野生株,分离自即食海参;蛋白Marker,大连瑞真生物技术有限公司。
LB液体培养基:酵母浸粉0.5 g,胰蛋白胨1.0 g,氯化钠1.0 g,去离子水100 mL,pH 7.5,121 ℃灭菌20 min。
LB固体培养基:酵母浸粉0.5 g,胰蛋白胨1.0 g,氯化钠1.0 g,琼脂粉1.5 g,去离子水100 mL,加热溶解,pH 7.5、121 ℃灭菌20 min。
1.2 仪器与设备
透析袋MD44,Solarbio;UV 2102型紫外分光光度计,岛津(上海)仪器有限公司;SpectraMax M2多功能酶标仪,美谷分子仪器(上海)有限公司;Sorvall ST 16R高速冷冻离心机,赛默飞世尔科技(中国)有限公司。
1.3 方 法
1.3.1 蛋白酶液的制备
细菌培养及胞外产物获得:将冻存于-80 ℃的蜂房哈夫尼菌野生株接种于LB液体培养基中,30 ℃、150 r/min培养16 h,采用平板划线法在LB平板中活化2次,挑取单菌落接种于LB液体培养基中,30 ℃、150 r/min培养16 h备用。
将菌液按体积比1∶100转接到新鲜的LB培养基中,30 ℃、150 r/min培养,每4 h取样一次(相同体积),4 ℃、10 000 r/min离心10 min[12],收集上清液备用。
1.3.2 硫酸铵盐析
采用硫酸铵分级沉淀法提取胞外蛋白酶。取一定体积收集的上清液,缓慢加入硫酸铵粉末,使上清液中硫酸铵的饱和度到达20%,4 ℃下匀速搅拌30 min,静置2 h,12 000 r/min离心10 min,分别收集上清液和沉淀;上清液中缓慢加入硫酸铵粉末至饱和度达到30%,重复以上操作,至上清液中硫酸铵的最终饱和度为70%,4 ℃匀速搅拌30 min后静置2 h,12 000 r/min离心10 min,收集沉淀。
将收集的硫酸铵饱和度为20%、30%、40%、50%、60%、70%的沉淀用20 mmol/L Tris-HCl(pH 8.0)重悬,离心去除不溶沉淀,重悬液分装于8 ku透析袋,用20 mmol/l Tris-HCl (pH 8.0)、4 ℃ 过夜透析。透析后离心除去沉淀,收集得到总蛋白粗提液,于-20 ℃保存。
1.3.3 蛋白酶活力的测定
1.3.3.1 2%干酪素溶液的配制
称取干酪素2.00 g加入10 mL 0.1 mol/L NaOH溶液润湿后,再加入70 mL Tris-HCl缓冲液,于沸水浴中加热至酪蛋白完全溶解,用缓冲液定容至100 mL。
1.3.3.2 酪氨酸标准溶液的配制
将L-酪氨酸放于105 ℃烘箱中烘至恒重,准确称重 0.100 0 g于洁净干燥的烧杯中,将6 mL 1 mol/L盐酸加入烧杯中溶解固体,转移至100 mL 容量瓶中,加入0.2 mol/L盐酸,将溶液定容,使L-酪氨酸的终质量浓度为1 000 μg/mL。取液体10 mL,用0.2 mol/L盐酸溶液定容至100 mL,L-酪氨酸终质量浓度为100 μg/mL[13]。
L-酪氨酸标准曲线的绘制参照文献[14],得到标准曲线y=0.052 1x+0.002 9(R2=0.998 1)。
1.3.3.3 酶活力测定
采用福林法测定蛋白酶的活力。酶活力定义:在特定条件下1 mL酶液每分钟水解酪蛋白产生1 μg酪氨酸定义为1个酶活力单位。
1.3.4 酶学性质研究
1.3.4.1 最适反应温度
胞外蛋白酶提取液分别与底物在30、35、40、45、50、55、60 ℃中反应,测定不同温度条件下胞外蛋白酶的酶活力,确定最适反应温度。
1.3.4.2 最适反应pH
胞外蛋白酶提取液分别与底物在pH 6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0中反应,测定不同pH条件下胞外蛋白酶的酶活力,确定最适反应pH。
1.3.4.3 最适NaCl质量分数
在胞外蛋白酶提取液与底物的最适反应温度和pH条件下,加入质量分数依次为3.0%、2.5%、2.0%、1.5%、1.0%、0.5%的NaCl反应。测定不同条件下蛋白酶的酶活力,确定最适NaCl质量分数。
1.3.4.4 金属离子对胞外蛋白酶活性的影响
在胞外蛋白酶提取液与底物的最适反应体系中加入终浓度为10 mmol/L的Mg2+、Mn2+、Ca2+、Zn2+、K+、Fe2+和Cu2+进行反应,测定酶活(不加金属离子作为空白对照)。
1.3.4.5 抑制剂对胞外蛋白酶活性的影响
在胞外蛋白酶提取液与底物的最适反应体系中加入终浓度5 mmol/L PMSF、10 mmol/L EDTA、10 mmol/L碘乙酸,测定酶活。
1.4 红外光谱分析
将溴化钾固体压制成透明的薄片,使用傅里叶红外光谱仪扫描400~4 000 cm-1的吸收情况。将样品与溴化钾固体均匀混合后压制成透明的薄片,在同样条件下使用傅里叶红外光谱扫描400~4 000 cm-1的吸收情况。去除溴化钾背景即为样品的红外吸收光谱图[15]。
整个实验操作过程均在红外灯下进行,以保持环境干燥。压片压力20 MPa,保持2~3 min。
1.5 数据处理和统计分析
结果用(平均数±标准差(SD))表示,使用SPSS 22.0软件进行数据方差分析及多重比较。
2 结果与讨论
2.1 蜂房哈夫尼菌生长曲线及胞外蛋白酶的分泌
采用比色法对HafniaalveiH4的生长曲线进行测定,如图1所示。由图1可知,在HafniaalveiH4生长前期伴随着胞外蛋白酶的分泌,当培养16 h时,菌株生长达到稳定期;到对数期时,检测到最大酶活力,此后趋于稳定状态。由此可知,HafniaalveiH4的生长状态决定着胞外蛋白酶的产生,当菌株生长的密度较高时,胞外蛋白酶活力相应增加;当菌株达到生长稳定期时,胞外蛋白酶活力达到最大。菌株培养时间选择16 h。
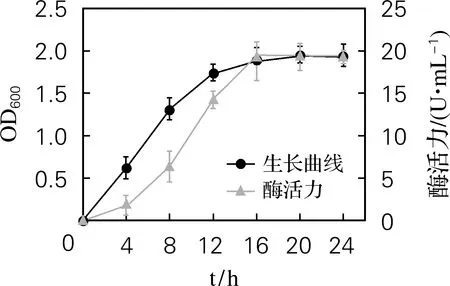
图1 Hafnia alvei H4的生长曲线和酶活力曲线
2.2 不同硫酸铵质量分数提取胞外蛋白酶的酶活力
由图2可以看出,硫酸铵质量分数在20%~50%时,胞外蛋白酶的活力逐渐增大;50%时胞外蛋白酶活力最大;50%~70%时,胞外蛋白酶活力逐渐降低。因此选择硫酸铵质量分数为50%。
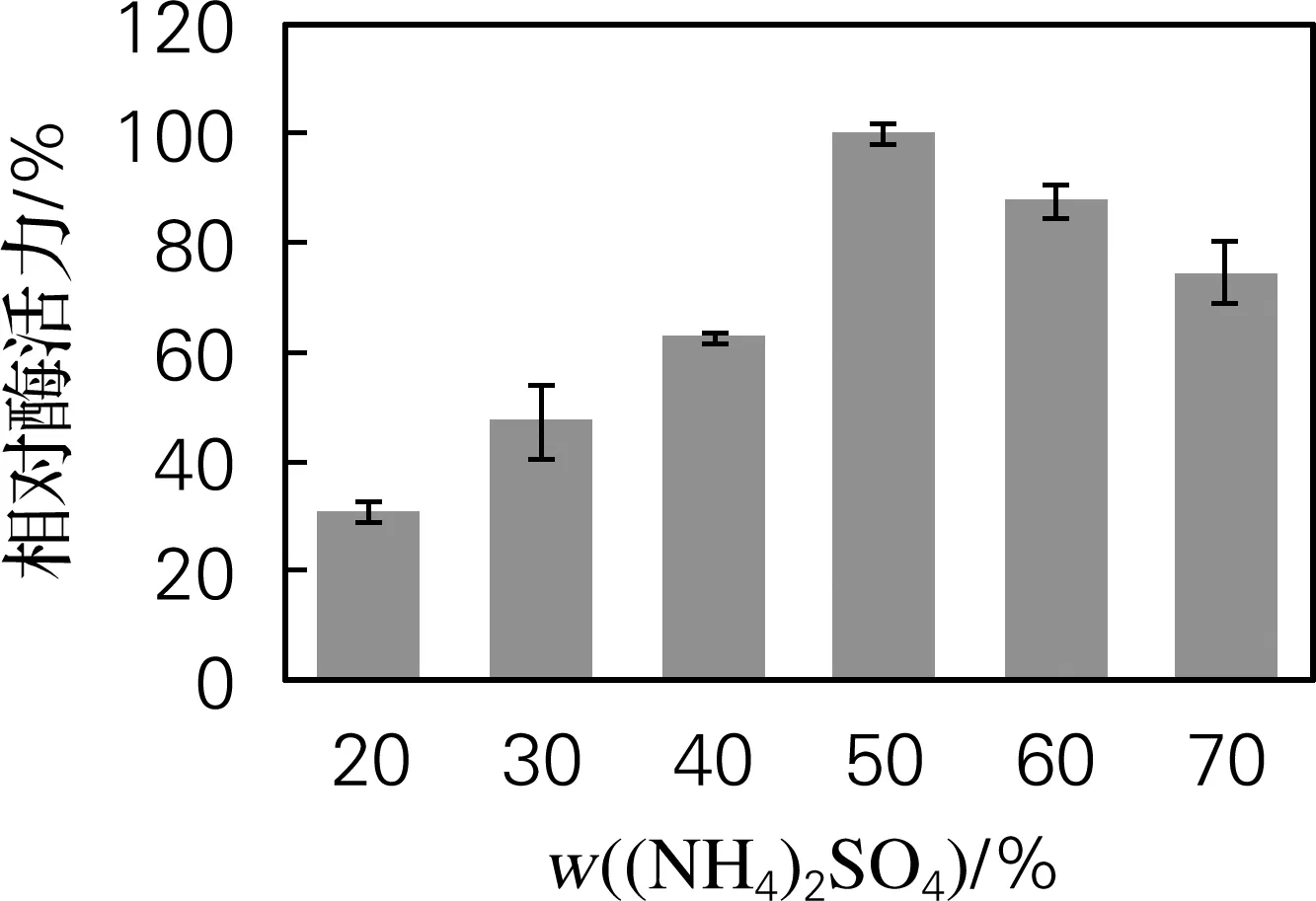
图2 不同硫酸铵质量分数提取胞外蛋白酶的酶活力
2.3 酶学性质
2.3.1 最适反应温度的确定
由图3可知,蛋白酶在30~60 ℃内均具有催化活性,在45 ℃时蛋白酶的活力最高。因此最适反应温度为45 ℃。
2.3.2 最适反应pH的确定
由图4可知,蛋白酶在pH 6.0~11.0具有一定的活力,在pH 7.5时有最高催化活力,在pH 7.5~10.0逐渐下降,当pH大于10时酶活力急剧下降,因此pH=7.5为最适反应pH。
2.3.3 NaCl质量分数对酶活性的影响
从图5可以看出,随着NaCl质量分数的升高,酶活力先上升后下降,最适反应NaCl质量分数为0.5%。
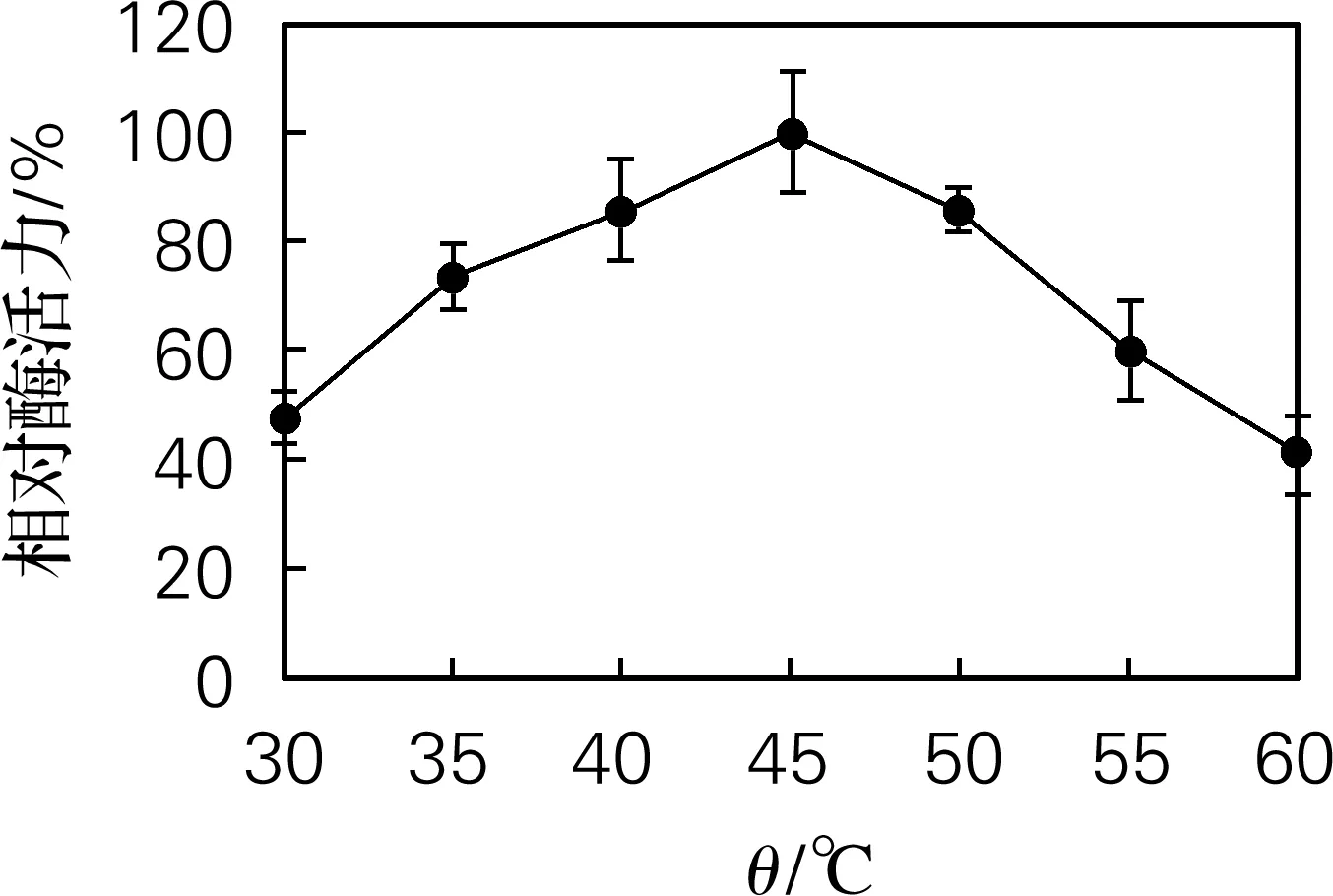
图3 Hafnia alvei H4胞外蛋白酶的最适反应温度
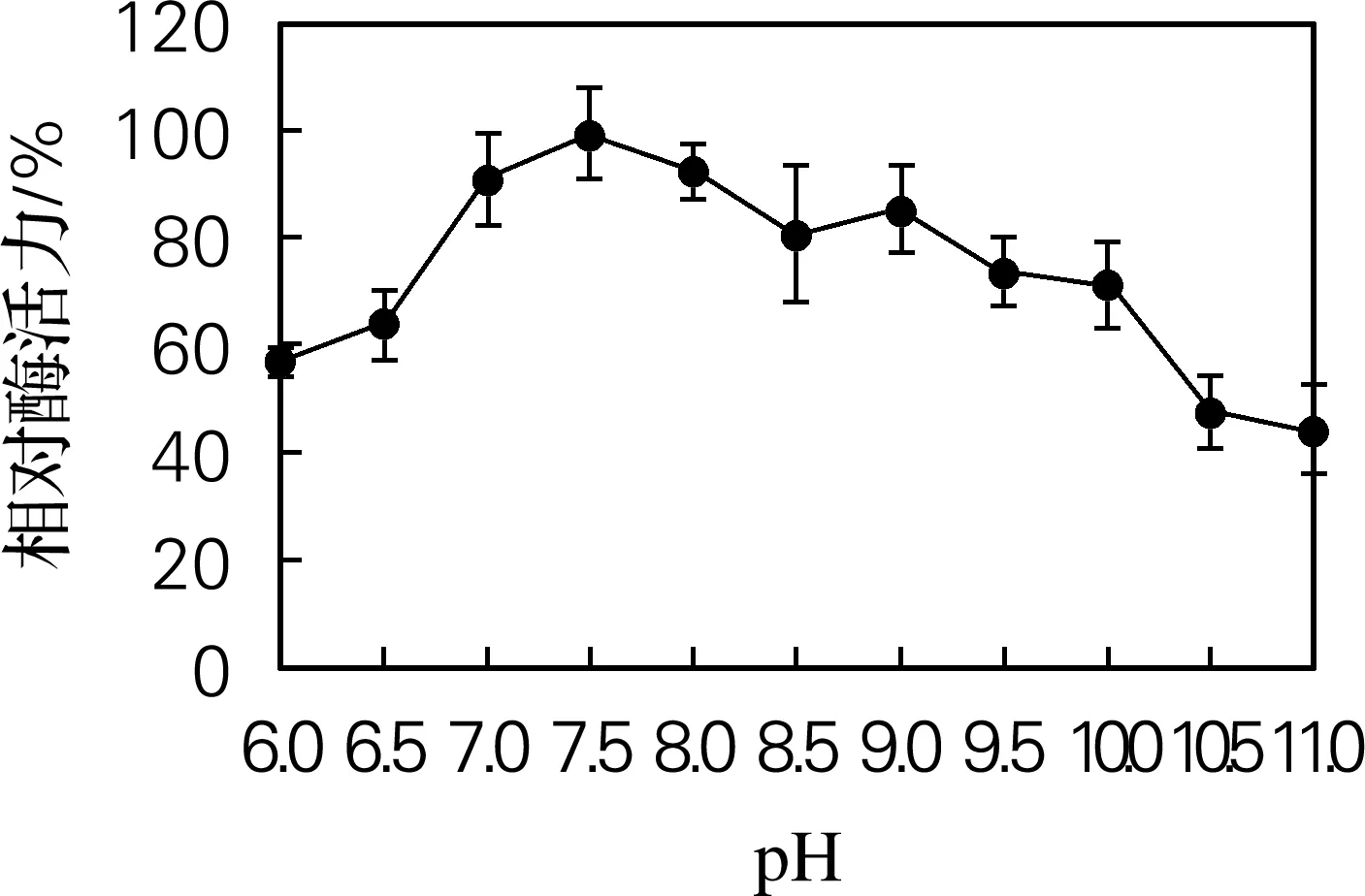
图4 Hafnia alvei H4胞外蛋白酶的最适反应pH
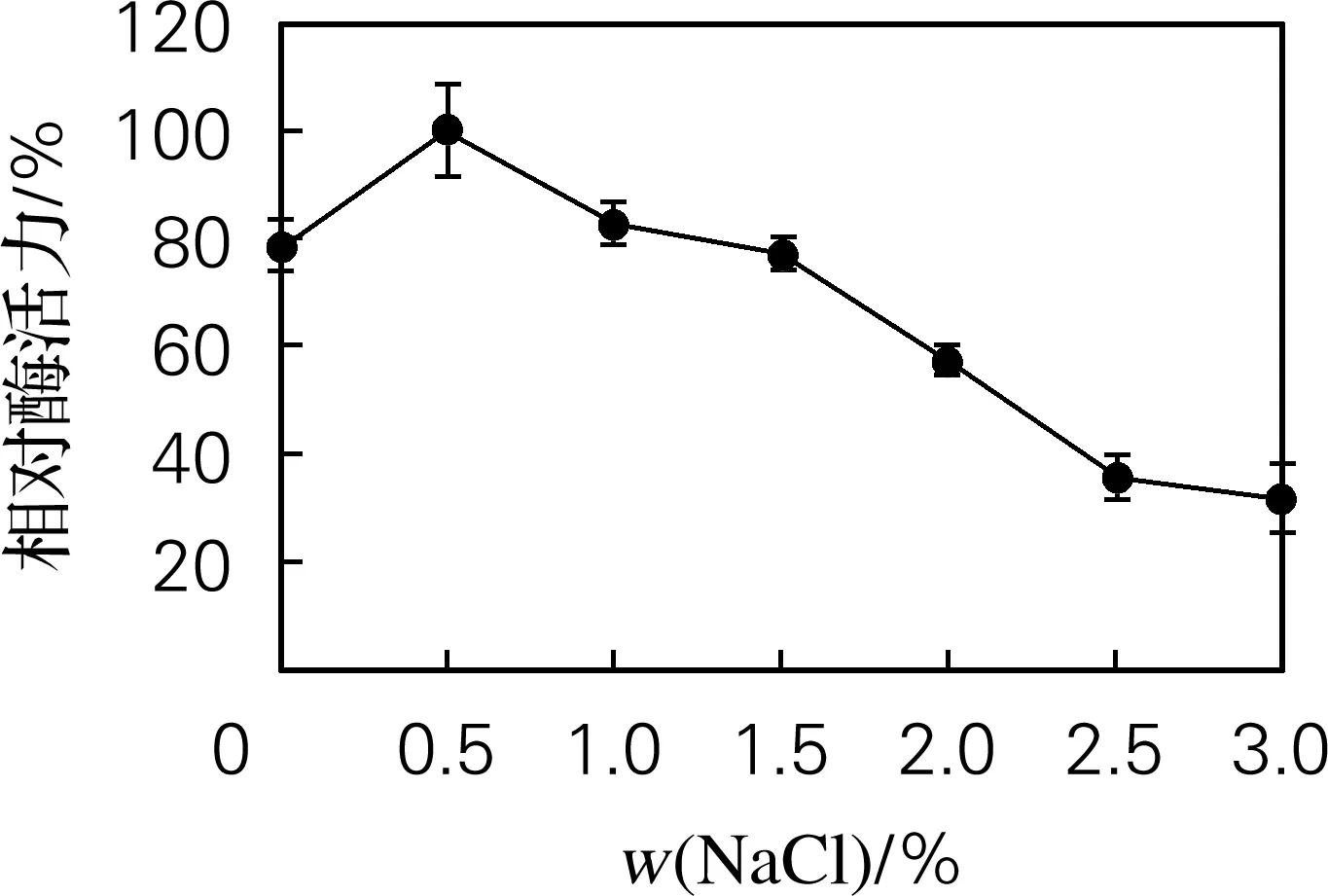
图5 Hafnia alvei H4胞外蛋白酶的最适反应NaCl质量分数
2.3.4 金属离子对酶活性的影响
从图6可以看出,K+、Mg2+对酶活力没有显著影响;Cu2+、Zn2+、Fe2+对酶活力具有抑制作用,3种离子的抑制作用依次减弱;Ca2+、Mn2+对酶活力具有促进作用。
2.3.5 抑制剂对酶活性的影响
由图7可知,EDTA、碘乙酸对酶的活性几乎没有影响,PMSF使蛋白酶的活性降低了75.54%,表明粗酶液中可能存在活性位点为丝氨酸的蛋白酶。
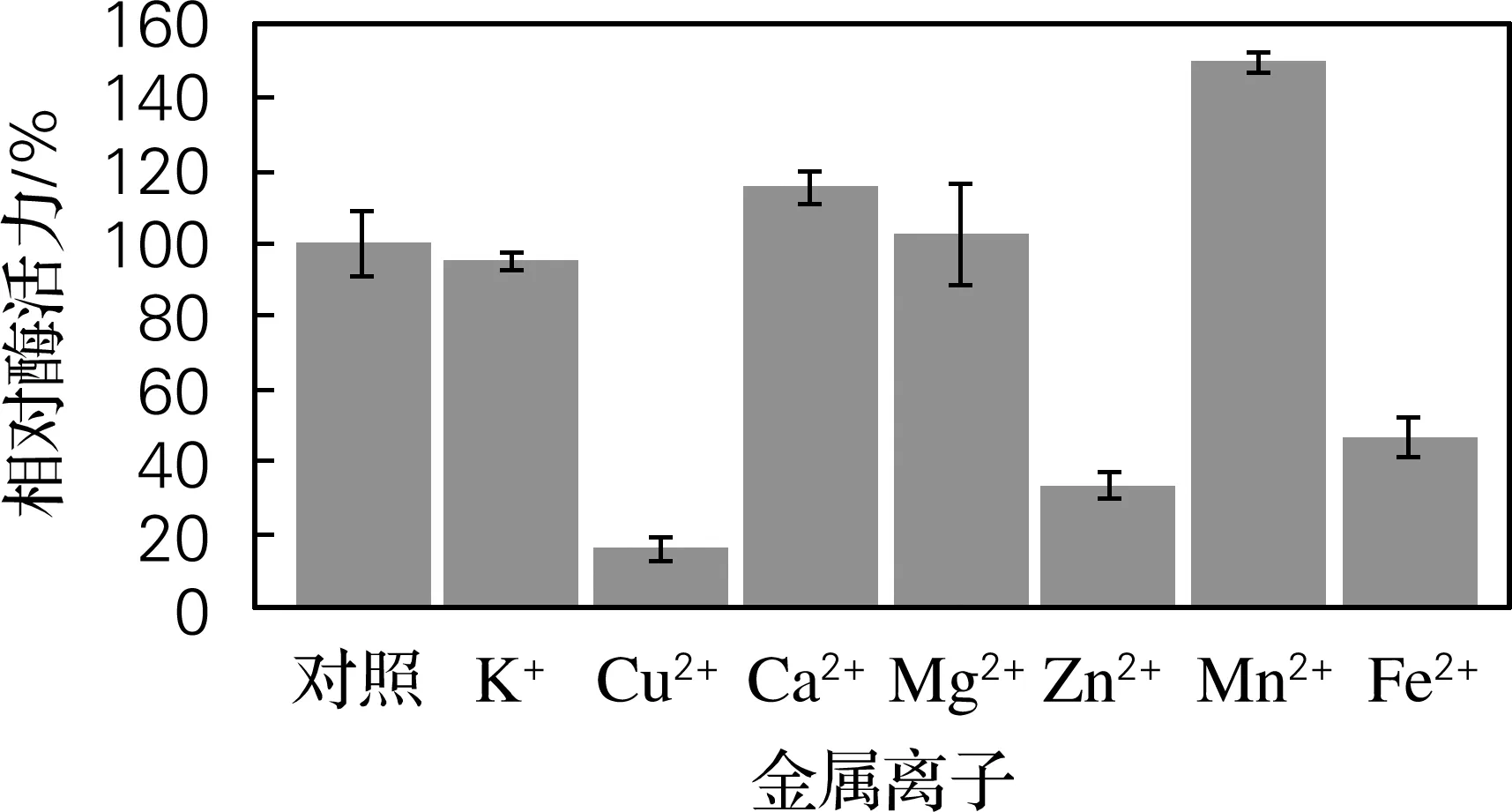
图6 金属离子对Hafnia alvei H4胞外蛋白酶活力的影响
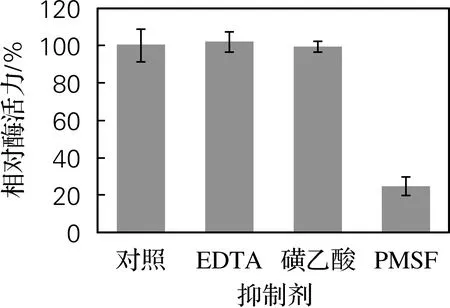
图7 抑制剂对Hafnia alvei H4胞外蛋白酶活力的影响
2.4 红外光谱分析
酰胺I带的吸收峰出现在1 690~1 630 cm-1,酰胺峰是蛋白质的特征吸收峰[16]。由图8可知,此酶在1 663 cm-1有吸收峰,说明具有高级结构。
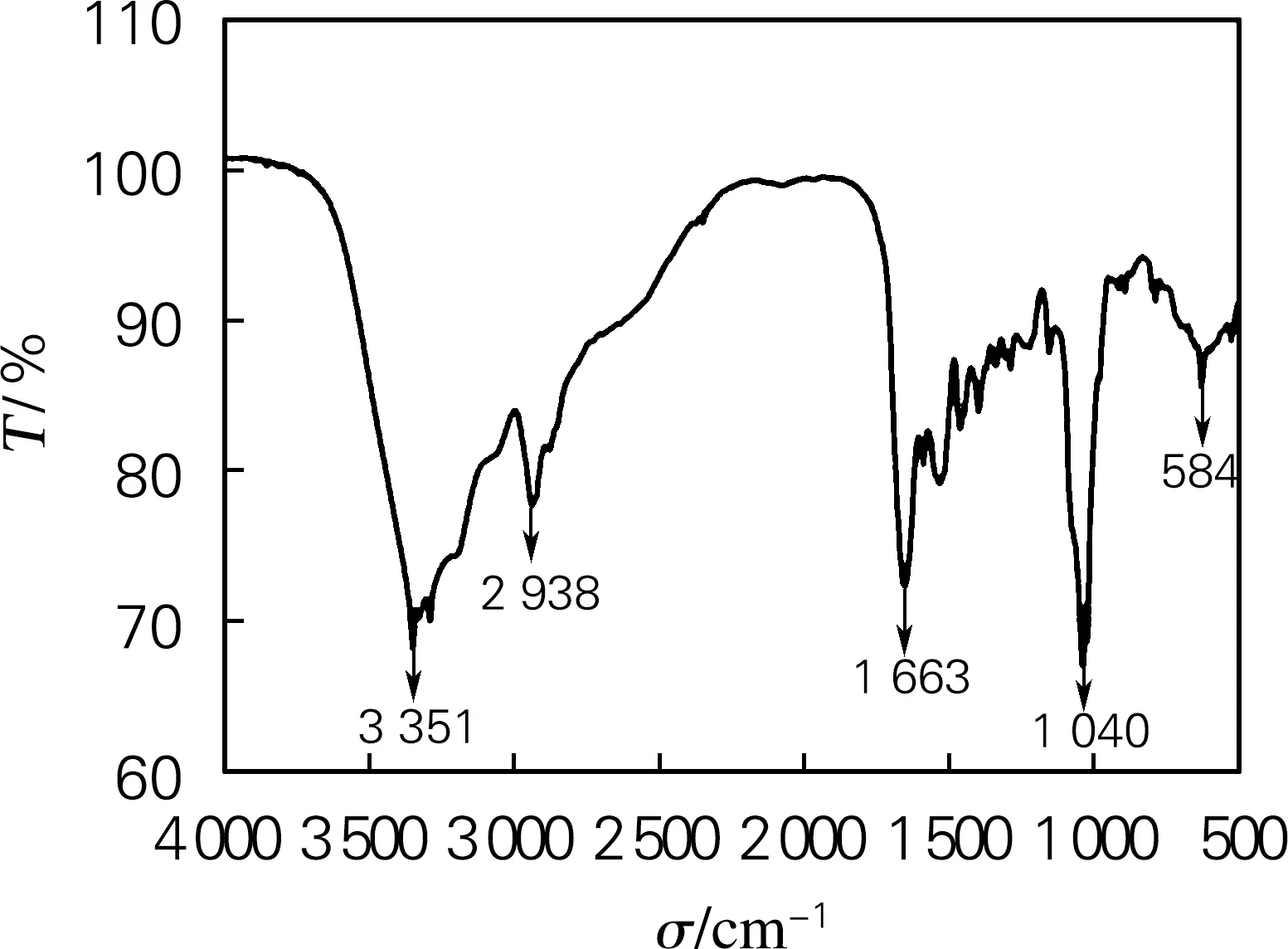
图8 酶的红外光谱分析
3 结 论
采用硫酸铵分级沉淀法提取HafniaalveiH4产生的胞外蛋白酶。结果表明,随着菌株生长密度的增大,酶活力也不断增大。硫酸铵质量分数为50%时提取的酶活力最大,酶最适反应条件为45 ℃、pH 7.5、0.5% NaCl。Cu2+、Zn2+、Fe2+对蛋白酶活力具有抑制作用,而Ca2+、Mn2+对蛋白酶活力具有促进作用,丝氨酸蛋白酶抑制剂PMSF对蛋白酶的活性具有抑制作用。红外光谱结果表明蛋白酶中含有高级结构。

