癌理通膏外敷治疗癌性疼痛的机制研究
陈学彰 田华琴 梁贵文 王斌 李宏良 叶伟琼


〔摘要〕 目的 观察癌理通膏对BALB/c癌性疼痛裸鼠的镇痛作用及对肿瘤生长、脊髓神经生长因子(NGF)、肿瘤坏死因子-α(TNF-α)、内皮素-1(ET-1)、β-内啡肽(β-EP)表达的影响。方法 通过在BALB/c裸鼠大腿外侧近臀部处皮下注射Walker 256乳腺癌细胞的方法建立裸鼠癌痛模型,动态观察癌理通组和模型组裸鼠的自发痛评分、肿瘤体积的变化,剥离肿瘤比较两组肿瘤重量的差异,RT-PCR法检测两组脊髓NGF、TNF-α、ET-1、β-EP的含量变化。结果 癌理通组裸鼠从第7天起自发痛评分明显低于模型组,持续到第10天(P<0.05),肿瘤体积从第3天起明显小于模型组,持续到第10天(P<0.01)。与模型组比较,癌理通组肿瘤重量(P<0.01)、脊髓NGF(P<0.01)及TNF-α(P<0.05)的含量均明显下降,脊髓β-EP含量明显升高(P<0.05),脊髓ET-1含量差异无统计学意义(P>0.05)。结论 癌理通膏能明显改善BALB/c裸鼠的癌性疼痛,其作用机制可能与癌理通膏抑制肿瘤的生长、降低脊髓NGF、TNF-α含量、升高脊髓β-EP的含量有关。
〔关键词〕 癌理通膏;癌性疼痛;肿瘤坏死因子-α;神经生长因子;β-内啡肽;内皮素-1
〔中图分类号〕R285.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.07.012
〔Abstract〕 Objective To observe the analgesic effects of external application with Ailitong Ointment on BALB/c nude mouse with cancer pain and its impact on tumor growth, spinal nerve growth factor (NGF), tumor necrosis factor alpha (TNF-α), endothelin-1 (ET-1) and beta-endorphin (β-EP) expressions. Methods Walker 256 breast cancer cells were hypodermically injected in lateral thigh of BALB/c nude rats to establish nude rat model of cancer pain. The changes of spontaneous pain scores, gross tumor volume in the Ailitong group and the model group were dynamically observed. Tumor tissues were stripped to compare the tumor weight in the 2 groups; RT-PCR was used to detect the changes of spinal NGF, TNF-α, ET-1 and β-EP levels. Results From day 7 to day 10, spontaneous pain scores in the Ailitong group were significantly lower than the model group (P<0.05); From day 3 to day 10, tumor volume in the Ailitong group was significantly smaller than model group (P<0.01). Compared with the model group, the tumor weight (P<0.01), NGF levels (P<0.01) and TNF-α levels (P<0.05) in the Ailitong group were significantly decreased; β-EP levels were significantly increased (P<0.05); ET-1 levels between the 2 groups were not significantly different (P>0.05). Conclusion Ailitong Ointment can significantly relieve the cancer pain of BALB/c nude rats, whose mechanism may be correlated with Ailitong Ointment in inhibiting tumor growth, decreasing NGF and TNF-α contents and increasing β-EP levels.
〔Keywords〕 Ailitong Ointment; cancer pain; tumor necrosis factor alpha; spinal nerve growth factor; beta-endorphin; endothelin-1
癌性疼痛亦称癌痛,是恶性肿瘤患者最常见亦是最痛苦的症状之一,其中包括由肿瘤直接引起的疼痛(如肿瘤压迫,骨、神经、内脏、皮肤、软组织肿瘤浸润或转移等)、肿瘤治疗引起的疼痛及肿瘤诊断检测引起的疼痛等。据国际癌症研究中心(International Agency for Research on Cancer, IARC)统计,2018年全球有18 078 957新增癌症病例,每10万人群中每年约有237人[1]。癌痛是癌症患者常见的症状之一,有80%的晚期癌症患者存在癌痛,其中50%的患者为中、重度癌痛,严重影响着生活质量[2]。我国约25%新诊断的癌症患者、33%正在接受治疗的癌症患者以及75%的晚期肿瘤患者伴有不同程度的疼痛[3]。然而由于目前治疗方法的局限性和治疗所带来的不良反应,仍有20%~40%癌痛患者不能得到满意的镇痛治疗[4],因此,积极寻找更安全有效的癌痛治疗方法具有重要的意义。癌理通膏是佛山市中医院肿瘤中心依据中医理论及多年临床治疗经验研制的院内中药新制剂,具有活血止痛、化瘀散结、攻毒抗癌之功效。在临床应用中观察到癌理通膏有较好的止痛疗效,但其作用机制有待进一步研究。本研究通过皮下注射Walker 256乳腺癌细胞的方法建立裸鼠癌痛模型,动态观察癌理通膏对裸鼠自发痛评分和肿瘤体积的影响,同时检测癌理通膏对肿瘤重量及脊髓神經生长因子(nerve growth factor, NGF)、肿瘤坏死因子-α(tumornecrosis factor alpha, TNF-α)、内皮素-1(endothelin-1, ET-1)和β-内啡肽(beta-endorphin, β-EP)表达的影响。
1 材料与方法
1.1 材料
28只4~5周SPF级雄性BALB/c裸鼠,体质量为20~25 g,由广东省医学实验动物中心提供,实验动物生产许可证号:SCXK(粤)2013-0002,动物合格证号:44007200042979。癌理通膏由佛山市中医院制剂中心提供,批号:13316022。Step One QPCR仪(美国Applied Biosystems公司,批号:ABI7500);Eastep总RNA提取试剂盒(上海Promega公司,批号:promega.ls1040);反转录试剂盒RevertAid First Strand cDNA Synthesis Kit(美国Thermo公司,批号:K1622);PCR扩增试剂盒SYBRPremix Ex taqTM(日本Takara公司,批号RR820A);Walker 256乳腺癌细胞株(Walker/LLC-WRC 256,武汉大学保藏中心,CCTCC编号:GDC060)。引物由上海瑞博生物公司设计合成,序列如表1所示。
1.2 动物饲养及分组
BALB/c裸鼠饲养于广东省医学实验动物中心SPF级动物房,每笼4只,光照黑暗周期为12 h∶12 h,自由饮食。28只裸鼠接种W256细胞后,待肿瘤长至约50~100 mm3时,筛选肿瘤大小较为均一的荷瘤裸鼠20只,随机分为模型组、癌理通组,10只/组。
1.3 细胞培养
Walker 256乳腺癌细胞培养在广东省医学实验动物中心细胞室,于37 ℃、5% CO2的环境培养。使用含10%胎牛血清的RPMI1640完全培养液培养,待细胞长至80%~90%满时,按适当比例接种到培养瓶,对传代细胞观察3 d,细胞未见异常,培养液未见异常,该株细胞纳入实验。
1.4 模型制备
将Walker 256 细胞株接种于皮下是目前常用的小鼠移植性肿瘤的造模方式[5]。Walker 256细胞株来源于大鼠自然生长的乳腺肿瘤,皮下注射能很好地模拟人恶性肿瘤膨胀性及浸润性生长的特性[6],能使大鼠出现痛觉过敏,痛觉超敏和自发痛等癌痛特征,且成瘤率高,是研究癌痛的良好实验动物模型[7-8]。本实验研究参考Sasamura等[9]的方法,Walker 256乳腺癌细胞复苏后,取对数生长期的细胞,用PBS制备成1.2×107个/mL浓度的细胞悬液,接种于28只裸鼠大腿外侧近臀部处皮下(每只裸鼠200 μL,约2.4×106个细胞)。
1.5 给药方法
按成人等效剂量换算成裸鼠癌理通膏的剂量为61 g/kg,分组当天起癌理通组裸鼠每日按体质量称取适量的癌理通膏,将其置于压敏胶纸上,再行敷贴至肿瘤处,用透气胶贴固定,每日敷贴6 h。期间将裸鼠装至50 mL带透气孔的离心管固定,模型组涂抹生理盐水后同法固定裸鼠6 h,连续给药10 d。给药方法参考刘耀[10]、姜涌[11]的给药方式。
1.6 自发痛评分
自发痛评分是通过观察受试动物行走时后足使用情况对自发性疼痛行为进行评分的方法[12]。该方法由Mouedden等[13]提出,目前,主要用于骨癌痛模型的评估[14]。分别于敷贴给药前,敷贴给药后第3、5、7、10天(记为敷药前、第3天、第5天、第7天、第10天),将各组裸鼠分别放入40 cm×40 cm的平底观察盒内,根据裸鼠自发行走進行评分。评分标准[15]:正常行走得0分,轻度跛行得1分,中度跛行得2分,严重跛行得3分,完全残疾得4分。
1.7 测量肿瘤体积及重量
每周测量肿瘤的最长径(a)、最短径(b)2次,计算肿瘤体积,计算公式为:V=1/2ab2。计算相对肿瘤体积(relative tumor volume,RTV),计算公式[16]为:RTV=Vt/V0。其中V0为分组时即第一次敷药前(记为敷药前)测量所得肿瘤体积,Vt为第t天测量时的肿瘤体积。计算相对肿瘤增殖率:相对肿瘤增殖率=TRTV/CRTV×100%(TRTV:癌理通组RTV;CRTV:模型组RTV)。当相对肿瘤增殖率大于40%时为治疗无效;当小于或等于40%时,且与模型组比较,Vt或RTV的差异P<0.05为治疗有效。
最后一次自发痛评分和肿瘤体积测量结束后过量二氧化碳吸入法处死裸鼠,剥离肿瘤称量重量。计算肿瘤生长抑制率[17]:肿瘤生长抑制率=(模型组肿瘤重量-癌理通组肿瘤重量)/模型组肿瘤重量×100%。当肿瘤生长抑制率小于40%为治疗无效;肿瘤生长抑制大于或等于40%为治疗有效。
1.8 检测NGF、TNF-α、ET-1、β-EP的基因相对表达量
过量二氧化碳吸入法处死裸鼠后,取脊髓L4-L6腰膨大部分迅速投入液氮冻存后放-80 ℃冰箱保存,用于RT-PCR检测NGF、TNF-α、ET-1和β-EP的表达。按照Eastep总RNA提取试剂盒说明书操作步骤经过裂解、稀释、静置、离心、清洗、溶解后提取总RNA并用紫外分光光度计测量RNA浓度,根据等量加入总RNA的原则计算出应加入总RNA体积并加入到逆转录反应体系中(20 μL),将RNA逆转录成cDNA。随后取2 μL cDNA加入PCR扩增反应体系(20 μL)中95 ℃ 30 s扩增40个循环,95 ℃ 5 s,60 ℃ 30 s后结束反应。使用2-ΔΔCT法计算基因相对表达量,即2-ΔΔCT=表达量的比值。
1.9 统计学方法
所有数据均运用SPSS 23.0软件进行统计分析,采用“x±s”进行统计学描述。计量资料数据服从正态分布或转换后服从正态分布,则组间比较采用独立样本t检验。数据经转换后仍然不服从正态分布,则组间比较采用非参数检验,P<0.05为差异有统计学意义。
2 结果
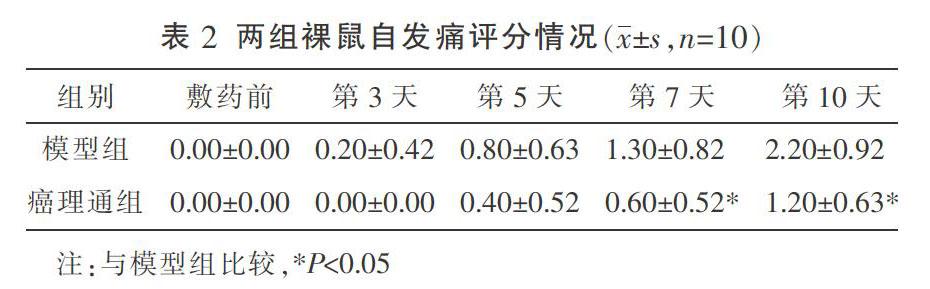
2.1 自发痛评分结果
两组裸鼠的自发痛评分结果如表2所示,敷药前至第5天癌理通组与模型组的自发痛评分差异无统计学意义(P>0.05),第7天和第10天癌理通组的自发痛评分明显低于模型组(P<0.05)。
2.2 肿瘤体积测量结果
如表3-4所示,模型组和癌理通组裸鼠的肿瘤体积在敷药前差异无统计学意义(P>0.05),当连续给药至第3、7、10天时,癌理通组裸鼠的肿瘤体积与相对肿瘤体积均明显小于模型组(P<0.01)。相对肿瘤增殖率为33.30%,低于40%。
2.3 肿瘤重量测定结果
癌理通组裸鼠经过10 d的贴敷治疗,肿瘤重量(2.40±0.79) g明显小于模型组肿瘤重量(6.53±1.90) g,差异有统计学意义(P<0.01);癌理通膏对肿瘤的生长抑制率为63.24%。
2.4 脊髓NGF、TNF-α、ET-1、β-EP的基因相对表达结果
与模型组相比,癌理通组脊髓ET-1的基因相对表达量有下降的趋势(P<0.05),NGF、TNF-α基因相对表达量则明显下降(P<0.01,P<0.05),β-EP的基因相对表达量则明显升高(P<0.05)。结果见表4。
3 讨论
癌性疼痛是一种机制独特而复杂的慢性疼痛,肿瘤的生长引起的神经压迫与损伤本身就可导致疼痛状态的出现。癌性疼痛属于中医学“痛证”范畴,其病因多样,病机总归“不荣则痛”和“不通则痛”两类,故据其治则“荣则不痛”“通则不痛”确立化瘀、祛痰、散寒、解毒为其常用治法。癌理通膏由制马钱子、蟾酥、毛麝香、徐长卿、金牛皮、冰片6味中药组成,具有活血止痛、化瘀散结及攻毒抗癌之功效。为了明确癌理通膏对癌性疼痛的治疗作用和可能机制,本研究团队动态观察了癌理通膏对癌性疼痛模型裸鼠的自发痛评分和肿瘤大小的影响,发现随着天数的增加,裸鼠的肿瘤体积增大,自发痛评分逐渐升高。从第3天起癌理通组的肿瘤体积和肿瘤相对体积均已明显低于模型组,自发痛评分从第7天起明显低于模型组,癌理通组的肿瘤重量亦明显低于模型组,对肿瘤的生长抑制率高达63.24%,说明癌理通膏能明显减轻癌性疼痛,抑制肿瘤的生长。
除肿瘤本身生长能引起的疼痛外,肿瘤生长所引起的TNF-α、ET-1、NGF、β-EP等的合成与释放也是癌痛的原因之一。NGF属于神经营养因子家族,该家族是对周围和中枢神经系统起营养和支持作用的调节因子,不仅参与神经的发育和存活,还参与痛觉敏感性的调制。有学者研究发现[18]胰腺癌患者的疼痛程度和NGF的含量成正相关。McCaffrey等[19]在小鼠骨肉瘤模型的研究中发现NGF阻滞能减轻40%~70%的癌痛,并且这种作用在动物模型的晚期仍然有效,此外在乳腺癌、肉瘤、前列腺癌骨转移的小鼠模型中,使用NGF抗体均能明显减轻骨癌疼痛。证明NGF的含量上调是疼痛发生的重要机制。本研究发现癌理通膏能明显降低裸鼠脊髓NGF的水平,这可能是癌理通减轻癌痛的机制之一。
TNF-α和ET-1均属重要的炎性介质,TNF-α是由脂多糖刺激巨噬细胞而分泌的一种具有多种生物活性的炎性细胞因子,可诱发肿瘤的发生,介导肿瘤细胞坏死,也是外周和中枢痛敏的重要参与因子之一[19-20]。TNF-α不仅可直接作用于疼痛感受器并诱发其他生物学反应(如炎症、凋亡、免疫应答等),还能增加其他致痛物质,如P物質、缓激肽、前列腺素E2等的致痛作用,此外还能刺激神经末梢改变神经元的兴奋性,并产生机械疼痛和诱发痛觉过敏[21-22]。研究表明促炎细胞因子TNF-α表达升高能明显促进神经病理性疼痛的发生和发展,而阻断TNF-α信号通路能明显减轻癌痛,可能是癌痛治疗的重要靶点[23-24]。ET-1是一种小分子生物活性肽,具有多种生物活性,与肿瘤的发生和发展也有密切联系。ET-1不仅能通过激活神经元上相应的受体,介导疼痛的发生,还能影响癌痛的程度,而使用ET-1受体拮抗剂又可阻断痛觉过敏的发生[25]。有研究[26]提出通过研究40例癌症患者的爆发痛情况发现,血浆ET-1浓度与爆发痛呈显著正相关。本研究对比癌理通组和模型组脊髓中TNF-α、ET-1的表达发现,癌理通膏有降低ET-1表达的趋势,能明显降低裸鼠脊髓TNF-α的表达,提示癌理通膏减少癌痛的发生可能与降低TNF-α的含量从而减轻炎症反应有关。
与NGF、TNF-α和ET-1在癌痛的发生过程中能起到引发、促进的作用不同,β-EP是机体产生的具有镇痛作用的主要内源性阿片肽,镇痛作用部位主要在脊髓以上水平,其浓度可影响患者的痛阈值[27]。研究发现β-EP可以抑制早期胰腺癌小鼠模型的内脏痛[28];在电针治疗小鼠癌痛模型的研究中发现,未做任何干预的癌痛小鼠血和脑中β-EP的浓度比空白对照组高2倍[29]。这些研究均提示β-EP在癌痛中具有重要的止痛作用。本研究发现癌理通组脊髓中β-EP的含量明显高于模型组,表明癌理通膏的镇痛作用可能与提高脊髓中β-EP的含量有关。
综上所述,癌理通膏对Walker/LLC-WRC 256荷瘤裸鼠因肿瘤引起的自发痛有明显的改善作用,其作用机制可能与抑制肿瘤生长、降低脊髓NGF和TNF-α的表达,升高脊髓β-EP的表达有关。
参考文献
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[2] APOLONE G, BERTETTO O, CARACENI A, et al. Pain in cancer. An outcome research project to evaluate the epidemiology, the quality and the effects of pain treatment in cancer patients[J]. Health Qual Life Outcomes, 2006, 4(7): 1-7.
[3] PAICE J A, FERRELL B. The management of cancer pain[J]. CA: A Cancer Journal for Clinicians, 2011, 61(3): 157-182.
[4] WILSON J, STACK C, HESTER J. Recent advances in cancer pain management[J]. F1000 prime Reports, 2014, 6: 10.
[5] GAO Y J, CHENG J K, ZENG Q, et al. Selective inhibition of JNK with a peptide inhibitor attenuates pain hypersensitivity and tumor growth in a mouse skin cancer pain model[J]. Experimental Neurology, 2009, 219(1): 146-155.
[6] LI X, FENG G S, ZHENG C S, et al. Influence of transarterial chemoembolization on angiogenesis and expression of vascular endothelial growth factor and basic fibroblast growth factor in rat with Walker-256 transplanted hepatoma: An experimental study[J]. World Journal of Gastroenterology, 2003, 9(11): 2445-2449.
[7] 邱龙华,顾雅佳,唐 峰,等.大鼠乳腺癌模型建立及其进行磁共振成像的可行性[J].中国医学计算机成像杂志,2008,14(3):259-263.
[8] BRIGATTE P, SAMPAIO S C, GUTIERREZ V P, et al. Walker 256 tumor-bearing rats as a model to study cancer pain[J]. The Journal of Pain, 2007, 8(5): 412-421.
[9] SASAMURA T, NAKAMURA S, IIDA Y, et al. Morphine analgesia suppresses tumor growth and metastasis in a mouse model of cancer pain produced by orthotopic tumor inoculation[J]. European Journal of Pharmacology, 2002, 441(3): 185-191.
[10] 刘 耀,李 忠,白 桦,等.镇痛膏外用缓解癌性疼痛的作用及相关机制研究[J].中医学报,2010,25(4):611-615.
[11] 姜 涌,王 莉,曹 莹,等.癌痛外治机制的实验性研究[J].时珍国医国药,2013,24(7):1780-1783.
[12] 彭 皓,黄 东.啮齿类动物疼痛评估方法的研究进展[J].中国疼痛医学杂志,2014,20(7):505-508.
[13] EL MOUEDDEN M, MEERT T F. Evaluation of pain-related behavior, bone destruction and effectiveness of fentanyl, sufentanil, and morphine in a murine model of cancer pain[J]. Pharmacology, Biochemistry, and Behavior, 2005, 82(1): 109-119.
[14] 黃 东,黄晓玲,阎雪彬,等.C57BL/6小鼠骨癌痛模型的制备与评价[J].中南大学学报(医学版),2008,33(2):115-120.
[15] 焦丽静,董昌盛,王菊勇,等.身痛逐瘀汤对骨癌痛大鼠痛觉行为学的影响[J].世界中西医结合杂志,2016,11(1):24-28.
[16] 朱中博,钱建升,杨 硕,等.不同剂量1 25I粒子植入对人乳腺癌裸鼠荷瘤增殖的抑制作用及其机制[J].吉林大学学报(医学版), 2019,45(6):1305-1309.
[17] SCHEFF N N, YE Y, BHATTACHARYA A, et al. Tumor necrosis factor alpha secreted from oral squamous cell carcinoma contributes to cancer pain and associated inflammation[J]. Pain, 2017, 158(12): 2396-2409.
[18] MCCAFFREY G, THOMPSON M L, MAJUTA L, et al. NGF blockade at early times during bone cancer development attenuates bone destruction and increases limb use[J]. Cancer Researcn, 2014, 74(23): 7014-7023.
[19] ZHAO D, HAN D F, WANG S S, et al. Roles of tumor necrosis factor-αand interleukin-6 in regulating bone cancer pain via TRPA1 signal pathway and beneficial effects of inhibition of neuro-inflammation and TRPA1[J]. Molecular Pain, 2019,15:1-10.
[20] 陈 宏,张双双,杨 科,等.丁香骨痛方外敷联合阿片类药物治疗骨转移癌痛阴证的临床研究[J].中国中医基础医学杂志,2018,24(1):108-110.
[21] 顏 芳,黄成成,路富民,等.癌痛的分子机理研究进展[J].生物技术通讯,2016,27(5):711-715.
[22] YAN X B, PENG T C, HUANG D. Correlations between plasma endothelin-1 levels and breakthrough pain in patients with cancer[J]. OncoTargets and Therapy, 2015, 8: 3703-3706.
[23] 韦日铺,蒋云芳,李扬帆.电针合雷火灸对癌痛镇痛作用及β-EP、PGE2的影响[J].针灸临床杂志,2018,34(11):10-14.
[24] 潘见欢,陈韵姿,王海侨,等.癌理通膏的体外透皮释放特性研究[J].中药材,2017,40(4):907-908.
[25] 彭召云,郑 心,李龙祥,等.肺抑瘤膏对Lewis肺癌种植瘤PI3K/AKT通路的影响[J].中国老年学杂志,2019,39(13):3262-3266.
[26] 张 静,常丽娜.复方止痛膏联合特定电磁波谱治疗仪治疗中重度癌性疼痛的临床观察[J].中国民间疗法,2018,26(6):38-39.
[27] 谢华夏,徐志远,郑国淀,等.槐耳清膏联合顺铂改变胃癌SGC7901细胞周期分布的实验研究[J].浙江医学,2017,39(14): 1155-1157,1174.
[28] 赵改霞,郑 心.肺抑瘤膏联合吉非替尼对Lewis荷瘤小鼠模型的抗肿瘤血管生成作用研究[J].临床和实验医学杂志,2018,17(4): 337-340.
[29] 鲁明骞,陆海燕,冯雪松,等.槐耳清膏对乳腺癌MCF-7细胞裸鼠移植瘤的抑制作用及其与调控miR-126表达的关系[J].东南大学学报(医学版),2019,38(2):328-332.

