尿苷二磷酸葡萄糖苷酸转移酶1A1基因多态性与伊立替康治疗小细胞肺癌不良反应及疗效的关系
杨科,郝学志,杜斌,滕菲,乔英凯,郭小花,曹素焕
1北京市朝阳区桓兴肿瘤医院肿瘤科,北京100065
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021
小细胞肺癌属于肺癌的一种类型,约占肺癌发病率的15%,虽然小细胞肺癌的发病率较非小细胞肺癌低,但由于其侵袭力高、生长迅速、易复发等特点,导致患者总体预后较差[1-2]。相对而言,小细胞肺癌对化疗较为敏感,所以目前针对小细胞肺癌的治疗仍以化疗为主,化疗是广泛期小细胞肺癌的标准治疗手段。依托泊苷+顺铂(EP)方案自1980年以来逐渐取代既往的环磷酰胺+多柔比星+长春新碱(CAV)方案,成为广泛期小细胞肺癌患者的一线治疗首选方案[3]。通常小细胞肺癌的一线化疗首选方案为EP或依托泊苷+卡铂(CA)方案,其应用较为广泛,但治疗效果并不理想,患者的客观缓解率(objective response rate,ORR)为50%~90%,中位生存时间为7.9个月,5年生存率约为2%[4-5]。由于小细胞肺癌的治疗手段相对单一,新药物缺乏,在过去很长一段时间内,其治疗遇到瓶颈、无新的突破,患者总体预后较差,5年生存率<5%[6-7]。一旦一线治疗患者出现耐药后,大部分患者将要进入二线治疗。拓扑替康是被美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)及美国食品药品管理局(Food and Drug Administration,FDA)同时推荐用于小细胞肺癌的二线标准治疗药物(1类证据)[8]。但由于拓扑替康在临床应用中骨髓抑制的不良反应比较明显,成为限制其在临床中应用的主要原因。在中国,小细胞肺癌的二线及以上化疗方案中,伊立替康联合顺铂方案更多地成为临床中的二线选择。目前国内外多项研究发现,伊立替康联合顺铂方案对于亚洲患者在疗效及总生存期等方面优于EP方案。与此同时,伊立替康联合顺铂方案的使用中迟发性腹泻和骨髓抑制等不良反应较为明显,因此化疗前对其不良反应的预测与评估显得尤为重要[9-11]。尿苷二磷酸葡萄糖苷酸转移酶1A1(uridine diphosphate glucosyltransferase 1A1,UGT1A1)是伊立替康在体内代谢中最重要的酶,其将伊立替康的活性产物7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxycamptothecin,SN38)转变为无活性的糖基化 SN-38(SN-38 glucuronide,SN-38G),而前者既是伊立替康进入体内产生细胞毒杀伤作用的主要物质,也是不良反应发生的原因[12]。因此,UGT1A1基因多态性与伊立替康联合顺铂化疗方案的疗效及不良反应关系密切。本研究纳入72例接受伊立替康联合顺铂方案治疗的小细胞肺癌患者,通过检测UGT1A1*28及UGT1A1*6基因分型,探究UGT1A1*28/6基因多态性与伊立替康治疗小细胞肺癌不良反应及疗效的关系,旨在更好地指导临床用药,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年10月至2019年9月于北京市朝阳区桓兴肿瘤医院接受以伊立替康为基础治疗方案的小细胞肺癌患者。纳入标准:①经组织学或病理学检查确诊为小细胞肺癌;②首次接受以伊立替康为基础的化疗方案;③治疗前接受UGT1A1*28及UGT1A1*6基因检测。排除标准:①合并严重心、肝、肾及造血功能障碍及严重免疫缺陷;②妊娠期或哺乳期妇女;③精神异常。依据纳入和排除标准,本研究共纳入72例患者。其中,男59例,女13例;年龄为32~80岁,平均年龄为(59.69±9.37)岁;临床分期:广泛期67例,局限期5例:治疗周期数:≤2个37例,>2个35例。
1.2 检测及治疗方法
首次治疗前采集患者外周静脉血2 ml,置入抗凝管中,提取基因组DNA,应用聚合酶链反应(polymerase chain reaction,PCR)扩增目的基因片段,采用2%琼脂糖凝胶电泳检测PCR产物,最后采用焦磷酸测序法分析UGT1A1基因多态性。所有小细胞肺癌患者均采用伊立替康联合顺铂治疗,具体方案如下:伊立替康130~150mg/m2,第1、8天;顺铂75 mg/m2,第1~3天,21天为1个周期。所有患者均采取同样的化疗前预处理方式。
1.3 观察指标及评价标准
观察并记录两组患者的不良反应发生情况,包括粒细胞减少、血小板减少、消化系统反应以及腹泻等。依据美国国立癌症研究所不良反应事件通用术语标准(National CancerInstitue-common terminology criteria for adverse events,NCI-CTCAE)4.0版[13]评价不良反应,分为0~4级,其中0级为无症状,1~2级为轻中度,3~4级为重度。依据美国国立癌症研究所制定的实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1 版[14]对患者进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。ORR=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
1.4 统计学方法
采用SPSS 22.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 UGT1A1基因多态性的分布情况
72例患者均检测了UGT1A1*28和UGT1A1*6基因多态性,UGT1A1*28基因型检测结果显示,野生型(TA6/6)57例(79.2%),突变型(TA6/7+TA7/7)15例(20.8%);UGT1A1*6基因型检测结果显示,野生型(G/G)48例(66.7%),突变型(G/A+A/A)24例(33.3%)。其中UGT1A1*28/*6基因双野生型(TA6/6+G/G)33例(45.8%),单野生型(TA6/6或G/G)39例(54.2%),未检测到两个基因位点纯和突变(TA7/7+A/A)同时存在。
2.2 不同临床特征小细胞肺癌患者UGT1A1基因多态性的比较
不同性别、年龄、临床分期、治疗周期数小细胞肺癌患者的UGT1A1*28和UGT1A1*6基因多态性比较,差异均无统计学意义(P>0.05)。(表1)

表1 不同临床特征小细胞肺癌患者的UGT1A1基因多态性( n=72)
2.3 不同UGT1A1基因型小细胞肺癌患者迟发性腹泻和骨髓抑制发生率的比较
UGT1A1*28突变型患者迟发性腹泻和骨髓抑制的发生率均高于UGT1A1*28野生型患者,差异均 有 统 计 学 意 义(χ2=4.197、6.258,P<0.05);UGT1A1*6野生型和突变型患者迟发性腹泻和骨髓抑制的发生率比较,差异均无统计学意义(P>0.05);UGT1A1*28/*6单野生型患者迟发性腹泻和骨髓抑制的发生率均高于UGT1A1*28/*6双野生型患者,差异均有统计学意义(χ2=5.115、6.344,P<0.05)(表2)。UGT1A1*28突变型患者3~4级迟发性腹泻和骨髓抑制的发生率均高于UGT1A1*28野生型患者,差异均有统计学意义(χ2=8.183、6.550,P<0.05);UGT1A1*6野生型和突变型患者3~4级迟发性腹泻和骨髓抑制的发生率比较,差异均无统计学意义(P>0.05);UGT1A1*28/*6单野生型患者3~4级迟发性腹泻和骨髓抑制的发生率均高于UGT1A1*28/*6双野生型患者,差异均有统计学意义(χ2=9.296、6.078,P<0.05)(表3)。
2.4 不同临床特征小细胞肺癌患者临床疗效的比较
72例患者的 ORR为 6.9%(5/72),DCR为55.6%(40/72)。不同性别、年龄、治疗周期数、UGT1A1*28基因型、UGT1A1*6基因型、UGT1A1*28/*6基因型小细胞肺癌患者的ORR和DCR比较,差异均无统计学意义(P>0.05);局限期小细胞肺癌患者的ORR为40.0%,高于广泛期患者的4.5%,差异有统计学意义(P<0.05);不同临床分期小细胞肺癌患者的DCR比较,差异无统计学意义(P>0.05)。(表 4)
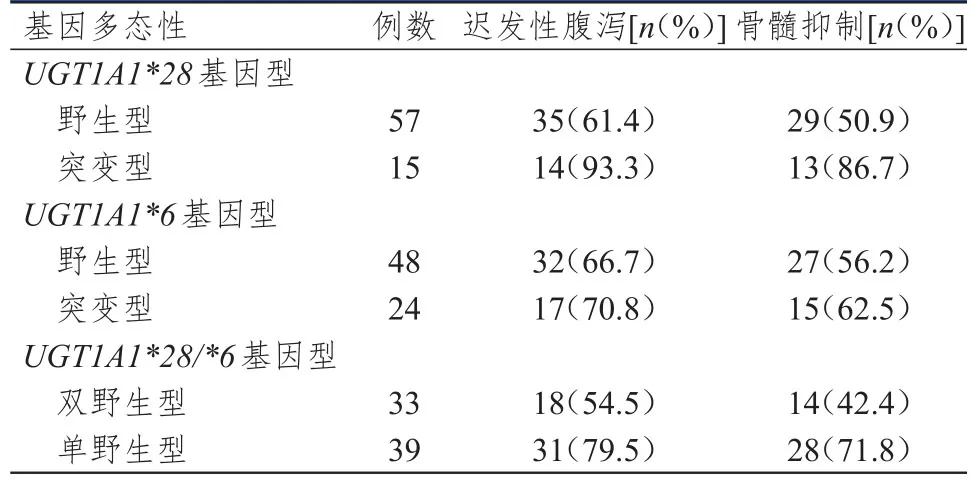
表2 不同UGT1A1基因型小细胞肺癌患者的不良反应发生情况( n=72)

表3 不同UGT1A1基因型小细胞肺癌患者的不良反应分级情况( n=72)

表4 不同临床特征小细胞肺癌患者的临床疗效( n=72)
3 讨论
UGT1A1酶隶属于尿苷二磷酸葡萄糖醛酸转移酶超家族,后者是一种结合在内质网上的膜蛋白,在生物转化代谢方面具有重要作用[15]。UGT1A1酶的编码基因UGT1A1的遗传多样性导致了个体间葡萄糖醛酸化活性的不同,从而使得解毒能力存在差异。研究表明,UGT1A1的遗传多样性表现在不同种族、区域间,其中高加索人群、非洲人群及中东人群UGT1A1*28杂合突变型(TA6/7)与纯和突变型(TA7/7)的比例明显高于东亚各国人群[16],UGT1A1*6突变则为亚洲人群独有[17]。本研究结果显示,72例患者中,UGT1A1*28突变型患者占20.8%,UGT1A1*6突变型患者占33.3%,与既往研究结果一致[18-19]。目前关于UGT1A1基因多态性与化疗不良反应及疗效的关系得到人们的普遍关注,但仍存在争议。Xiao等[18]对67例广泛期小细胞肺癌患者应用以伊立替康为基础的化疗方案进行治疗,并进行UGT1A1*28和UGT1A1*6基因检测,结果显示,迟发性腹泻、中性粒细胞减少及血小板减少与基因突变存在显著的相关性。Massacesi等[20]应用伊立替康联合雷替曲塞治疗56例大肠癌患者,结果发现,UGT1A1*28突变纯合子(TA7/7)是腹泻、呕吐及疲劳的主要预测因素(P<0.01)。但是在一项关于伊立替康治疗复发难治性小细胞肺癌的研究中,并未发现腹泻、中性粒细胞减少及血小板减少等一系列不良反应与UGT1A1*28基因多态性有关[21]。同时一些研究表明,UGT1A1*28与UGT1A1*6两种不同的基因型可能对于不同不良反应的影响不同。李虎等[22]研究发现,UGT1A1*28基因型是迟发性腹泻的独立影响因素(P=0.040),而不是中性粒细胞减少的独立影响因素(P=0.068)。Xu等[23]研究表明,UGT1A1*28基因型和UGT1A1*6基因型对迟发性腹泻的影响高于骨髓抑制,但将两个基因位点结合后对两种不良反应的发生均表现出显著影响。
本研究结果表明,UGT1A1*28基因型与迟发性腹泻及骨髓抑制的发生均有密切的关系,UGT1A1*28突变型(TA6/7+TA7/7)患者迟发性腹泻及骨髓抑制的发生率均高于UGT1A1*28野生型(TA6/6)患者,差异均有统计学意义(P<0.05);同时,UGT1A1*28突变型患者3~4级迟发性腹泻和骨髓抑制的发生率均高于野生型患者,差异均有统计学意义(P<0.05)。然而,UGT1A1*6野生型和突变型患者迟发性腹泻和骨髓抑制的发生率比较,差异均无统计学意义(P>0.05);UGT1A1*6野生型和突变型患者3~4级迟发性腹泻和骨髓抑制的发生率比较,差异亦均无统计学意义(P>0.05)。然而将UGT1A1*28与UGT1A1*6基因结合,UGT1A1*28/*6双野生型(TA6/6+GG)患者迟发性腹泻及骨髓抑制的发生率均高于UGT1A1*28/*6单野生型(TA6/6或G/G)患者,同时,UGT1A1*28/*6双野生型患者3~4级迟发性腹泻和骨髓抑制的发生率均高于UGT1A1*28/*6单野生型患者,差异均有统计学意义(P<0.05)。表明了在进行伊立替康为基础的化疗方案前同时检测UGT1A1*28与UGT1A1*6两个基因位点对于不良反应的预测作用强于只检测一种基因,如二者均为突变型,建议根据患者情况对治疗方案做出适当修改。另外,本研究结果显示,不同UGT1A1*28基因型、UGT1A1*6基因型、UGT1A1*28/*6基因型小细胞肺癌患者的ORR和DCR比较,差异均无统计学意义(P>0.05),这与目前一些相关研究的结论一致[18,24-25]。但本研究并未对剂量进行分层研究,例如对于突变型患者,降低剂量是否可以在不改变药物疗效的情况下减少不良反应的发生,今后还需更深入的探索。
综上所述,对于接受以伊立替康为基础化疗方案治疗的小细胞肺癌患者,UGT1A1*28基因与UGT1A1*6基因位点联合检测对于不良反应及其程度具有一定的预测作用,基因突变型患者迟发性腹泻及骨髓抑制的发生率及严重程度均高于野生型患者,但基因多态性与化疗疗效之间并无明显关系。

