宫内发育迟缓大鼠胰腺骨保护素的表达及其对胰腺发育的影响
唐诗,辛颖
(中国医科大学附属盛京医院小儿内分泌遗传代谢科,沈阳 110004)
宫内发育迟缓 (intrauterine growth retardation,IUGR) 是指胎儿未能达到其遗传基因影响下应有的大小。IUGR可增加成年期发生胰岛素抵抗、2型糖尿病等代谢综合征的风险[1-3],其机制尚不十分清楚。目前普遍被认可的机制是“节俭表型假说”[2],该假说指出胎儿及新生儿早期营养不良会导致胰岛β细胞的发育异常及胰岛功能损伤,这种解剖结构和功能的变化可能导致胰岛素敏感性降低,进而成年后发生2型糖尿病。
骨保护素 (osteoprotegerin,OPG) 是肿瘤坏死因子受体家族的成员,1997年由SIMONET等[4]发现,因具有保护骨的作用而得名。近年的研究[5-8]发现,OPG在人类及大鼠胰岛中均有表达。RIECK等[5]通过芯片筛查发现OPG在怀孕、肥胖和β细胞损伤动物模型中的表达水平均升高,提示OPG与胰岛β细胞之间存在密切的关系。但OPG对胰岛β细胞的具体影响目前仍存在争议[6-8]。
IUGR与OPG相关性的研究鲜有报道,且均集中于血清中OPG水平与IUGR关系的研究[9-11]。临床研究[9-10]表明,出生后1~4 d,IUGR组和健康组母亲和婴儿血清中OPG水平无差异;而动物研究[11]发现,IUGR幼鼠的血清OPG水平显著低于正常幼鼠。目前,尚无针对IUGR个体生长发育过程中胰腺组织中OPG表达情况的研究。本研究拟检测新生至成年期IUGR大鼠胰腺组织中OPG蛋白及mRNA的表达水平,旨在探讨OPG对IUGR大鼠胰腺发育的影响。
1 材料与方法
1.1 建立IUGR大鼠动物模型
将体质量 (body weight,BW) 250~300 g的健康雌性处女Wistar大鼠 (辽宁长生生物技术有限公司)以雌雄比例4︰1与Wistar雄性大鼠合笼。将已受孕的大鼠按照喂养饲料不同随机分成2组:孕期全程低蛋白饮食组 (蛋白含量8%) 和标准饲料饮食组(蛋白含量20%)。低蛋白饮食组母鼠喂养至分娩,得到出生BW低于相应孕周第10百分位数以下的子鼠,即IUGR鼠,作为IUGR组;标准饲料饮食组母鼠喂养至分娩,得到正常子鼠,作为正常对照组 (CON组)。
选择生后第1天、第1周、第3周及第12周作为研究时间点。为了排除雌激素的影响,选择雄性大鼠为研究对象。每个时间点、每组大鼠均为10只。
1.2 HE染色观察胰岛形态
取大鼠胰腺组织,固定并石蜡包埋,制3 μm厚切片。二甲苯及梯度乙醇脱蜡;苏木素染色5 min,自来水冲洗30 min返蓝;伊红复染1.5 min;梯度乙醇脱水,二甲苯透明,中性树脂封片。光镜下观察胰岛形态。
1.3 Ki-67与insulin免疫荧光双染检测胰岛β细胞增殖情况
将石蜡切片依次放入二甲苯及梯度乙醇中脱蜡,Tris-EDTA修复液微波7 min煮沸修复,驴血清室温封闭40 min,加入抗Ki-67抗体 (1︰200,美国Abcam公司) 及抗insulin抗体 (1︰50,中国武汉博士德生物工程有限公司),4 ℃孵育过夜;次日复温后,驴抗小鼠Alexa Fluor 488 (1︰400,美国Abcam公 司) 与驴抗兔Alexa Fluor 594 (1 ︰ 400,美 国Abcam公司) 室温孵育2.5 h,DAPI染核5 min,甘油封片后在免疫荧光共聚焦显微镜 (FV1000S,日本Olympus公司) 下观察并拍照。每组选取5只大鼠,计算各组Ki-67+细胞数/总细胞数。
1.4 Western blotting检测胰腺组织OPG蛋白表达水平
用RIPA裂解液提取大鼠胰腺组织总蛋白,BCA法检测蛋白浓度,调整蛋白浓度并变性。40 μg蛋白上样,10%SDS-PAGE电泳分离蛋白,恒压电泳湿转电转法将蛋白质转移到PVDF膜上,5%脱脂奶粉溶液室温封闭PVDF膜2 h,分别加入兔抗大鼠OPG抗体 (1︰1 000,美国Abcam公司) 和兔抗大鼠GAPDH抗体 (1︰6 000,美国Proteintech公司),4 ℃孵育过夜,山羊抗兔二抗 (1︰5 000,美国Proteintech公司)室温孵育2 h,ECL显色,应用Image J软件进行蛋白灰度分析,以相对灰度值代表蛋白表达量。
1.5 实时PCR检测胰腺组织OPG mRNA表达水平
提取总RNA,应用PCR反转录试剂盒 (日本TaKaRa公司) 逆转录合成cDNA。采用PCR扩增试剂盒 (日本TaKaRa公司) 进行PCR扩增,反应条件为:95℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。PCR引物序列如下:OPG,F 5’-AAGTGGCTGTGCTGTGCACTC-3’,R 5’-CGGTTTCTGGGTCATAATGCAA-3’;GAPDH,F 5’-AGACAGCCGCATCTTCTTGT-3’,R 5’-CTTGCCGTGGGTAGAGTCAT-3’。GAPDH作为内参照基因,表达量用2-ΔΔCt计算。
1.6 ELISA法检测血清胰岛素水平
按照胰岛素ELISA试剂盒 (武汉华美生物有限公司) 说明书操作,96孔板中加入标准品和待测样品,37 ℃孵育2 h,弃液体;加入生物素标记抗体工作液,37 ℃孵育1 h,洗涤;加入辣根过氧化物酶标记亲和素工作液,37 ℃孵育1 h,洗涤;加入底物溶液,37℃避光显色15~30 min;加入终止溶液终止反应;使用酶标仪在450 nm波长依序测量各孔的光密度值。
1.7 胰岛素抵抗指数 (homeostasis model assessmentinsulin resistance index,HOMA-IR) 计算
心脏穿刺取血,用快速生化血糖仪 (拜安捷,德国拜耳公司) 检测各组大鼠空腹血糖 (fasting blood glucose,FPG)。计算HOMA-IR=[空腹胰岛素(fasting insulin,FINS) ×FPG]/22.5。
1.8 统计学分析
2 结果
2.1 宫内营养不良对IUGR子鼠生长及胰腺发育的影响
IUGR组大鼠出生BW明显低于CON组,这种情况一直持续至生后3周,哺乳期后,IUGR组出现生长追赶,至12周时,IUGR组与CON组BW无统计学差异 (P=0.37)。IUGR组大鼠胰腺质量 (pancreas weight,PW) 及胰腺质量/BW比值 (pancreas weight/body weight ratio,PW/BW) 在生后1 d及1、3、12周时均低于CON组,差异有统计学意义 (P< 0.01,P<0.01,P< 0.01,P=0.01)。见表1。
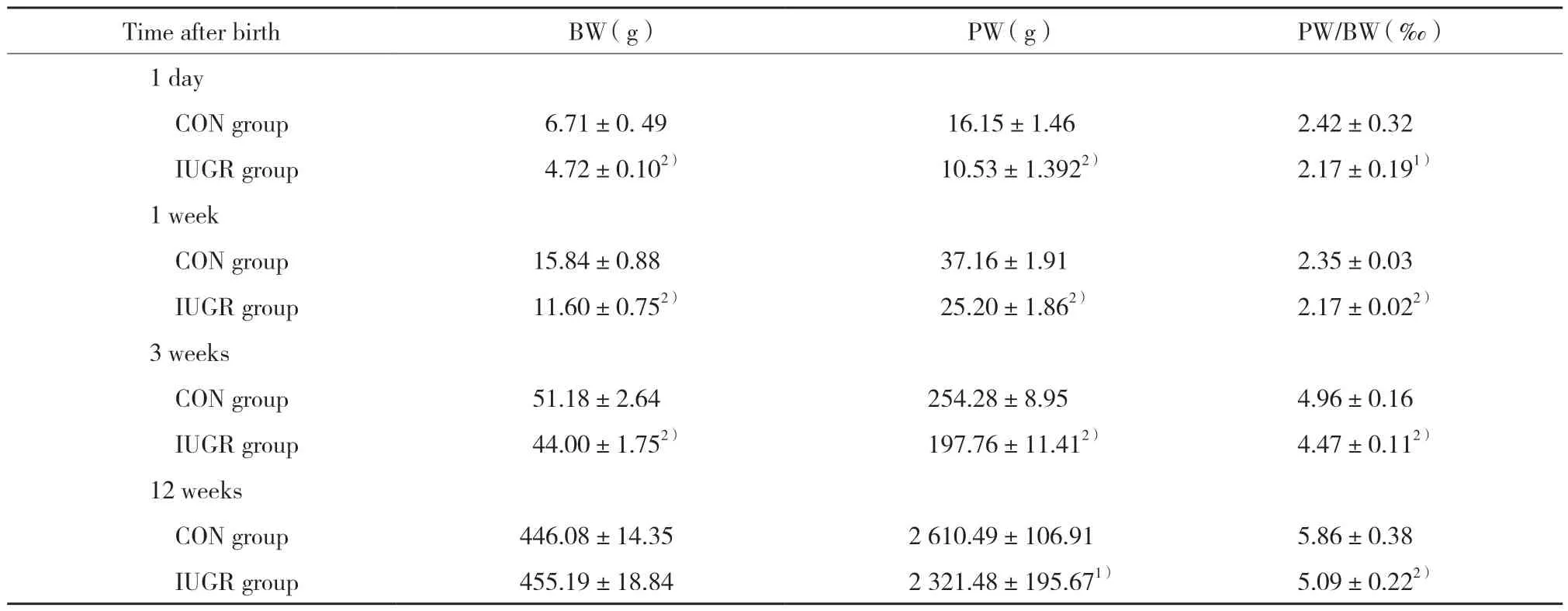
表1 CON组及IUGR组大鼠体质量、胰腺质量比较 (n=6)Tab.1 Comparison of rats’body weight and pancreas weight between CON group and IUGR group (n=6)
HE染色结果显示,与CON组相比,新生IUGR大鼠胰岛组织松散,胰岛面积明显低于对照组。生后1、3、12周时,IUGR组胰岛细胞团体积亦小于CON组。见图1。

图1 CON组和IUGR组胰腺组织HE染色结果 ×400Fig.1 HE staining of rats pancreas in CON and IUGR groups ×400
进一步通过免疫荧光双染的方法测定子鼠胰岛β细胞增殖情况,其中Ki-67和insulin共表达的部分即提示胰岛β细胞增殖。结果表明,在生后1 d及1、3、12周时,IUGR组胰岛β细胞增殖水平明显低于CON组 (P< 0.01)。见图2。
2.2 宫内营养不良对IUGR大鼠胰岛功能的影响
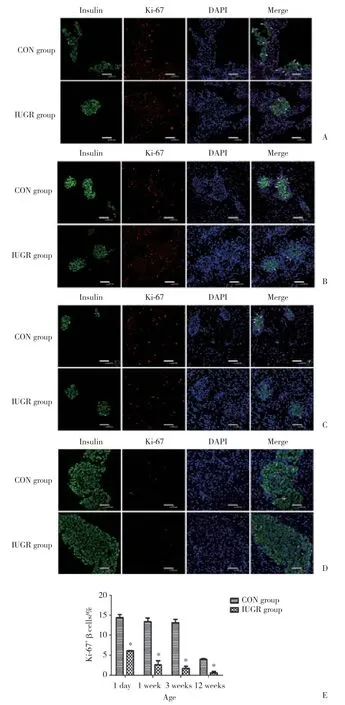
图2 CON组和IUGR组胰腺免疫荧光双染结果 (n=5)Fig.2 Immunofluorescent staining of rats’ pancreas in CON and IUGR groups (n=5)

表2 CON组及IUGR组大鼠空腹血糖、空腹胰岛素及胰岛素抵抗指数比较 (n=6)Tab.2 Comparison of rat fasting blood glucose,fasting insulin and homeostasis model assessment-insulin resistance index between CON group and IUGR group (n=6)
不同时间点2组大鼠FPG、FINS及HOMA-IR的结果如表2所示,出生后1 d、1周、3周时,IUGR组大鼠FPG水平、FINS水平及HOMA-IR与CON组比较无统计学差异。生后12周,IUGR组大鼠FPG水平虽略高于CON组,但无统计学差异;而其FINS水平及HOMAIR显著高于CON组,差异有统计学意义 (P< 0.01)。提示IUGR大鼠在生后12周时存在高胰岛素血症及胰岛素抵抗。
2.3 IUGR大鼠胰腺中OPG蛋白及mRNA的表达情况
Western blotting和实时PCR结果显示,生后1 d及1、3、12周时,IUGR组OPG蛋白及mRNA的表达水平均低于CON组,其中生后1 d及12周的差异尤为显著 (P< 0.01)。见图3、4。
3 讨论
胎盘发育异常、宫内乏氧及宫内营养不良等均会导致胎儿IUGR[12-13]。胎儿期与新生儿早期胰岛β细胞分裂加快、数目增多,这一过程受营养物质的调节,营养物质的数量或质量是保证胰岛β细胞发育的基础。雌性大鼠妊娠期给予低蛋白饮食可使新生大鼠生长发育迟缓,并影响胎鼠胰岛β细胞大小、增殖及功能成熟,造成β细胞缺陷。本研究发现,在生长发育的各个阶段,IUGR大鼠的胰腺发育均较对照组迟缓,表现为胰腺质量低、胰岛细胞团体积减小、胰岛β细胞增殖水平下降。
胰岛β细胞的数量和功能与糖尿病的发生有密切的关系。IUGR个体胰岛β细胞缺陷在2型糖尿病发生中的作用一直受学者关注[14]。临床研究[15-16]也发现,IUGR的患儿在儿童期和成人期会出现胰岛素敏感性下降或胰岛素抵抗。本研究发现,IUGR大鼠在生后12周时出现了高胰岛素血症及胰岛素抵抗。
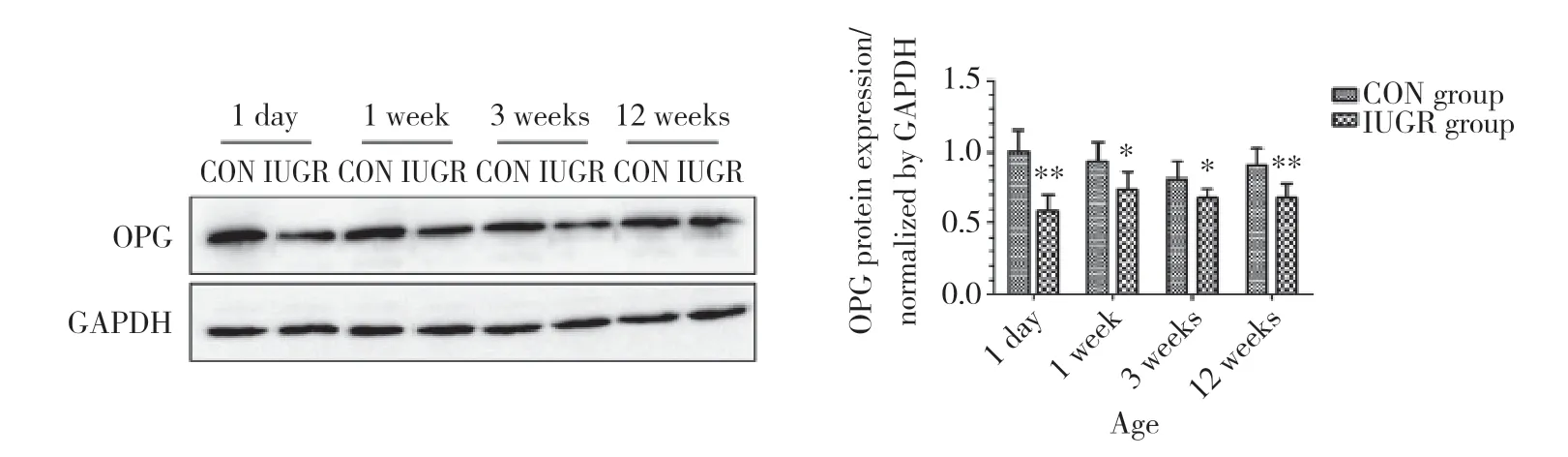
图3 CON组和IUGR组大鼠胰腺组织OPG蛋白表达 (n=6)Fig.3 OPG protein expression in pancreas of rats in CON and IUGR groups (n=6)

图4 CON组和IUGR组大鼠胰腺组织OPG mRNA表达 (n=5)Fig.4 OPG mRNA expression in pancreas of rats in CON and IUGR groups (n=5)
近年来的研究表明,OPG与糖尿病密切相关。2型糖尿病患者血中OPG水平明显高于对照组[17],但机制尚不清楚,可能与胰岛素抵抗的炎症状态有关[18],也可能与糖尿病血管病变有关[19]。OPG及其配体核因子κB受体活化因子配体 (receptor activator of nuclear factor κB ligand,RANKL) 在肝脏中均有表达[20]。RANKL可与核因子κB受体活化因子 (receptor activator of nuclear factor κB,RANK) 结 合,激活核因子κB (factor nuclear facto κB,NF-κB) 及其下游的炎症信号通路,引起肝脏胰岛素抵抗。而OPG做为RANKL的诱饵受体,竞争性地与RANKL结合,阻止NF-κB及其下游信号通路,进而改善糖代谢。这一结论在临床研究[21]中也得到了证实。
研究[6]表明,在胰腺中,白细胞介素1β (interleukin-1β,IL-1β)、肿瘤坏死因子α (tumor necrosis factorα,TNF-α) 可介导OPG的产生,而OPG则通过抑制P38分裂原激活的蛋白激酶 (mitogen activated protein kinases,MAPK) 的磷酸化,使胰岛β细 胞免受损伤,可见OPG具有保护胰岛β细胞的作用。KONDEGOWDA等[7]认为,OPG在催乳素介导的胰岛β细胞再生中起关键的作用,可以促进幼年、老年及糖尿病大鼠胰岛β细胞增殖。而TOFFOLI等[8]则认为OPG可改变胰岛β细胞形态并造成胰岛功能损伤。本研究发现,OPG在正常大鼠及IUGR大鼠胰腺均有表达,但新生儿期 (生后1 d)、幼年期 (生后1周、3周)及成年期 (生后12周) IUGR大鼠胰腺中OPG蛋白及mRNA水平均低于同期正常大鼠。
综上所述,本研究结果表明,IUGR大鼠胰腺中OPG蛋白及mRNA表达水平下降,可能是引起其胰腺发育不良、胰岛β细胞增殖水平下降及成年期胰岛素抵抗的原因之一。

