胆维丁乳对急性肺损伤小鼠肺表面活性物质的影响
李野,李斌超,张雅琳,刘宁,刘祖望,孔娟
(中国医科大学附属盛京医院临床营养科,沈阳 110004)
急性肺损伤 (acute lung injury,ALI) 是肺泡上皮细胞和肺毛细血管内皮细胞受损的急性肺部炎症综合征 (acute respiratory distress syndrome,ARDS)[1],是一种高死亡率的急危重症。通过气管滴注脂多糖(lipopolysaccharides,LPS)可建立ALI 小鼠模型[2]。
肺表面活性物质由Ⅱ型肺泡上皮细胞分泌,主要成分为二棕榈酰卵磷脂和肺表面活性物质结合蛋白 (surfactant protein,SP),分布于肺泡液体分子层表面,能降低肺泡表面张力,维持大小肺泡容量的相对稳定[3],阻止肺泡毛细血管中液体向肺泡内滤出,是治疗ALI的有效手段[4]。目前已知的SP有SP-A、SP-B、SP-C、SP-D 4种。维生素D是一种脂溶性类固醇激素,在钙磷平衡和骨代谢中起重要作用[5-7],并可通过其受体 (vitamin D receptor,VDR) 调控多种生理反应[2,8-16]。研究[17-19]发现,维生素D3能调节Ⅱ型肺泡上皮细胞增殖。胆维丁乳 (cholecalciterol cholesterol emulsion,CCE) 是一种新型的活性维生素D前体,临床上常用于治疗婴幼儿维生素D缺乏性佝偻病。SP在维生素D缺乏小鼠的肺中表达减少[20]。本研究拟探讨CCE对LPS所致ALI肺表面活性物质的影响。
1 材料与方法
1.1 制作动物模型与分组
将36只健康雄性BALB/c小鼠随机分为正常对照组、CCE组、LPS组、LPS+CCE组,每组9只。正常对照组和LPS组给予饮用水,CCE组和LPS+CCE组小鼠给予10%CCE水溶液 (避光,购自中国医科大学附属盛京医院)。饲喂14 d后,LPS 组和LPS+CCE组小鼠行气管切开,滴注LPS (10 mg/kg),24 h后取血清、肺泡灌洗液及肺组织备用。
1.2 检测血清钙、磷的含量
从小鼠心脏取血,分离血清,采用钙测试盒 (带标准) 微板法 (C004-2,南京建成生物工程研究所)、无机磷测试盒 (C006-1,南京建成生物工程研究所)检测各组小鼠血清钙、磷含量。
1.3 测定小鼠肺组织湿/干质量比
取4组小鼠的右下肺,用吸水纸吸干肺组织表面血迹,立即称质量,记为“湿质量”。置于80 ℃恒温干燥箱内烘干,48 h后称质量,记为“干质量”。计算肺湿/干质量比。
1.4 肺组织HE染色
4%多聚甲醛固定肺组织,石蜡包埋并切片,脱蜡,HE染色,封片,光镜下观察并拍照。
1.5 实时PCR
用TRIzol试剂盒 (美国Invitrogen公司) 提取肺组织总RNA,按照产品说明书操作。用生物分光光度计测定RNA浓度和纯度。取2 μg RNA样本,用TaKaRa逆转录试剂盒 (A2302-1,日本TaKaRa公司)进行逆转录合成cDNA,并以此为模板进行PCR扩增反应。逆转录和PCR反应条件按照试剂盒说明书设置。引物由上海生工生物工程公司合成,见表1。
1.6 Western blotting
取肺组织,研磨匀浆后,蛋白裂解,BCA法检测总蛋白浓度。取50 μg总蛋白,行SDS-PAGE电泳,电转至PVDF膜,用5%脱脂奶粉封闭1 h。加入一抗(VDR抗体 1:1 000稀释,购自美国SANTA CRUZ BIOTECHNOLOGY公司;GAPDH抗体 1 ∶5 000稀释,购自美国Proteintech公司),4 ℃孵育过夜。TBST洗3次,室温孵育二抗1 h,ECL显色。Image J图像分析软件对条带进行定量分析比较。

表1 PCR引物序列Tab.1 PCR primer sequence
1.7 绘制生存曲线
另取健康雄性BALB/c小鼠20只,分为LPS组、LPS+CCE组,每组10只,处置同1.1,绘制并分析2组小鼠生存时间曲线。
1.8 统计学分析
采用Graph Pad Prism 5.0软件进行统计学分析,计量结果均采用表示,采用方差分析或配对t检验进行组间比较。P< 0.05为差异有统计学意义。
2 结果
2.1 CCE对ALI模型小鼠血清钙、磷含量的影响
如表2所示,喂饲CCE 2周后,4组小鼠血清钙、磷水平无统计学差异。说明CCE对LPS所致ALI模型小鼠血清钙、磷的影响较小,故可排除血清钙、磷水平的高低对实验结果的干扰。
2.2 CCE对ALI模型小鼠生存时间的影响
如图1所示,LPS+CCE组小鼠平均生存时间长于LPS组,小鼠死亡的首发时间晚于LPS组,给予LPS处理后25 h,LPS+CCE组小鼠仍有80%存活,LPS组则有40%小鼠死亡;53 h以内LPS组小鼠全部死亡,2组小鼠生存时间有显著的统计学差异 (P< 0.05)。表明CCE能显著延长ALI小鼠的生存时间,对ALI起保护作用。
2.3 CCE对ALI模型小鼠肺组织及肺水肿的影响
肉眼观察可见,与正常对照组相比,LPS组小鼠双肺肿胀,体积变大,肺表面可见出血区。光镜下(图2A) 可见,正常对照组与CCE组小鼠肺泡结构完整,肺泡腔和间隙内无炎症细胞浸润;LPS组小鼠肺泡和肺间质广泛充血、水肿、大量炎性渗出液,肺泡腔可见破裂的红细胞和渗出物,肺泡结构紊乱,肺泡腔狭窄,肺泡间隔增厚;与LPS组相比,LPS+CCE组小鼠肺泡和肺间质微血管充血扩张程度及炎症细胞浸润减轻,肺泡腔内红细胞减少。
表2 4组小鼠血清钙、磷含量 (,n=9)Tab.2 Serum calcium and phosphorus contents in 4 groups (,n=9)

表2 4组小鼠血清钙、磷含量 (,n=9)Tab.2 Serum calcium and phosphorus contents in 4 groups (,n=9)
CCE,cholecalciterol cholesterol emulsion;LPS,lipopolysaccharides.
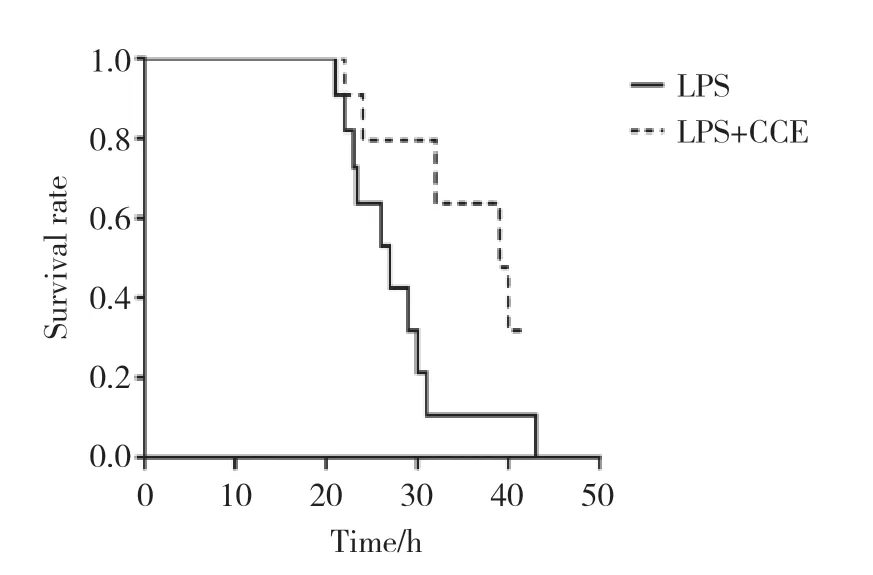
图1 Kaplan-Meier法测定LPS诱导的ALI小鼠生存曲线 (n=10)Fig.1 The survival curve of ALI mice induced by LPS determined by Kaplan-Meier method (n=10)
为了观察ALI时肺泡和肺间质充血、水肿的程度,本研究进一步检测了肺湿/干质量比。结果如图2B所示,LPS组小鼠肺湿/干质量高于正常对照组,差异有统计学意义 (P< 0.01);LPS+CCE组较LPS组显著降低,差异有统计学意义 (P=0.023)。提示CCE能改善ALI肺组织水肿程度。
2.4 CCE对ALI模型小鼠肺中VDR表达的影响
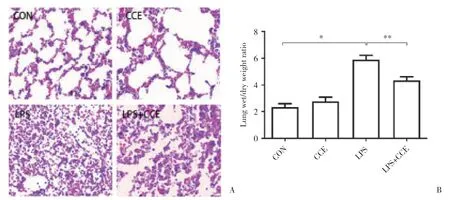
图2 CCE对ALI小鼠肺组织病理变化及水肿程度的影响Fig.2 The effect of CCE on the pathological changes of lung tissue and the degree of edema in ALI mice
Western blotting和实时PCR结果如图3所示,CCE 组小鼠肺组织中VDR蛋白表达水平高于正常对照组,LPS+CCE组VDR蛋白表达水平高于LPS组,差异有统计学意义 (P=0.012,P=0.005)。提示饲喂CCE能增加小鼠肺组织内VDR表达。
2.5 CCE对ALI模型小鼠肺组织SP-A、SP-B、SP-C、SP-D mRNA表达的影响
如表3所示,CCE小鼠肺组织SP-A、SP-C和SP-D的表达水平高于正常对照组,差异有统计学意义(P=0.007,P=0.011,P=0.006);与正常对照组相比,LPS组SP-A、SP-B、SP-C、SP-D的表达水平均显著下降 (P=0.006,P=0.016,P=0.001,P=0.001),而LPS+CCE组SP-A、SP-B、SP-C、SP-D的表达水平均较LPS组显著上升 (P=0.001,P=0.049,P=0.001,P=0.042),差异有统计学意义。表明CCE能促进小鼠肺泡中肺表面活性物质的产生。
3 讨论
尽管临床研究[21-22]发现,活性维生素D可影响血清钙磷水平,但本研究结果显示CCE并未影响小鼠的血清钙磷水平,因此排除了血清钙磷对后续实验结果的影响。

图3 小鼠肺组织VDR蛋白及mRNA表达情况Fig.3 Expression of VDR protein and mRNA in the lungs of mice

表3 各组小鼠肺中SP-A、SP-B、SP-C、SP-D mRNA表达水平比较 (n=9)Tab.3 Comparison of the mRNA expression levels of SP-A,SP-B,SP-C and SP-D in the lungs of mice in each group (n=9)
本研究发现,LPS+CCE组小鼠死亡首发时间晚于LPS组,且平均生存时间长于LPS组,提示维生素D前体CCE有显著延长ALI小鼠生存时间的作用,原因可能与维生素D的抗炎特性有关[23-24]。本研究还发现,CCE具有减轻ALI所致肺组织损伤的作用。HE染色显示,LPS组小鼠肺组织可见肺泡上皮细胞及间质水肿、肺泡腔内渗出、充血、炎症细胞浸润等典型ALI病理改变[25],而LPS+CCE组ALI病理改变较LPS组减轻。小鼠肺湿/干质量比能反映ALI所致肺水肿的程度,ALI时肺水肿严重,肺湿/干质量比升高[26]。本研究结果显示,LPS+CCE组肺湿/干质量比较LPS组降低,提示CCE在一定程度上缓解了LPS对小鼠造成的ALI肺水肿。
本研究发现,与正常对照组和LPS组相比,CCE组和LPS+CCE组小鼠肺组织内VDR表达水平显著升高,表明饲喂CCE能使小鼠体内VDR表达增多。研究[27-29]表明,ALI会造成肺泡不稳定、肺泡去复张及相应的组织重塑,肺表面活性物质可降低肺泡表面张力,从而防止低肺容量时发生肺泡塌陷及水肿[30-31],因此增加肺表面活性物质可治疗ALI[4]。维生素D3可加速胎儿肺成熟和Ⅱ型肺泡上皮细胞分化,并增加大鼠肺组织和Ⅱ型肺泡上皮细胞中肺表面活性物质的表达和分泌[32-34]。有研究[35]表明,维生素D3可直接作用于原代培养的Ⅱ型肺泡上皮细胞,诱导SP-BmRNA的产生,故推测维生素D前体CCE对ALI的保护作用有可能是因为增加了肺表面活性物质,因此本研究检测了各组小鼠肺组织中SP-A、SP-B、SP-C、SP-D的表达情况,结果证实CCE确能增加SP的表达。
综上所述,本研究证实了维生素D前体物质CCE能缓解LPS造成的ALI,改善并延长ALI小鼠的生存时间,改善肺组织病理学变化及肺水肿,增加SP的表达。因此,维生素D前体CCE增加肺表面活性物质可能是缓解ALI的机制之一,为探索ALI治疗方法提供了新的思路。

