伊马替尼-槲皮素共无定型纳米制剂的制备与表征*
王雪,张宝喜,胡堃,龚宁波,吕扬
(北京协和医学院、中国医学科学院药物研究所、晶型药物研究北京市重点实验室,北京 100050)
慢性髓细胞白血病(chronic myeloid leukemia,CML)是一种世界范围内罕见的造血干细胞恶性克隆性疾病,发病率为1~2/10万人口,约占成人白血病的15%[1-2]。CML发病的分子基础是断裂点簇集区-埃希尔森小鼠白血病病毒癌基因同源物(breakpoint cluster region-Abelson murine leukemia viral oncogene homolog,BCR-ABL)融合基因编码的蛋白具有高酪氨酸激酶活性,从而使细胞处于过度增殖且凋亡受阻的状态[3-5]。伊马替尼(imatinib)主要通过竞争性抑制酪氨酸激酶活性从而有效治疗CML,但仍对部分患者治疗效果不佳[6]。近年来,靶向药物联合生物素治疗肿瘤逐渐成为国内外研究的热点[7],国内有研究表明伊马替尼联合槲皮素可协同诱导细胞凋亡[4-5,7],具有较好的开发潜力,但由于伊马替尼和槲皮素的水溶性较差,导致其应用受到限制。为了解决这一难题,采用制备纳米制剂来改善药物溶解性成为第一选择。
纳米药物技术是增加难溶性药物溶解度的有效途径[8]。通过纳米制备技术,药物粒径为纳米级别,表面积显著增大,药物溶解度增加[9]。多项研究表明,纳米包封能增加伊马替尼对癌细胞的疗效,减轻其对心脏的毒副作用[10-11],常见的纳米化技术主要包括反溶剂法、乳化溶剂挥发法、超临界流体法、高压均质法以及喷雾干燥法等[12-13]。笔者在本研究采用加热搅拌法,得到伊马替尼-槲皮素的共无定型物。为提高共无定型物的溶解度,选取聚维酮K30作为稳定剂,联合应用反溶剂沉淀法[14]与冷冻干燥法得到伊马替尼-槲皮素的纳米制剂,并对其进行分析表征和饱和溶解度评价。
1 材料与仪器
1.1仪器 XS-105 型分析天平(瑞士梅特勒-托利多仪器公司,感量:0.01 mg);FDU-1100真空冷冻干燥机(东京理化EYELA公司);D/max-2550型粉末X射线衍射仪(日本Rigaku公司);1/500型差示扫描量热仪(瑞士梅特勒-托利多仪器公司);ZetasizerNano S90型高灵敏纳米粒度分析仪(英国马尔文公司);Spectrum400 型傅里叶红外光谱仪(英国PerkinElmer公司);1200型高相液相色谱仪(美国安捷伦科技有限公司)。
1.2药品与试剂 伊马替尼原料药(武汉远城科技发展有限公司,批号:20190614,含量>98.0%);二水合槲皮素原料药(陕西慧科植物开发有限公司,批号:20080106,含量>98.0%);聚维酮K30(PVP K30,西安天正药用辅料有限公司,批号:20160602,医药项);娃哈哈纯净水、甲醇、乙腈,实验过程中所用溶剂均为色谱纯。
2 方法与结果
2.1伊马替尼-槲皮素共无定型物制备 精密称取伊马替尼原料药493.6 mg,二水合槲皮素原料药338.3 mg,溶解于甲醇溶液30 mL中,在温度为80℃,300 r·min-1条件下加热搅拌至全部溶解,将所得溶液趁热过滤,滤液继续搅拌至溶液挥干,获得亮黄色粉末,即为摩尔比为1:1的伊马替尼-槲皮素共无定型物样品。
2.2伊马替尼-槲皮素纳米制剂制备 实验采用反溶剂沉淀法制备纳米制剂。称取PVPK30原料药40 mg,加入纯化水20 mL溶解,制成稳定剂,将伊马替尼-槲皮素共无定型物样品50 mg溶于甲醇溶液5 mL中,在室温下将稳定剂溶液20 mL在300 r·min-1转速下搅拌,用注射器将伊马替尼-槲皮素共无定型物的甲醇溶液缓慢注入,继续搅拌10 min,获得混悬液。将混悬液滤过后,采用冷冻干燥法除去溶剂后获得黄色粉末状固体,即为伊马替尼-槲皮素纳米制剂。
2.3分析表征实验
2.3.1粉末X射线衍射分析 分别称取伊马替尼-槲皮素物理混合物(以下简称物理混合物)、伊马替尼-槲皮素共无定型物(以下简称共无定型物)、伊马替尼-槲皮素纳米制剂(以下简称纳米制剂)各50 mg,研磨过筛后置于样品架中,采用粉末X射线衍射仪进行分析,结果见图1(A)。共无定型物和纳米制剂的粉末X射线衍射图谱中衍射峰均为弥散峰,晶型状态与物理混合物完全不同,表明制备产物中均为共无定型状态。
2.3.2差示扫描量热分析 采用差示扫描量热仪对物理混合物、共无定型物、纳米制剂3种样品各2.5 mg进行分析,获得3种物质的热分析结果见图1(B)。DSC曲线显示,共无定型物和纳米制剂在两种药物的熔点处均没有吸热峰出现,证实其形成了新的无定型态物质。
2.3.3红外光谱分析 称取物理混合物、共无定型物、纳米制剂3种样品各5 mg,分别采用红外光谱仪进行分析,结果见图1(C)。相比共无定型物(曲线a)和纳米制剂(曲线b),物理混合物(曲线c)中槲皮素的羟基(-OH)在3393 cm-1的伸缩振动特征峰和伊马替尼的氨基(-NH)在3279 cm-1的伸缩振动特征峰均减弱或消失,提示伊马替尼-槲皮素新共晶物质的生成与两个基团形成新的弱相互作用有关。
2.4粒度分析 称取共无定型物和纳米制剂各5 mg,加纯净水稀释后,采用纳米粒度分析仪对两者的粒径进行分析。粒径分析结果见图2。共无定型物平均粒径为(1600.0±20.7)nm,分散指数(PDI)=0.158(曲线a),纳米制剂的平均粒径为(157.3±4.5)nm,PDI=0.135(曲线b),表明伊马替尼-槲皮素形成纳米制剂,且粒度分散均匀。

a.共无定型物;b.纳米制剂;c.物理混合物。
2.5含药量测定
2.5.1高效液相色谱法测定 伊马替尼和槲皮素的标准曲线:分别精密称取伊马替尼和槲皮素原料药各50 mg,置于50 mL量瓶,加入甲醇溶解并定容,制成伊马替尼和槲皮素储备液。精密量取一定量的储备液,加入甲醇稀释配制成浓度分别为1,5,10,25,50,100,200,500,800,1000 μg·mL-1的伊马替尼和槲皮素系列标准溶液。选用流动相为乙腈和0.2%的磷酸水溶液梯度洗脱10 min,检测波长为272 nm,流速为1 mL·min-1,进样量为10 μL。色谱图见图3,伊马替尼和槲皮素的峰形对称性较好,无拖尾现象,出峰时间分别为3.635和8.773 min。记录出峰时间和峰面积,分别以伊马替尼和槲皮素的浓度(C,μg·mL-1)为横坐标,峰面积(A)为纵坐标得到两种原料药的标准曲线。伊马替尼的线性回归方程为A=14.329C+104.64,R2=0.999 1(n=10),槲皮素的线性回归方程为A=15.823C+202.11,R2=0.999 2(n=10)。两者均具有良好的线性关系,可以用于药物含药量的测定和溶解度实验分析。
2.5.2纳米制剂含药量的测定 精密称取纳米制剂5 mg,加甲醇定容至1 mL,采用HPLC法测定药物的峰面积,结果见表1。经过3次重复实验测得纳米制剂中伊马替尼的含药量为20.21%,槲皮素的含药量为3.53%。其中含药量D(%)通过公式(1)计算获得[15]。

表1 纳米制剂中伊马替尼和槲皮素的含药量
D(%)=m(伊马替尼或槲皮素)m总×100%(1)
2.6饱和溶解度的测定 分别称取伊马替尼原料药、槲皮素原料药、共无定型物和纳米制剂各30 mg,加入水5 mL,超声溶解20 min后制成过饱和溶液,置于温度37 ℃的恒温振荡箱中,以100 r·min-1的转速振荡12 h,将得到的溶液用孔径0.22 μm微孔滤膜滤过后,采用HPLC法进行分析,分析方法与测定标准曲线时所用方法一致,结果见表2,纳米制剂中伊马替尼的饱和溶解度为524.3 μg·mL-1,槲皮素的饱和溶解度为113.3 μg·mL-1;共无定型物中伊马替尼的饱和溶解度为38.7 μg·mL-1,未检测到槲皮素;伊马替尼原料药的饱和溶解度为60.1 μg·mL-1,槲皮素原料药未检测到色谱峰。分析结果显示,纳米制剂中伊马替尼的饱和溶解度相比共无定型物和原料药均有显著提高,分别提高13.5倍和8.7倍;纳米制剂中槲皮素的饱和溶解度也有明显改善。
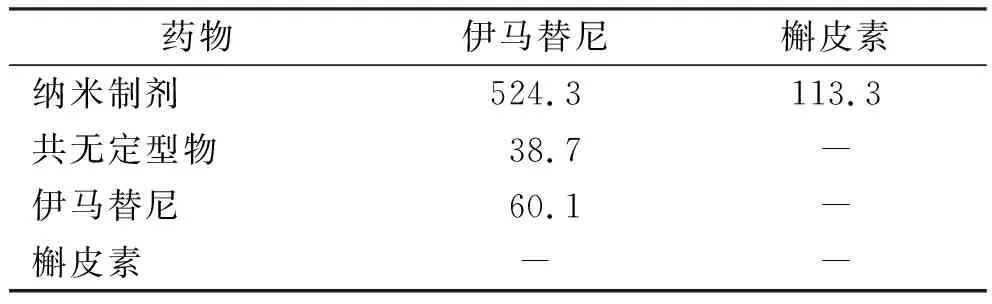
表2 纳米制剂、共无定型物以及原料药的饱和溶解度

a.共无定型物;b.纳米制剂。

A.伊马替尼;B.槲皮素。
3 讨论
本文采用加热搅拌法成功制备获得伊马替尼-槲皮素的共无定型物,为两者联合应用提供共晶物质基础;同时在获得新的共晶物质状态基础上,采用反溶剂沉淀法和冷冻干燥法成功制备获得纳米制剂。与其他伊马替尼-槲皮素的纳米制剂[16]比较,本研究通过冷冻干燥法获得纳米制剂,更能保证物质的纳米状态,从而使伊马替尼和槲皮素的含药量均有显著提高;与共无定型物以及原料药比较,本研究所得纳米制剂具有粒径小、分布均匀、饱和溶解度大等优势;与单一成分伊马替尼或槲皮素纳米制剂相比,作为共晶物质,该纳米制剂中槲皮素可与伊马替尼协同诱导细胞凋亡[4-5],在改善药物理化性质和共晶药物开发等方面具有良好的应用开发前景。研究结果为抗肿瘤药物的共晶物质探索开发和改善成药性研究提供了新思路。

