脾脏调节性树突状细胞腹腔回输对实验性自身免疫性脑脊髓炎小鼠视神经的保护作用及其机制
侯艳丽,杜然,刘庆阳,王艳玲
1 首都医科大学附属北京友谊医院,北京100050;2 应急总医院
视神经炎是指发生于视神经的炎症性疾病,也是一种常见的致盲性眼病,常常会引起急性或亚急性视力丧失。视神经炎按病因可分为特发性视神经炎、感染性或感染相关性视神经炎、自身免疫性视神经病和其他无法归类的视神经炎4类,在特发性视神经炎中以多发性硬化相关性视神经炎(MSON)最为典型。实验性自身免疫性脑脊髓炎(EAE)是一种CD4+T细胞介导的自身免疫性疾病,因其发生于动物中枢神经系统内,在临床表现、病理特征及免疫学特性等方面与人类多发性硬化(MS)极为相似,是研究MS的经典动物模型[1,2]。Horstmann等[3]研究发现,EAE模型动物视神经可出现炎症细胞浸润、髓鞘脱失、轴突损害及神经节细胞凋亡等病理改变。因此,EAE也是研究MSON的理想动物模型。树突状细胞(DC)是MS发病过程中极其重要的专职抗原提呈细胞。CD11c-CD45RBhighDC是新发现的,以CD11c-、CD45RBhigh为特征的DC亚群,通过负向调控维持机体免疫平衡[4]。我们前期研究发现,CD11c-CD45RBhighDC的免疫耐受作用具有转移性,小鼠腹膜注射CD11c-CD45RBhighDC能够抑制热损伤导致的炎症细胞浸润,进而减少炎症细胞因子产生[5,6]。由此推测,CD11c-CD45RBhighDC有可能通过减少促炎症细胞因子分泌,减轻MSON的炎症细胞浸润,从而缓解视神经脱髓鞘损伤。2018年10月~2019年6月,本研究观察了CD11c-CD45RBhighDC腹腔回输对EAE小鼠视神经的保护作用,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 雄性C57BL/6小鼠100只,SPF级,6~8周龄,体质量19~21 g,购自中国医学科学院北京实验动物中心,动物许可证号:SCXK(京)2007-0001。髓鞘少突胶质细胞糖蛋白35-55(MOG35-55),纯度≥98%,购自上海强耀生物科技有限公司。MiniMACS磁化细胞分选仪,购自德国Mihenyi Biotec公司。流式细胞仪、阴选试剂盒,购自美国BD公司。完全弗氏佐剂(CFA)、百日咳毒素,购自美国Sigma公司。
1.2 脾脏CD11c-CD45RBhighDC分离、培养与鉴定 随机选择C57BL/6小鼠50只,无菌条件下摘取脾脏,置于预先加入足够胶原酶D溶液的6 cm培养皿中,用1 mL注射器将胶原酶D溶液注入脾脏,使脾脏充分充盈,然后将脾脏剪碎,37 ℃孵育30 min,充分研磨后制成细胞悬液。在离心管中依次加入小鼠淋巴细胞分离液、细胞悬液,离心15 min,吸取中层絮状物,加入4倍缓冲液重悬,离心去除多余淋巴细胞分离液,所得细胞即为单个核细胞。按阴选试剂盒说明分选获得DC,经抗CD45RB磁珠阳选获得CD45RBhighDC,剪切掉细胞上的磁珠,再加入抗小鼠CD11c磁珠,MS磁性分离柱阴选部分即本实验所需要的CD11c-CD45RBhighDC。将CD11c-CD45RBhighDC置于含10% FBS的RPMI 1640培养液培养约2 h,缓冲液洗涤,1 200 r/min离心7 min,弃上清,留取沉淀。取部分沉淀,分别加入标染的抗CD11c单克隆抗体-别藻蓝蛋白和抗CD45RB单克隆抗体-藻红蛋白染色。染色满意后,上流式细胞仪鉴定。
1.3 动物分组处理 将剩余C57BL/6小鼠适应性饲养7 d,随机分为对照组、模型组及低、中、高剂量组,每组10只。对照组常规饲养,不建模;模型组及低、中、高剂量组于背部皮下注射0.2 mL油包水抗原乳剂(2 mg/mL MOG35-55与CFA等体积混合),第2、3天分别腹腔注射0.2 mL百日咳毒素,制备EAE模型。低、中、高剂量组皮下注射当日分别腹腔回输CD11c-CD45RBhighDC 1×105、5×105、10×105个/只,对照组与模型组同期腹腔注射等量PBS。
1.4 神经功能观察 模型组及低、中、高剂量组建模当日开始,每日由两名研究员采用盲法观察小鼠神经功能,按照Kono等[7]方法进行神经症状评分,连续观察15 d。对照组同期按相同方法评价神经功能。神经症状评分标准:无任何临床表现,计0分;精神萎靡,尾部无力,计1分;行走步态异常,双后肢无力,计2分;双后肢瘫痪,计3分;双后肢瘫痪伴一侧或双侧前肢瘫痪,计4分;濒死或死亡,计5分。
1.5 血浆IL-6、TNF-α、IL-4和CD4+T细胞计数检测 模型组及低、中、高剂量组建模第1~3、7、15天,对照组同期,取尾静脉血0.2 mL,肝素抗凝,4 ℃、1 200 r/min离心10 min,留取上层血浆,-70 ℃保存。采用ELISA法检测血浆IL-6、TNF-α、IL-4,采用流式细胞仪计数CD4+T细胞。所有操作严格按试剂盒说明或仪器规定流程进行。
1.6 视神经组织病理学观察 模型组及低、中、高剂量组建模第15天,对照组同期,尾静脉采血后用2%戊巴比妥钠40 mg/kg腹腔注射麻醉后开胸,剪开左心耳,经左心室/升主动脉依次灌注生理盐水5 mL、预冷的4%多聚甲醛50 mL。自筛板后0.5 mm处取球后视神经组织,常规固定、脱水、透明后石蜡包埋,4 μm厚切片。切片烤片后,脱蜡至水,分别行HE染色、LFB染色,梯度乙醇脱水,二甲苯透明,中性树胶封固,光镜下观察视神经组织病理变化。

2 结果
2.1 CD11c-CD45RBhighDC分离与鉴定 通过磁珠分选仪获取脾脏CD11c-CD45RBhighDC,经流式细胞仪检测,CD11c-CD45RBhighDC纯度>85%。
2.2 各组神经功能观察 连续观察15 d,对照组未出现明显神经功能异常,神经症状评分均为0分。模型组及低、中、高剂量组建模第1~9天均未出现明显神经功能异常,神经症状评分均为0分;建模第10天,模型组及低、中、高剂量组开始出现神经功能异常,神经症状评分的中位数分别为2、1、1、1分;建模第15天,模型组及低、中、高剂量组神经症状评分的中位数分别为3、1、1、1分。模型组建模第10、15天神经症状评分均高于低、中、高剂量组(P均<0.05),而低、中、高剂量组两两比较P均>0.05。
2.3 各组不同时间血浆IL-6、TNF-α、IL-4水平和CD4+T细胞计数比较 见表1。
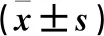
表1 各组不同时间血浆IL-6、TNF-α、IL-4水平和CD4+ T细胞计数比较
2.4 各组视神经组织病理变化 建模第15天,HE染色光镜下可见,对照组视神经横切面呈类圆形,视神经染色均匀,纤维排列整齐、致密,其间有散在的神经胶质细胞,无任何炎症细胞浸润表现;模型组视神经纤维出现曲折或波浪状,排列混乱,部分轴突变性,光轴束网状分层,形成大量液泡;低、中、高剂量组较模型组视神经炎症细胞浸润明显减轻,轴索空泡样变性明显减少,尤其以高剂量组最为明显。LFB染色光镜下可见,对照组视神经髓鞘完整,无液泡变性;模型组视神经出现广泛脱髓鞘和液泡变性;低、中、高剂量组较模型组视神经脱髓鞘和液泡变性明显减轻,尤其以高剂量组最为明显。
3 讨论
MSON是一种自身免疫性疾病,其病因和发病机制至今尚不完全清楚。目前,在临床上普遍采用激素冲击和免疫抑制剂治疗MSON,虽然能够快速提高视觉质量,但因缺乏针对性,不能逆转预后,并且停药后复发率较高[8,9]。国内外一些学者尝试生物制剂,如免疫球蛋白,其治疗MSON的效果亦不理想。脾脏CD11c-CD45RBhighDC是一种调节性DC,在体内不仅可以控制免疫反应,还能维持周围免疫环境的稳定性[10]。2006年Sato等尝试了经腹腔或静脉注射CD11c-CD45RBhighDC来干预脓毒症小鼠预后,结果显示脓毒症病情迅速被控制,小鼠死亡率明显降低,这为CD11c-CD45RBhighDC体内回输治疗相关疾病奠定了基础。
EAE是目前研究MSON的理想动物模型。EAE是一种由MOG35-55诱发的,类似于人类MS的炎症性脱髓鞘疾病,其视神经脱髓鞘改变与MSON相似。有研究认为,EAE小鼠视神经脱髓鞘可能与Th1细胞免疫反应增强、Th2细胞免疫反应减弱导致的Th1/Th2细胞免疫失衡有关[11]。炎症细胞浸润神经组织后可诱导促炎症细胞因子分泌,使周围自身反应性T细胞活化,通过已破坏的血脑屏障渗透至中枢神经系统和视神经,从而产生自身免疫性损伤[12,13]。因此,脾脏CD11c-CD45RBhighDC腹腔回输有可能通过减轻炎症细胞浸润,从而减轻EAE视神经免疫损伤。
本研究提取C57BL/6小鼠脾脏单个核细胞,通过磁珠分选仪获取脾脏CD11c-CD45RBhighDC,经流式细胞仪检测CD11c-CD45RBhighDC纯度>85%。本研究结果显示,连续观察15 d,对照组未出现明显神经功能异常,模型组随着病情进展,开始逐渐出现神经功能异常,而低、中、高剂量组神经功能异常较模型组同期明显减轻。与对照组比较,模型组血浆IL-6、TNF-α水平和CD4+T细胞计数明显升高,其视神经组织中可见明显炎症细胞浸润和脱髓鞘、液泡变性等病理改变,提示EAE模型构建成功。进一步研究发现,低、中、高剂量组血浆IL-6、TNF-α水平和CD4+T细胞计数较模型组明显降低,其视神经组织中炎症细胞浸润和脱髓鞘、液泡变性等病理改变较模型组明显减轻,尤其以高剂量组最为明显。提示脾脏CD11c-CD45RBhighDC腹腔回输能够减轻EAE小鼠视神经免疫损伤,并且其作用效果与剂量有关。CD4+T细胞是EAE发病的效应性细胞,在EAE发病早期活化的CD4+T细胞比例在外周引流淋巴结中开始上调,这种情况一直持续到疾病缓解。本研究脾脏CD11c-CD45RBhighDC腹腔回输后,EAE小鼠CD4+T细胞异常增多被显著抑制,回输的CD11c-CD45RBhighDC数量越多,其抑制作用越明显。与模型组比较,低、中、高剂量组Th1型免疫反应的代表因子TNF-α明显下降,而Th2型免疫反应的代表因子IL-4却在疾病整个过程中无明显变化,表明低、中、高剂量组体内Th1/Th2出现下调。本研究脾脏CD11c-CD45RBhighDC腹腔回输能够明显改善EAE视神经炎症细胞浸润和脱髓鞘改变,其机制可能与以下4个因素有关:①CD11c-CD45RBhighDC表面低表达CD40、CD80和MHC Ⅱ类分子,这些分子的存在使Th1细胞不能被有效激活[14];②CD11c-CD45RBhighDC能够通过分泌IL-10,有效控制下游促炎症细胞因子IL-6、TNF-α的合成和释放,而且IL-10能够抑制抗原提呈作用和诱导1型调节性T细胞分化,以正反馈的方式促进IL-10释放,进一步抑制Th1细胞分泌IL-6、TNF-α[15,16];③CD11c-CD45RBhighDC通过诱导T细胞失能使免疫反应偏移,诱导调节性T细胞形成并促使活化的T细胞凋亡等负性调控免疫反应;④CD11c-CD45RBhighDC抑制CD4+T细胞增多,减少其向中枢神经系统的渗漏。
综上所述,脾脏CD11c-CD45RBhighDC腹腔回输可能通过抑制促炎症细胞因子分泌,减少CD4+T细胞浸润,纠正Th1/Th2细胞平衡紊乱,从而减轻EAE小鼠视神经免疫损伤。本研究可能为MSON临床治疗提供了新的思路。

