Pt、Cu共改性TiO2选择性光催化还原CO2制CH4
李长华,赵江婷,熊 卓,赵永椿
(1.国家能源集团江西发电有限公司,江西 丰城 331100;2.华中科技大学 煤燃烧国家重点实验室,湖北 武汉 430074)
0 引 言
CO2是导致全球变暖的主要温室气体之一。利用太阳能将CO2转化为可再生能源,不仅可减少CO2排放,还可提供有用的能源[1-2]。自1979年Inoue等首次报道了半导体材料光催化还原CO2后,TiO2由于其高稳定性、低成本和低毒性已成为最受欢迎的光催化剂之一[3]。但由于光生电子-空穴对的快速复合和对可见光的有限利用,TiO2表现出较低的光催化反应效率[4]。此外,CO2在TiO2表面的弱吸附也限制了CO2光催化还原的效率。
为了提高TiO2光催化还原CO2的效率,近年来报道了制备具有不同结构或形态的TiO2[5]、用贵金属改性TiO2[6],以及将TiO2与其他材料复合[7]等方法。文献[8]研究表明,{101}和{001}双晶面暴露的TiO2纳米晶体显示出较强的CO2光催化还原活性,这是由于其促进了光生电荷分别向TiO2的不同晶面转移,形成光生电荷空间分离,从而抑制了光生电子和空穴的复合。但同时,大部分方法也促进了水分解产生H2,使反应选择性仍较差。
Xie等[9]研究发现,MgO可增强CO2的化学吸附能力,Pt可提高催化剂的局部电子密度,因此Pt-MgO/TiO2提高了CO2光催化还原制CH4的选择性。Zhai等[10]制备了Pt@Cu2O/TiO2核壳结构的催化剂,发现其在抑制水还原为H2的同时,促进了CO2的还原。Zhao等[11]发现,在TiO2中引入Ag助催化剂后,H2和CO产率显著增加。Varghese等[12]发现,Cu助催化剂有利于CO2的还原且不利于产氢。助催化剂不仅能改变TiO2光催化CO2还原效率,还会影响产物的选择性。合理设计助催化剂,使CO2选择性还原为特定产物仍极具挑战性。
本文采用溶剂热法制备了{101}和{001}双晶面暴露的锐钛矿型TiO2纳米晶体,并将Pt和Cu2O纳米颗粒沉积在TiO2晶体表面,系统研究了Pt、Cu助催化剂对光催化CO2还原性能和产物选择性的影响,提出了可能的催化反应机理,为高选择性CO2还原光催化剂的设计提供了新思路。
1 试 验
1.1 催化剂制备
采用溶剂热法制备双晶面暴露TiO2纳米晶体。将不同含量的氢氟酸和10 mL钛酸丁酯滴入搅拌中的90 mL乙醇中,充分搅拌后,在200 mL水热反应釜中进行水热反应,反应温度180 ℃,时间24 h。用去离子水和无水乙醇先后清洗反应得到的样品各3次,并用转速为3 000 r/min 的离心分离机分离样品15 min,将得到的浅蓝色沉淀置于70 ℃烘箱内干燥12 h。为了去除样品表面的氟离子,在500 ℃的马弗炉里煅烧干燥后的样品2 h。
采用化学还原法将Pt及Cu2O纳米颗粒沉积在TiO2表面。将0.1 g TiO2粉末分散在100 mL处于磁力搅拌状态的去离子水中,然后加入一定量氯铂酸和乙酸铜(金属/TiO2质量比均为1%),搅拌30 min后,逐滴加入2.5 mL NaBH4和NaOH的混合溶液,其中NaBH4浓度为0.1 mol/L,NaOH浓度为0.5 mol/L。待溶液变色后,继续搅拌1 h,用转速为3 000 r/min 的离心分离机分离样品15 min,在离心分离过程中用去离子水对样品进行清洗,离心得到的样品放入70 ℃烘箱内干燥12 h。干燥后的样品即为Pt、Cu共沉积的TiO2纳米晶体。作为对照,其他条件不变,仅加入氯铂酸或乙酸铜,分别合成Pt沉积TiO2晶体和Cu沉积TiO2晶体。
1.2 催化剂表征
晶体结构:荷兰PANalytical B.V.公司的X’Pert PROX型X射线衍射仪。
比表面积:氮气吸脱附法(美国Micrometrics公司的ASAP 2020型比表面与孔径分析仪)。
样品内部微观结构:荷兰FEI公司的Tecnai G2 F30 场发射透射电子显微镜。
表面元素的化学形态:日本岛津-Kratos公司的AXIS-ULTRA DLD光电子能谱仪。
光致发光光谱:法国Horiba JobinYvon公司LabRAM HR800型激光共焦拉曼光谱仪。
催化剂的CO2吸附特性采用CO2程序升温脱附法。将50 mg样品放入石英管反应器中,在高纯氦气气氛(30 mL/min)下加热至300 ℃并稳定30 min,升温速率为25 ℃/min。将催化剂冷却至30 ℃,气氛切换为CO2,通气30 min,再用氦气(30 mL/min)吹扫催化剂30 min。在氦气气氛(30 mL/min)下,以10 ℃/min的升温速率将反应管温度升至750 ℃进行程序升温脱附分析,反应器排出的CO2量通过TCD检测器分析。
1.3 光催化还原CO2
CO2光催化还原反应系统如图1所示,反应器顶部为石英玻璃,在反应器上方约10 cm处放置作为光源的氙灯,在反应器底部加入10 mL去离子水,距液面2 cm处放置一个装有20 mg催化剂的培养皿。光照前,用真空泵抽净反应器中的空气后,向反应器内通入高纯CO2(99.999%)。光照开始后,反应温度通过循环冷却水维持在20 ℃,反应器内气体总压力为71 kPa,其中水蒸气分压为2.3 kPa。每隔15 min采用气相色谱(GC)对反应器中的产物浓度进行分析。该气相色谱配有氢离子火焰检测器(FID)、热导检测器(TCD)及甲烷转化炉。样品气中H2、O2和N2浓度通过TCD检测器检测,CH4和CO浓度由FID检测器分析。
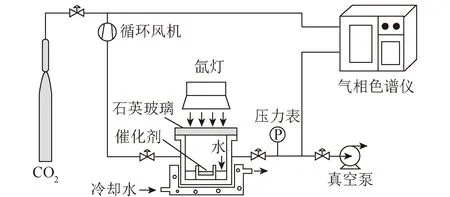
图1 CO2光催化还原反应系统Fig.1 Reaction system of CO2 photocatalytic reduction
2 试验结果与讨论
2.1 催化剂表征
图2为所制备样品的XRD谱图。可知,TiO2为锐钛矿型,未观察到Pt或Cu的衍射峰,这可能是由于金属物种在TiO2晶体表面的负载量低所致[13]。此外,沉积了Pt和Cu样品的峰值与TiO2相比没有明显变化,说明2种金属物种的沉积对锐钛矿型TiO2的晶体结构无明显影响。采用N2吸附法对催化剂比表面特性进行分析。表1为样品的比表面积、孔容和孔径,可以看出,所有样品的BET比表面积几乎相同(约为165 m2/g),表明金属纳米颗粒沉积对TiO2纳米晶体的比表面积、孔径和孔结构几乎无影响。
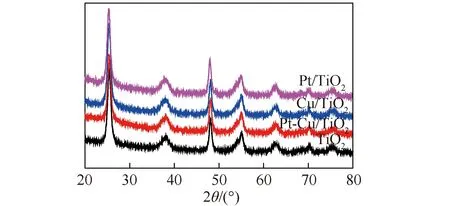
图2 催化剂样品XRD谱图Fig.2 XRD patterns of the catalysts
催化剂样品的TEM和HR-TEM图如图3所示。纯TiO2纳米晶体为纳米片,TiO2纳米晶体的边长和厚度约为50、20 nm。图3(b)中,TiO2纳米晶体表面有许多小黑点,根据晶面间距,这些黑点为Pt纳米颗粒[14]。图3(c)中,TiO2纳米晶体清晰可见,但很难看到含Cu颗粒,这可能是由于Cu物质尺寸小,且结晶度低的缘故。在高分辨率的TEM图中,可清楚观察到沉积在表面上的Cu氧化物纳米颗粒,根据图3(c)中的晶面间距,推断其为Cu2O纳米颗粒。图3(d)中可清晰看到Pt和Cu2O纳米颗粒同时沉积在TiO2晶体表面。

图3 TiO2、 Pt/TiO2、 Cu/TiO2和Pt-Cu/TiO2 样品TEM和HR-TEM图Fig.3 TEM and HR-TEM images of TiO2,Pt/TiO2,Cu/TiO2,and Pt-Cu/TiO2 catalysts
图4为光催化剂的Pt 4f和Cu 2p的XPS谱图。由图4(a)可知,Pt 4f区域包含2个峰,可分为2对XPS峰,分别为Pt0峰(70.6 eV和74.1 eV)和Pt2+峰(71.4 eV和75.5 eV)[15],这是由于制备过程中Pt 纳米颗粒表面被氧化产生少量Pt2+[16-17]。共沉积后Pt 4f的束缚能几乎不变,表明共沉积Cu对Pt上的电子密度无明显影响。由图4(b)可知,Cu/TiO2样品的Cu 2p3/2束缚能约为932.5 eV,表明Cu2O是Cu的主要存在形式[18],这与TEM分析结果一致。与Cu/TiO2催化剂的峰位置相比,Pt-Cu/TiO2催化剂的Cu 2p峰略向低能级方向移动,说明共沉积Pt可提高Cu2O纳米颗粒上的电子密度,因为Pt的引入促进了电子向Cu2O纳米颗粒移动,有利于CO2还原为CH4的多电子还原反应过程进行。
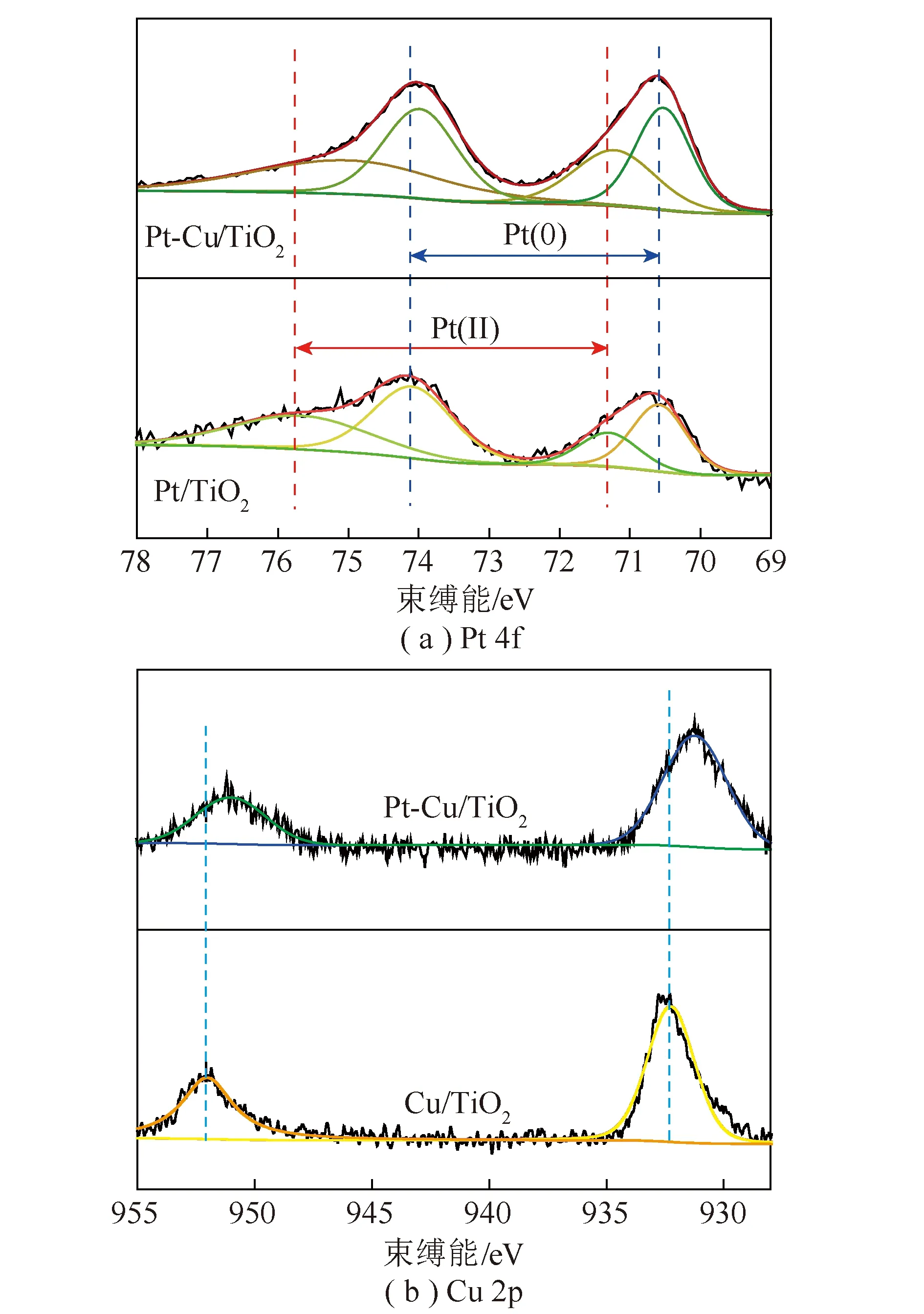
图4 光催化剂的Pt 4f和Cu 2p的XPS谱图Fig.4 XPS spectra of high-resolutionPt 4f and high-resolution Cu 2p
催化剂的PL谱如图5所示,除强度不同外,4种催化剂的荧光光谱图相似。一般来说,荧光强度随着光生电子-空穴复合的减少而下降[19],因此PL谱常被当作光生电子-空穴复合被抑制的直接证据。由图5可知,TiO2的PL谱强度最大,Pt和Cu2O纳米颗粒在TiO2纳米晶体上的沉积均使TiO2纳米晶体的PL谱强度减弱,说明光生电子和空穴的复合受到不同程度的抑制,这是因为沉积在TiO2晶体上的Pt和Cu2O纳米颗粒可轻易地捕获光生电子,有利于光生电子和空穴发生空间分离。Pt/TiO2的PL强度较低,说明Pt纳米颗粒比Cu2O纳米颗粒更能有效抑制光生电荷的复合。Pt-Cu/TiO2具有最低的PL强度,说明Pt、Cu2O可有效促进光生电荷分离,可能有助于提高Pt-Cu/TiO2的光催化活性。
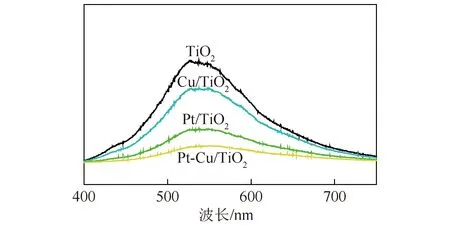
图5 催化剂样品的PL谱图Fig.5 Photoluminescence spectra of the catalysts
2.2 CO2光催化还原
图6为不同催化剂光催化还原CO2的H2、CO和CH4的产量,随着反应进行,光催化还原CO2的产量逐渐累积。沉积Cu2O后,几乎无H2产生;沉积Pt和Cu2O均不利于CO生成;沉积Pt和Cu2O有利于CH4生成。图7为3种产物的产率和产物选择性。与纯TiO2相比,Pt/TiO2显著提高了H2和CH4产量,同时抑制了CO生成,这主要是因为光生电子-空穴复合被有效抑制,从而有利于多电子反应,高选择性生成CH4。与Pt不同,Cu2O促进CH4的生成,但抑制H2和CO的生成,且Cu/TiO2催化下的CH4产率低于Pt/TiO2,这是因为Cu/TiO2具有相对较高的电子空穴复合速率。另外,Pt更倾向于活化H2O,而Cu2O倾向于还原CO2。对于共沉积Pt-Cu/TiO2催化剂,在Pt和Cu2O共同作用下,H2和CO的生成均受到有效抑制,CO2高选择性地转化为CH4,选择性达96.6%。
图8为Pt-Cu/TiO2催化剂的循环性能。第1次循环后,收集反应后的Pt-Cu/TiO2催化剂,依次重复试验[20]。由图8可以看到,在反应初期,第2次和第3次的CH4产率高于第1次,这可能是因为在第1次反应结束后,部分产物没有完全脱附,第2次循环反应时,开灯瞬间,温度升高,有利于产物脱附。但总体上,第2次和第3次循环中的CH4和CO产率与第1次循环相似,说明在催化反应中Pt-Cu/TiO2起到了催化作用。从图8还可以看出,该反应条件下,Pt-Cu/TiO2催化剂的循环性能良好。
2.3 反应机理
为了研究Pt和Cu2O纳米颗粒对催化剂CO2吸附的影响,对催化剂样品进行TPD-CO2测试,结果如图9所示。129 ℃时,纯TiO2上的CO2发生脱附。沉积Pt后,CO2的脱附峰向低温方向略有移动,说明Pt对CO2的吸附影响不明显。沉积Cu2O后,CO2的吸附位点发生变化,且脱附需要更高的温度(148、374、500 ℃),说明沉积Cu2O使TiO2和CO2的结合更为紧密,这可能与铜氧化物呈碱性有关。共沉积Pt、Cu2O时,其CO2脱附峰的温度仍较高,分别为394 ℃和497 ℃,说明Pt、Cu2O共沉积不会使TiO2与CO2的紧密结合减弱,有利于CO2的吸附,不利于水的吸附,从而可抑制H2的产生。

图6 光催化还原反应中H2、CO和CH4产量Fig.6 Production of H2,CO and CH4 of Photocatalytic reduction

图7 光催化活性及产物选择性Fig.7 Photocatalytic activities and selectivities of the catalysts
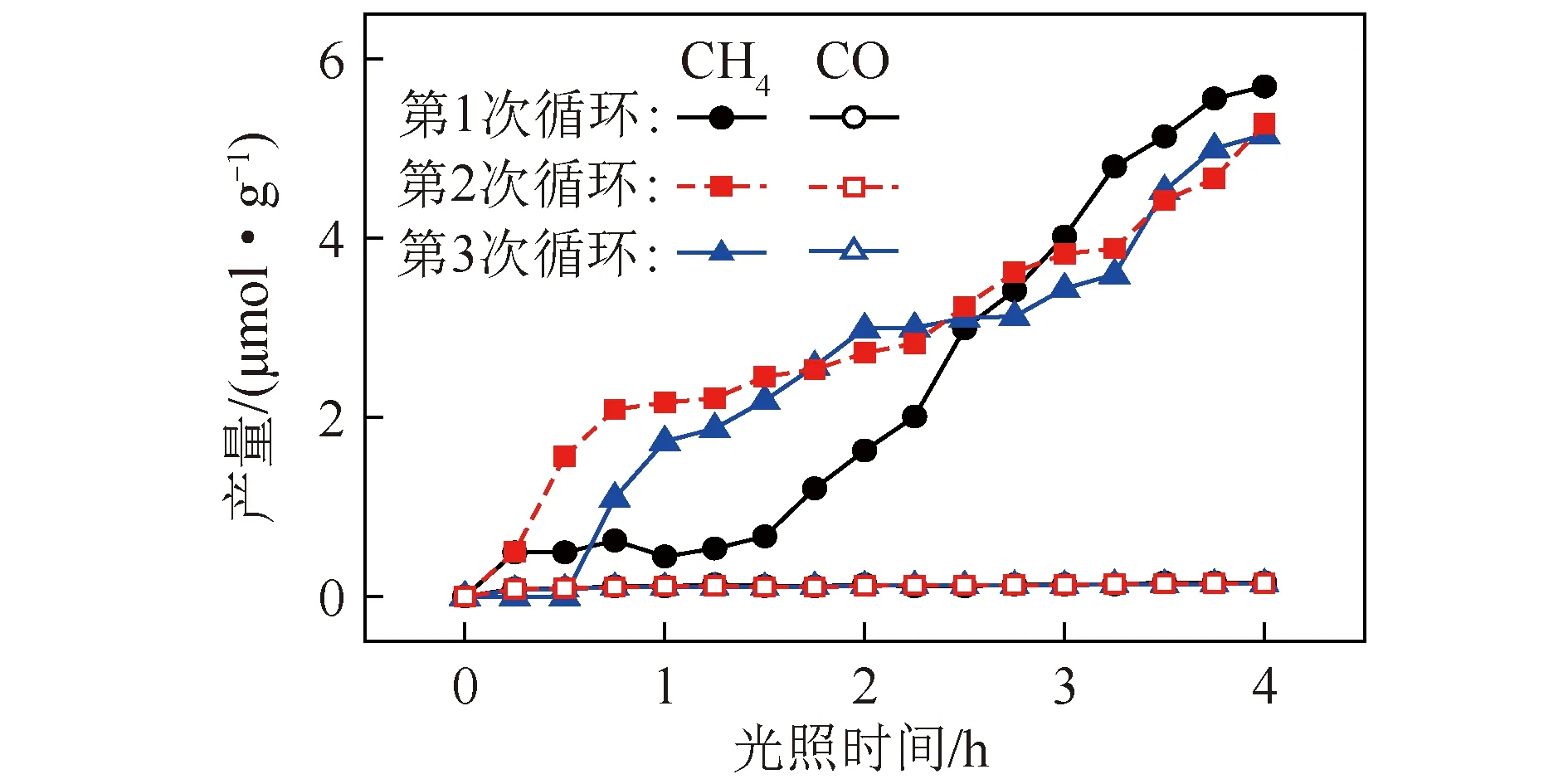
图8 Pt-Cu/TiO2催化剂循环光催化性能Fig.8 Cycle photocatalytic performance of Pt-Cu/TiO2 catalyst
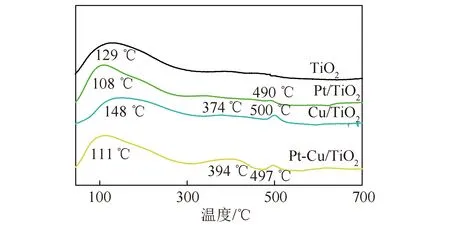
图9 不同催化剂的CO2-TPD结果Fig.9 CO2-TPD profiles for the catalysts
通常,Pt是水还原的活性中心,而Cu2O是CO2还原的活性中心。考虑到助催化剂在光催化反应中可能会发生转化,因此对反应前后的催化剂进行XPS分析,如图10所示。图10(a)中,Pt的化学状态较稳定,因为在反应前后Pt 4f峰的束缚能几乎无变化,结合其光催化活性,可推测在Pt/TiO2中,Pt是CO2和水还原的活性位点。图10(b)中,反应前以Cu2O形式存在,反应后出现零价Cu的峰,这可能是由于Cu2O被捕获的光生电子还原的缘故。图10(c)、(d)表明,反应后的Pt-Cu/TiO2中,Cu2O几乎被完全还原为零价Cu,这可能是因为在光催化反应过程中,Pt沉积可促进光生电子向Cu2O迁移,在还原Cu2O为零价Cu的同时为光催化还原反应提供更多的电子,有利于CH4的选择性生成。

图10 不同催化剂光催化反应前后XPS谱图Fig.10 XPS spectra of the catalyst before and after photocatalytic reaction
3 结 论
1)Pt沉积促进了H2和CH4生成,抑制CO生成,Cu2O沉积有利于CH4生成,抑制H2和CO生成。
2)Pt和Cu2O共沉积在TiO2晶体上时,H2和CO的生成均受到有效抑制,CO2选择性转化为CH4(选择性为96.6%)。这是由于Pt纳米颗粒捕获了光生电子,增加了催化剂上的电子密度。
3)进一步负载Cu2O后,TiO2表面CO2吸附增强,水的吸附被削弱,同时Pt沉积可促进光生电子向Cu2O迁移。
4)在Pt和Cu2O共同作用下,Pt-Cu/TiO2催化剂可将CO2选择性地还原为CH4,经3次循环试验,催化剂的活性未降低,具有良好的稳定性。
——潘桂棠光生的地质情怀

