胸腺增生相关的原发性干燥综合征合并眼肌型重症肌无力1例报告及文献复习
王子燚,郭娇娇,王 猛,于雪凡
原发性干燥综合征(primary Sjǒgren’s syndrome,pSS)是一种不伴其他结缔组织病变的炎性免疫性疾病,该病以淋巴细胞进行性破坏外分泌腺的为特点。pSS累及神经系统患者临床表现复杂多样,但同时合并眼肌型重症肌无力(ocular myasthenia gravis,OMG)少见。现报道1例与胸腺增生相关的pSS合并OMG患者,患者在切除增生的胸腺后症状明显好转,旨在加深临床对自身免疫共性疾病的认识。
1 病例报告
患者,女,65 岁,因“双眼及唇舌干涩1 y,加重伴双睑下垂2 m”于2019年12月22日入院。患者1 y前无诱因出现双眼及唇舌发干,唾液、哭时泪液明显减少,症状进行性加重,吃饭需饮水送服,伴多颗龋齿,无口腔溃疡,无脱发、皮疹;偶有活动后双侧膝关节酸痛。未系统诊治。2 m前出现双眼睑上抬费力,晨轻暮重,视物偶有左右重影。无头痛、头晕,无饮水呛咳,无呼吸困难,精神、睡眠差,大小便如常,近期体重如常。既往否认糖尿病、冠心病、高血压、结核、肝炎病史,否认食物、药物过敏史,无毒物接触史,无烟酒嗜好。查体:血压138/71 mmHg,部分牙齿脱落,可见黑色牙根。心肺腹查体无异常。神清语利,认知水平正常。双侧眼睑下垂(双眼平视时双睑下缘遮挡1/2瞳孔),睁、闭眼力弱,余颅神经未见异常。四肢肌肉无萎缩,未见肌肉束颤及不自主运动。四肢肌力5级。肌张力对称适中。双侧关节运动觉、位置觉、振动觉对称正常。共济试验正常。Romberg征阴性。双侧病理征阴性。无项强,Kernig征阴性。辅助检查:眼肌疲劳试验阳性。新斯的明试验阳性。重复神经电刺激可见低频递减:左侧眼轮匝肌 5 Hz衰减 19%,右侧眼轮匝肌 5 Hz衰减 17%。肺CT示双肺下叶炎性改变。胸腺CT+二期增强示:胸腺区略饱满伴多发小结节,考虑淋巴节可能(见图1)。Schirmer 实验阳性。泪膜破裂时间左4.5 s,右4.8 s。腮腺超声:双侧腮腺实质弥漫性病变。唇腺活检(见图2)见淋巴细胞浸润灶>1个灶。血清抗乙酰胆碱受体抗体阳性。抗核抗体(ANA):抗SSA-60,抗SSB,颗粒型 1∶3200阳性,抗核糖核蛋白抗体测定 +,抗SSA-52/Ro52;类风湿因子(RF)升高(22.10 IU/ML);血清学重症肌无力相关抗体:乙酰胆碱相关抗体(Ach-R)(+)。抗ds-DNA 抗体、抗CCP抗体、抗 Sm抗体均为阴性。血常规、凝血常规、肝肾功能、外科综合、风湿三项、免疫五项、甲状腺功能、ANCA、心肌酶、肿瘤标志物、血尿免疫固定电泳均未见明显异常。入院后诊断原发性干燥综合征合并眼肌型重症肌无力。给于溴吡斯的明60 mg,4次/d;甲强龙80 mg静点,1次/d;辅以人工泪液等支持治疗,入院 3 d患者双侧眼裂增宽, 5 d眼干症状有所缓解,7 d双眼睁、闭眼较前有力,但午后仍力弱。出院后按MG规范治疗1 m后唇舌干涩症状好转,但双睑下垂症状改善不明显,遂于我院胸外科行胸腺切除术,术程顺利,病理诊断示(见图3):胸腺组织增生,淋巴结8枚反应性增生。术后规律口服激素80 mg,1次/d,每2 w减4 mg;溴吡斯的明60 mg,4次/d。出院3 m后电话随访,患者双睑上抬有力,无晨轻暮重,已停用溴吡斯的明,双眼及唇舌偶有干涩现象。出院5 m后随访,患者停止口服激素,无眼睑下垂症状,口眼干涩不明显。
2 讨 论
pSS是一种系统性自身免疫性疾病,其特征是唾液腺和泪腺的靶向性炎症,导致大多数患者口干、眼干,少数患者的唾液腺持续或复发性肿大[1]。该例患者出现牙齿脱落,口眼干燥首先出现,结合患者自身免疫相关抗体检测以及唇腺活检,符合pSS诊断标准[2]。部分pSS患者会有肌肉受累的情况,Lindvall等对36例有SS患者肌肉活组织检查发现,72%有炎症表现,证明肌肉疼痛以及纤维肌痛可以是SS患者的继发临床症状[3]。但是合并肌无力少见,独以眼肌型重症肌无力(ocular myasthenia gravis,OMG)为并发症的更为少见。我们报道的患者在有SS症状后10 m又相继出现了晨轻暮重的眼睑下垂,结合肌电图以及血清学抗体检测,符合OMG的诊断。胸腺CT以及增强扫描提示患者存在一定程度的胸腺及淋巴结增生。术后病理证实了胸腺增生的结果。综上,患者诊断为胸腺增生相关的原发性干燥综合征合并眼肌型重症肌无力。小剂量的激素治疗加上胸腺切除后疗效明显。
干燥综合征和重症肌无力均属于自身免疫系统疾病的范畴,两者存在相似的免疫学以及遗传学基础,共同造成了免疫平衡紊乱,从而造成了自身免疫性疾病间的重叠现象。两病同时存在NK细胞以及CD4+、CD25+等调节性T细胞数目或功能下降,进而影响下游炎性因子,如IFN-γ、IL-4等的表达,干预疾病的发生和发展。同时细胞死亡或凋亡碎片清除无效、自抗原修饰、分子拟态等后细胞内抗原的释放,可能触发B细胞活化和多克隆扩增后产生免疫球蛋白。近年来研究学者发现自由光链的产生与SS以及MG患者发病机制密切相关,提示两者存在类似的免疫介导机制[4]。
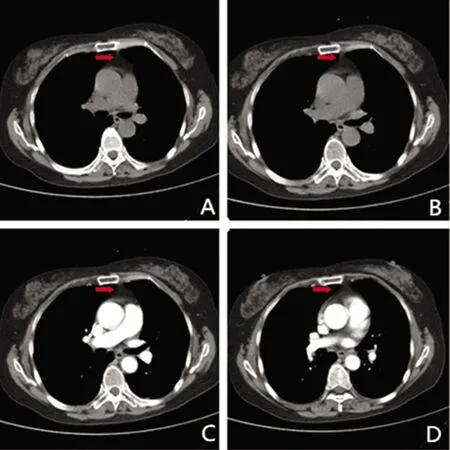
A、B:胸腺核磁平扫;C、D:胸腺核磁增强

镜下所见淋巴细胞浸润灶大于1个灶(HE染色,×200);诊断标准:4 mm2的面积上至少有50个淋巴细胞(1个灶),则为阳性结果
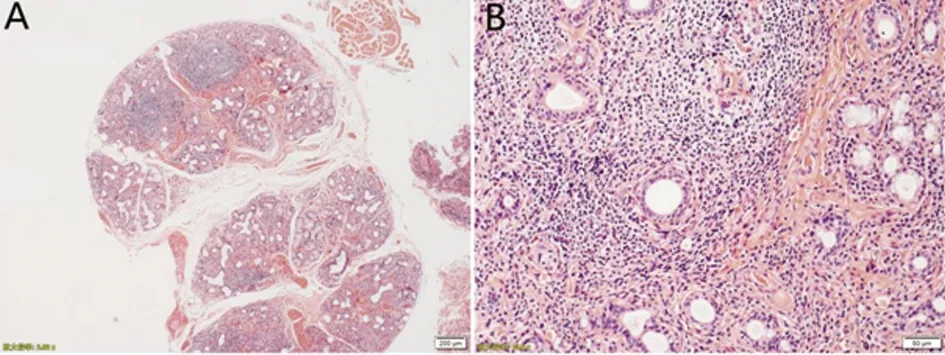
A:低倍镜下可见胸腺大体结构正常(HE染色,×40);B:高倍镜下可见胸腺组织增生,部分淋巴结反应性增生(HE染色,×200)
1913年,Schumacher等描述了胸腺切除术对MG患者的有效性[5]。随后的大量的研究调查了胸腺切除对伴有或不伴有胸腺异常的MG患者的益处,并且表明胸腺切除可以明显改善临床症状和提升胸腺切除后的存活率[6]。现在普遍的做法是建议MG患者切除胸腺从而改善免疫紊乱。对于没有胸腺瘤的患者,对于血清学ACh-R阳性的患者及时的胸腺切除也是必要的,这样可以防止增生组织瘤样改变或者发生恶性转变,并且切断免疫紊乱来源,调节失控的免疫系统。不同于Tsai报道的胸腺瘤合并SS及MG患者[7],本例患者经过病理证实并无胸腺瘤以及恶性改变,预后明显好于胸腺瘤患者。
对于SS患者的重症肌无力治疗,需要注意到溴吡斯的明的使用会对腺体外分泌功能有所干扰,从而重叠SS所导致的干燥症状。已有相关证据表明MG患者的唾液腺被淋巴细胞浸润的频率较高,但未出现症状或功能损害8,因此需要根据病情对胆碱类药物以及激素的剂量加以调整。该例患者胸腺切除后疗效显著,配合小剂量激素治疗好转很快,因此未使用丙球以及免疫抑制剂治疗。但是,对于SS合并MG 的患者进行长期的随访十分必要,因为部分患者在胸腺切除[8]后出现延迟复发的情况并不少见[9]。随着对免疫相关疾病研究的进展,临床上类似的免疫共病愈发多见,相似的临床表现以及检验结果需要警惕,避免漏诊。

