制造过程对可溶性大豆多糖结构和产物起泡性的影响
张 权 陈 洁 曾茂茂 何志勇
(江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
可溶性大豆多糖(soluble soybean polysaccharides,SSPS)是从大豆子叶中提取出来的一种阴离子多糖[1]。工业上一般从脱油、除蛋白后的豆粕中提取SSPS(其含量占豆粕的5%左右),从而实现大豆加工副产物的高效再利用。目前工业上存在多种提取SSPS的方法,包括酸法提取[2]、碱法提取、酶法提取[3]和物理超声法提取[4]等,而不同方法提取的SSPS性质存在着十分显著的差异。
SSPS的结构与果胶相似,果胶由半乳糖醛酸聚糖和鼠李糖半乳糖醛酸聚糖组成的主链以及半乳聚糖和阿拉伯聚糖组成的支链构成,与果胶相比,SSPS的主链相对较短,而侧链较长[5-6]。SSPS具有多种功能特性,包括在酸性条件下稳定蛋白的能力、乳化性、起泡性、成膜性和抗氧化性等性质[7-8]。迄今为止,SSPS在酸性条件下稳定蛋白能力的研究相对比较多,包括SSPS的浓度[9]、酯化度[10]、其与果胶的复配作用以及与其他多糖的协同作用[11]等。由于SSPS具有很低的黏度,使用在酸性含蛋白饮料中会带来清爽的口感,这种特殊性质使SSPS在酸性乳饮料中得以广泛应用[12]。
前人[13]研究结果也显示,SSPS具有良好的表面活性,浓度为4%时其乳化能力甚至高于同浓度的阿拉伯胶。一般认为,SSPS的表面活性主要来自于其结构中的蛋白质,SSPS之所以具有良好的乳化性,是由于SSPS结构中的疏水多肽链能像锚一样吸附在油滴表面,亲水的多糖结构铺展在油滴表面形成带电的吸附层从而防止油滴互相聚集[10]。然而影响SSPS的表面活性的因素,相对于其在酸性条件下稳定蛋白的能力而言,相对研究得较少,尤其是SSPS的单糖组成、主链中的蛋白质含量、分子量、分子量分布以及酯化度等结构要素对于其表面活性的影响研究甚少。
目前,含气泡的苏打饮料或乳酸菌蛋白饮料逐渐兴起,而SSPS由于兼具良好的起泡性和较低的黏度,极具应用潜力[14]。作为一个有效的起泡剂,其结构应满足下列基本要求:具有合适的亲水亲油结构;能快速吸附到气—水界面;吸附到界面的蛋白质分子可以相互作用形成具有一定机械强度和良好黏弹性的界面膜[15]。从SSPS的结构分析,影响其表面活性的结构特征主要包括分子量、酯化度以及SSPS中的蛋白含量。试验旨在通过控制酸水解、碱性脱酯和蛋白酶解条件获得不同分子量、酯化度和蛋白含量的SSPS,并同步测定产物的起泡性,从而探究加工对于SSPS的结构以及产物起泡性的影响,进而为工业生产出高起泡性的SSPS提供指导依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
大豆纤维:大豆纤维的蛋白含量19.17%,总膳食纤维含量60%,水分含量7.85%,灰分2.44%,平顶山金晶生物科技股份有限公司;
右旋糖酐分子量标准品套装:5.25,13.05,64.65,135.35,300.60,2 000.00 kDa,中国食品药品检定研究院;
盐酸、氢氧化钠、95%乙醇:分析级,国药集团化学试剂有限公司;
试验用水:去离子水(自制)。
1.1.2 仪器与设备
可见分光光度计:UV-5300PC型,上海元析仪器有限公司;
高效液相色谱系统:WATERS 2695型,美国Waters公司;
凝胶色谱柱:TSK-gel G5000PWXL型,日本TOSOH公司;
高效液相色谱仪:WATERS 600型,美国Waters公司;
自动凯氏定氮仪:KDN-103F型,上海纤检仪器有限公司;
超声波清洗机:SB-5200型,宁波新芝生物科技股份有限公司;
冷冻离心机:3K15型,德国Sigma公司;
恒温干燥箱:HY300型,上海一恒科技有限公司;
振荡水浴锅:SHZ-82型,金坛市新航仪器厂;
实验室pH计:FE20型,梅特勒—托利多仪器(上海)有限公司;
电子分析天平:AL104型,梅特勒—托利多仪器(上海)有限公司;
数字式ULTRA TURRAX均质器:T18型,德国IKA公司。
1.2 试验方法
1.2.1 酸水解制备不同分子量SSPS样品 在朱昌玲等[16]酸提取方法的基础上加以修改制备不同分子量的SSPS。将大豆纤维与去离子水以1∶25 (g/g)比例混合,混合液pH调节至4.0,并进行不同程度的热处理(100 ℃持续2.5 h;120 ℃持续2.5 h;135 ℃持续1.5 h)以获得高、中、低分子量的可溶性大豆多糖(SSPS),分别被命名为M1(高分子量SSPS)、M2(中分子量SSPS)、M3(低分子量SSPS)。将反应后的混合液离心(5 400×g) 10 min,收集上清液,并通过旋转蒸发仪浓缩至原体积的1/10,将所得的浓缩液与3倍体积95%的乙醇混合,5 400×g离心10 min,获得的沉淀物在60 ℃的烘箱中干燥24 h,粉碎,过100目筛网,获得不同分子量的SSPS粉末。
1.2.2 碱脱酯制备不同酯化度SSPS样品 将1.2.1中制备的低分子量SSPS溶于去离子中,分别进行不同程度的碱性脱酯处理(pH 12.0、90 ℃,2 h; pH 12.5、90 ℃,2.5 h)以获得中酯化度(DE)和低酯化度(DE)的SSPS。将未进行碱性脱酯处理的SSPS定义为高酯化度SSPS,并命名为M3D1(低分子量高酯化度),将碱性脱酯处理的样品分别命名为M3D2(低分子量中酯化度)、M3D3(低分子量低酯化度)。将反应后的混合液离心(5 400×g) 10 min,收集上清液,并通过旋转蒸发仪浓缩至原体积的1/10,将所得的浓缩液与3倍体积95%的乙醇混合,调节pH至4.0,5 400×g离心10 min,获得的沉淀物在60 ℃的烘箱中干燥24 h,粉碎,过100目筛网,获得低分子量不同酯化度的SSPS粉末。
1.2.3 蛋白酶处理制造不同蛋白质含量SSPS样品 将1.2.1中制备的低分子量SSPS溶于去离子水中,添加3%的木瓜蛋白酶,在pH 6.0、50 ℃下分别酶解1,2 h[17]。将未进行酶解处理的SSPS定义为高蛋白含量的SSPS,并命名为M3P1 (低分子量高蛋白含量SSPS),将酶解处理的样品分别命名为M3P2 (低分子量中蛋白含量SSPS)、M3P3 (低分子量低蛋白含量SSPS)。将反应后的混合液离心(5 400×g)10 min,收集上清液,并通过旋转蒸发仪浓缩至原体积的1/10,将所得的浓缩液用3倍体积95%的乙醇混合,调节pH至4.0,将混合液离心(5 400×g) 10 min,获得的沉淀物在60 ℃的烘箱中干燥24 h,干燥后用粉碎机粉碎,过100目筛网,获得低分子量不同蛋白含量的SSPS粉末。
1.2.4 SSPS分子量的测定 使用高效液相色谱系统、2414示差检测器、TSK-gel G5000PWXL 凝胶色谱柱(300 mm×7.8 mm,TSK)测定SSPS的分子量。流动相为pH 6.8、13.097 g/L磷酸盐缓冲液,流速0.6 mL/min。取0.1 g SSPS溶解于10 mL磷酸盐缓冲液中,将SSPS溶液过0.45 μm水系滤膜然后注入HPLC色谱系统。使用葡聚糖标准品(5.25,13.05,64.65,135.35,300.60,2 000.00 kDa)绘制多糖分子量(Mw)的标准曲线,曲线方程为:lgMw=-0.268 5tR+9.271 4,R2=0.997 3,根据曲线方程计算SSPS重均分子量。
1.2.5 SSPS酯化度的测定 参照Xiong等[10]的滴定法并稍加改进。将SSPS(500 mg)在100 mL乙醇—HCl混合物(在100 mL 70%乙醇中的5 mL 437.5 g/L HCl)中搅拌10 min,再通过滤纸和玻璃漏斗过滤。收集的SSPS用上述乙醇—HCl混合物洗涤6次(每次20 mL),再用60%乙醇溶液洗涤,直到滤液中无硝酸银离子为止。将SSPS在60 ℃下干燥24 h。该处理消除了游离糖和盐,将SSPS转化为游离酸形式。将干燥的样品(200 mg)用0.8 mL乙醇润湿,溶解在40 mL无二氧化碳的蒸馏水中,并使用酚酞作为指示剂通过4 g/L氢氧化钠(NaOH)溶液滴定。NaOH的使用体积记录为V1。将20 g/L NaOH添加到滴定的样品溶液中进行脱甲基处理。15 min后,将18.2 g/L脱甲基 HCl(与脱甲基所用20 g/L NaOH的体积相同)添加到滴定的样品溶液中。使用4 g/L NaOH滴定样品,并将使用的体积记录为V2。按式(1)计算酯化度。
(1)
式中:
DE——酯化度,%;
V1——第1次滴定NaOH消耗的体积,mL;
V2——第2次滴定NaOH消耗的体积,mL。
1.2.6 SSPS蛋白质含量的测定 凯氏定氮法[18]。
1.2.7 SSPS单糖组成的测定 将500 mg SSPS样品和8 mL 218.8 g/L盐酸置于密闭管中,于120 ℃水解22 h。水解样品用400 g/L NaOH中和,并用蒸馏水稀释至25 mL。过滤后,将滤液以12 600×g离心30 min。将上清液用0.22 μm滤膜过滤,取10 μL上高效液相色谱仪测定单糖组成。
1.2.8 SSPS起泡性能的测定 根据Kunarayakul等[19]的方法加以修改。将10 mL的1 g/100 mL SSPS溶液转移到50 mL塑料量筒中,用匀浆器以17 500 r/min的速度搅打2 min。分别按式(2)、(3)计算泡沫膨胀和泡沫稳定性(FS)。
(2)
(3)
式中:
FE——泡沫膨胀率,%;
FS——泡沫稳定性,%;
V0——液体的初始体积,mL;
V1——刚搅打完泡沫的体积,mL;
V2——静置30 min后的泡沫体积,mL。
1.2.9 数据分析 除单糖组成和分子量数据外,其余数据均测试3次,结果以“平均值±标准偏差”表示。方差分析使用置信区间为95%的最小显著性差异检验来比较均值。
2 结果与分析
2.1 酸水解过程热处理程度对于SSPS结构性质和起泡性的影响
如表1所示,随着SSPS提取过程热处理程度的加重,产物分子量不断下降,从556 kDa降低至217 kDa,SSPS结构中鼠李糖含量逐渐降低,而阿拉伯糖和半乳糖含量并未发生改变。Nakamura等[20]曾报道,SSPS主要由鼠李糖和半乳糖醛酸构成其主链,由半乳糖和阿拉伯糖构成其侧链。因此可推测,随着酸水解程度越来越剧烈,SSPS分子量逐渐降低,其主链结构可能被逐渐破坏。从表1还可以看出,随着酸水解过程热处理程度的加重,产物SSPS的酯化度和蛋白含量并未发生显著改变。该结果提示,SSPS中的蛋白结构可能主要存在于主链结构上。
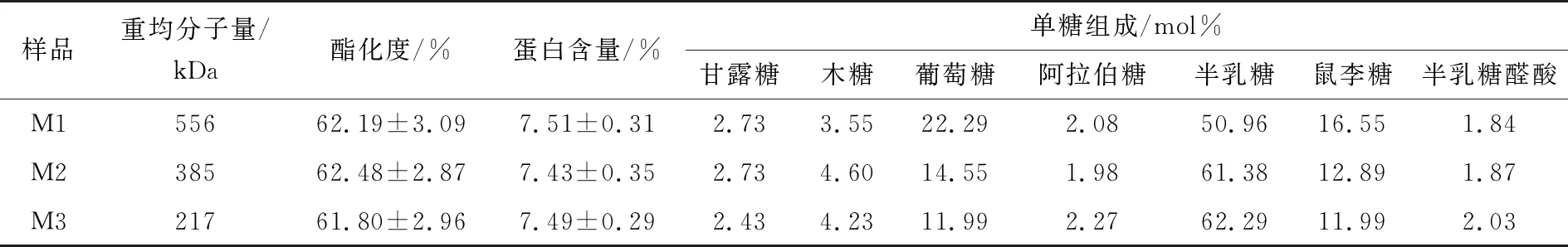
表1 不同酸水解条件下SSPS的重均分子量、酯化度、蛋白含量和单糖组成
如图1所示,随着SSPS分子量的逐渐降低,其泡沫膨胀率逐渐增大,而泡沫稳定性逐渐减小。分子量的降低有助于提高SSPS的起泡能力,这是因为小分子量的SSPS能更快地移动到气—水界面,进而更快地产生泡沫。而分子量降低使得SSPS的泡沫稳定性下降,可能是由SSPS在气—水界面的界面膜黏弹性下降导致。Chivero等[21]研究表明,相对分子量的增大会使SSPS溶液的黏度增加。另有研究[22]表明,茶叶多糖随溶液黏度的增大,液膜的表面黏弹性提高,多糖溶液的泡沫稳定性也越好。
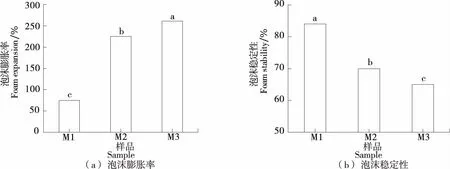
字母不同表示不同样品之间存在显著差异(P<0.05)
2.2 碱脱酯工艺对SSPS的结构性质和起泡性的影响
如表2所示,随着pH的提高和脱酯时间的延长,产物SSPS的甲酯化度不断降低,而SSPS的重均分子量和单糖组成并未发生明显改变,说明碱脱酯过程对SSPS的主链和侧链结构影响不显著。随着酯化度的降低,SSPS的蛋白含量逐渐降低。另外随着酯化度的降低,反应液颜色显著增加,说明碱脱酯过程使SSPS发生了剧烈的美拉德反应,导致蛋白含量降低。An等[23]的研究也表明碱脱酯过程会发生严重的美拉德反应。
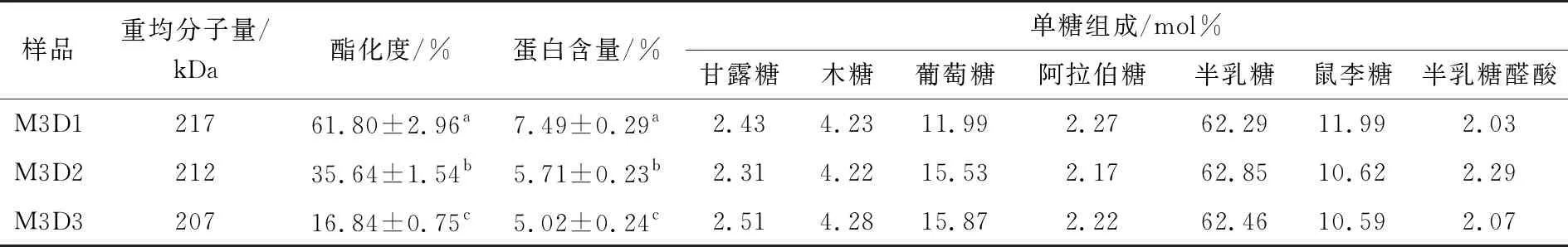
表2 不同碱处理条件下SSPS的重均分子量、酯化度、蛋白含量和单糖组成†
如图2所示,随着酯化度的降低,SSPS的泡沫膨胀率和泡沫稳定性均逐渐降低。有研究[24]称,SSPS的起泡性能主要由两亲性蛋白质成分决定,当SSPS的蛋白质含量降低到一定水平时,其起泡能力会大大降低。
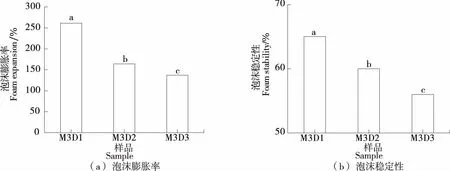
字母不同表示不同样品之间存在显著差异(P<0.05)
2.3 蛋白酶水解对产物SSPS结构性质和起泡性的影响
为了探讨影响SSPS起泡性的结构要素究竟是酯化度还是蛋白质含量,采用木瓜蛋白酶对相同分子量和酯化度的SSPS进行酶解处理。如表3所示,随着酶解时间的提升,产物SSPS中蛋白含量逐渐降低,SSPS的重均分子量、单糖组成和酯化度并未发生显著改变。说明蛋白酶酶解处理并不会破坏SSPS的主链和侧链结构,也不会影响其甲酯基结构。
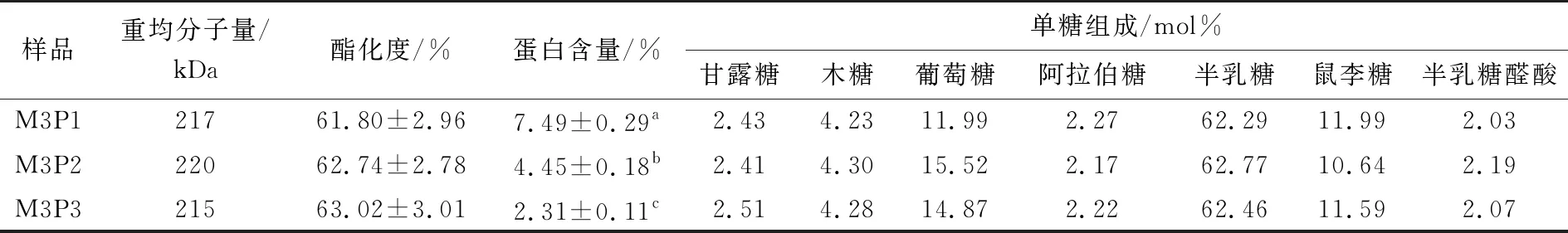
表3 不同酶解条件下SSPS的重均分子量、酯化度、蛋白含量和单糖组成†
如图3所示,随着蛋白含量的逐渐降低,SSPS的泡沫膨胀率和泡沫稳定性均显著下降。对照分析表2和图2中不同酯化度SSPS及其起泡性的结果可以得出结论,蛋白含量对SSPS的起泡性能相比于酯化度而言,有着更为重要的作用。
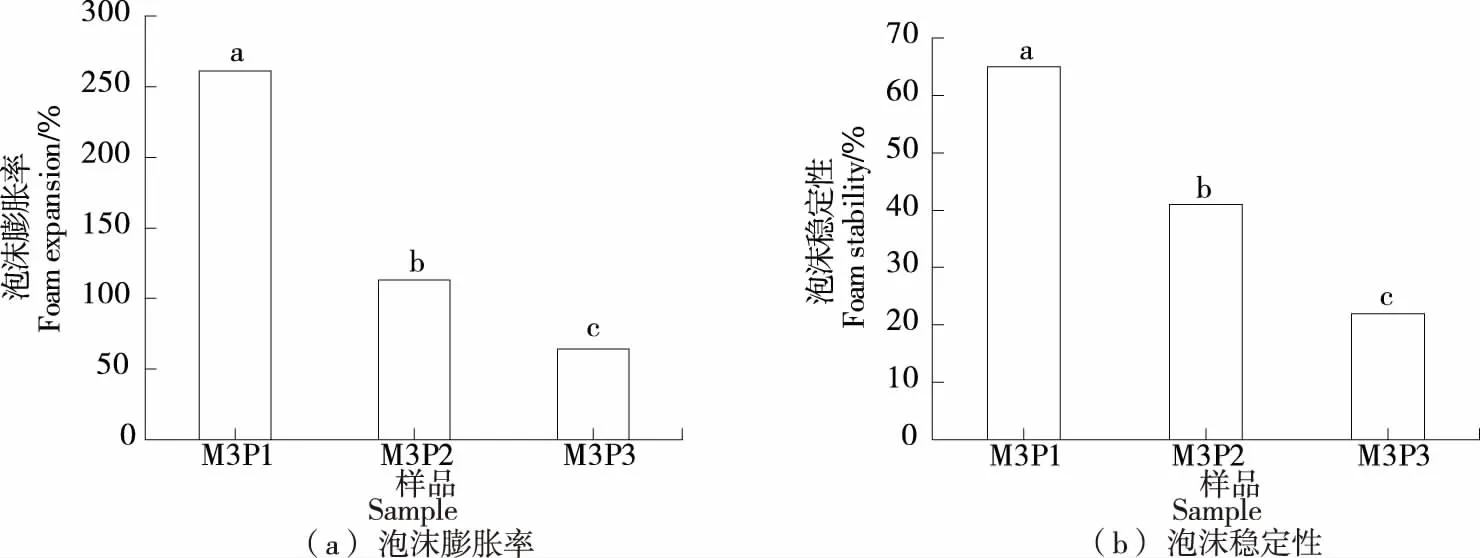
字母不同表示不同样品之间存在显著差异(P<0.05)
3 结论
试验研究了可溶性大豆多糖制备过程酸水解、碱脱酯和木瓜蛋白酶酶解对产物的单糖组成、分子量、酯化度和蛋白含量等结构性质和起泡性能的影响。结果显示:酸性水解过程会破坏可溶性大豆多糖主链结构进而使分子量逐渐降低;碱脱酯过程对可溶性大豆多糖的主链和侧链结构影响很小,但可以使其结构中的蛋白含量降低;蛋白酶水解可以降低蛋白质含量但不影响分子量和酯化度。随着分子量的降低,可溶性大豆多糖的泡沫膨胀率逐渐增大,但泡沫稳定性逐渐降低;与甲酯化度相比,可溶性大豆多糖结构中蛋白质含量对其起泡性起着更为重要作用。
试验研究表明,酸水解条件下的制备过程可能会对可溶性大豆多糖结构造成影响,但具体会如何改变可溶性大豆多糖的结构进而影响其起泡性质,仍需要进一步的研究,例如:利用光散射设备或原子力显微镜进一步分析可溶性大豆多糖的结构;对可溶性大豆多糖表面张力、临界胶束浓度等方面的界面性质进行研究以进一步解释其起泡性能改变的原因。

