维生素D受体基因多态性与2型糖尿病患者视网膜病变的相关性分析
严 凯,刘 意,田慧丽
0引言
糖尿病性视网膜病变(diabetic retinopathy,DR)是临床最常见的糖尿病微血管并发症,DR是成人致盲的重要原因,据相关报道,超过一半的2型糖尿病(type 2 diabetes mellitus,T2DM)患者会患视网膜病变,其中近1/3的患者会因DR而失明[1]。可见,DR严重威胁T2DM患者的生活质量,同时给患者家庭和社会带来沉重的负担。2型糖尿病视网膜病变的具体发病机制仍未阐明,目前维生素D与T2DR的相关性是国内外研究的热点[2]。维生素D是一组内分泌激素,在肝脏及肾脏内羟化成为活性1,25-二羟基维生素D3[1,25(OH)2D3],具有抗氧化、抑制血管平滑肌增生以及抗血管增殖的作用,在视网膜组织中广泛表达[3]。维生素D与维生素D受体(VDR)结合,通过激活及调节多条细胞通路来发挥其生物学作用[4]。近年来,出现少数关于VDR基因多态性与DR相关性的相关报道,但结果差异较大甚至截然相反。因此,本研究通过多重高温连接酶检测反应(improved multiple ligase detection reaction,iMLDR)技术进行单核苷酸多态性(single nucleotide polymorphism,SNP)分型,检测并分析DR患者rs1544410、rs2228570的VDR SNPs位点基因多态性,旨在探讨VDR基因多态性与DR的相关性,为DR的临床预防及个性化治疗提供理论依据,现报道如下。
1对象和方法
1.1对象筛选2018-02/2019-01我院收治的T2DM患者作为研究对象。纳入标准:(1)符合《中国2型糖尿病防治指南(2017版)》[5]相关诊断标准;(2)同意取血样行DNA检测;(3)个人资料完整;(4)患者自愿参与本研究,并签署知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)与已纳入对象有血缘关系;(3)肾功能衰退;(4)急性或者慢性炎症者;(5)其他原因导致的视网膜病变。最终纳入研究的T2DM患者共198例。本研究遵循《世界医学协会赫尔辛基宣言》,并经我院伦理委员会批准。
1.2方法
1.2.1分组方法采用免散瞳数码眼底成像方法对198例患者进行眼底检查。患者先在暗室内适应视觉,后由眼科医师使用佳能EOS 40D免散瞳数码眼底相机获取45°后极部视网膜彩色图像。由眼科医师根据美国眼科协会出台的2018年糖尿病视网膜病变临床指南[6]阅片诊断,并将198例患者分为DR组(n=108)和非DR组(n=90)。
1.2.2检测方法
1.2.2.1相关指标检测使用EDTA管取患者入院次日清晨空腹静脉血约5mL,提取DNA,-80℃储存备用。检测空腹血糖(FBG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、糖化血红蛋白(HbA1c)和血管内皮生长因子(VEGF)。
1.2.2.2 PCR扩增主要试剂:Taq DNA聚合酶(赛默飞世尔科技有限公司,中国),引物(上海生工生物工程公司),PCR反应缓冲液(TaKaRa公司),PCR Marker(南京赛泓瑞生物科技有限公司),琼脂糖(上海源叶生物科技有限公司)等。PCR条件:反应体系10μL包括1×HotStarTap缓冲液、0.30mmol/L dNTP、3.0mmol/L Mg2+、1U HotStarTap聚合酶、1μL DNA样本及1μL多重PCR引物,引物序列见表1。反应热循环:95℃预变120s;94℃ 20s、65℃ 40s、72℃ 90s,循环11次;94℃ 20s、59℃ 30s、72℃ 90s,循环24次;72℃延伸120s,4℃保存。
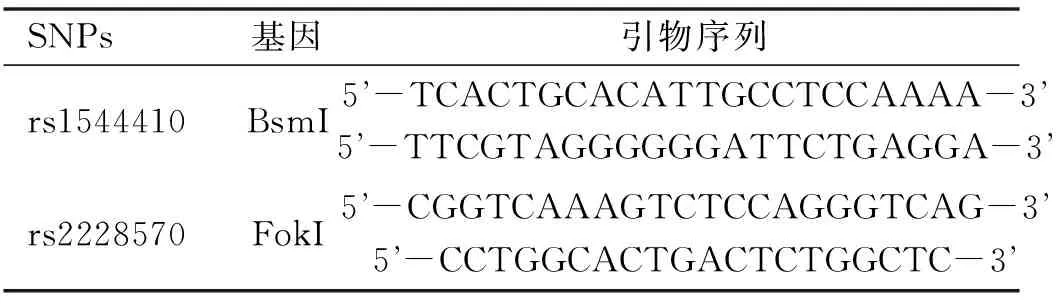
表1 各SNP的引物序列
1.2.2.3 PCR产物纯化5U SAP酶、2U Exonuclease Ⅰ酶加入10μL PCR产物中,温浴(37℃,60min),然后灭活(75℃,15min)。连接引物反应体系:10×连接缓冲液(1.0μL)、0.25μL高温连接酶、0.4μL 5’连接引物混合液(1.0μmol/L),0.4μL 3’连接引物混合液(2.0μmol/L)、2.0μL纯化后多重PCR产物、6.0μL ddH2O,混匀。将稀释后的连接产物(0.5μL)、Liz 500SIZ STANDARD(0.5μL)、hi-Di(9.0μL)混匀,变性(95℃,5min)后上ABI 3730XL基因测序仪,所得原始数据应用GemeMap-per4.1(ABI)进行分析。

2结果
2.1两组一般资料比较两组患者年龄、性别、T2DM病程、体质量指数及HDL-C比较,差异均无统计学意义(P>0.05);DR组的HbA1c、FBG、LDL-C、TG、VEGF显著高于非DR组,差异均有统计学意义(P<0.001),见表2。

表2 两组一般资料比较
2.2 VDR基因位点Hardy-Weinberg平衡检验rs1544410、rs2228570位点基因型分布符合Hardy-Weinberg平衡(P>0.05),提示2个位点选择的样本具有群体代表性,见表3。
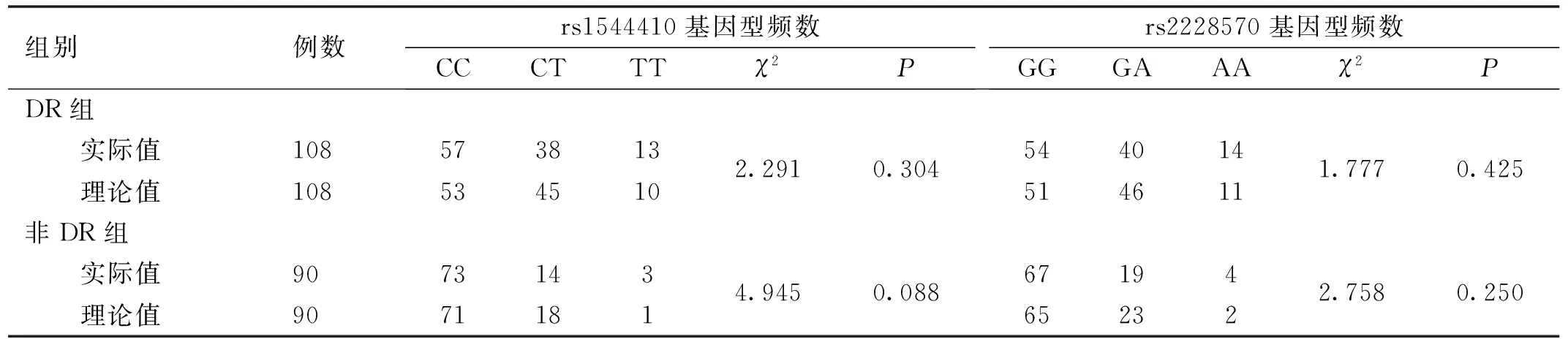
表3 两组VDR基因位点Hardy-Weinberg平衡检验 例
2.3非DR组与DR组VDR基因位点的基因型和等位基因频率分布比较DR组VDR基因rs1544410位点T等位基因频率、rs2228570位点A等位基因频率均显著高于非DR组,差异有统计学意义(P<0.05),见表4。

表4 非DR组与DR组VDR基因位点的基因型和等位基因频率分布比较 例(%)
2.4 VDR基因BsmI基因型间相关指标比较CC基因型130例,CT基因型52例,TT基因型16例。CC基因型与CT+TT基因型相关指标比较,差异均有统计学意义(P<0.05),见表5。

表5 VDR基因BsmI基因型间相关指标比较
2.5 VDR基因FokI基因型间相关指标比较GG基因型121例,GA基因型59例,AA基因型18例。GG基因型与GA+AA基因型相关指标比较,差异均有统计学意义(P<0.05),见表6。

表6 VDR基因FokI基因型间相关指标比较

变量BWaldPOR95%CIBsmI基因CT+TT基因型0.9517.7800.0242.5881.108~6.450FokI基因GA+AA基因型0.6885.5050.0381.9901.404~8.220
2.6 Logistic回归分析rs1544410、rs2228570与2型糖尿病患者视网膜病变的关系以是否发生DR作为因变量(1代表发生,0代表不发生),选择以上比较有统计学意义的因素(HbA1c、FBG、LDL-C、TG、VEGF)及BsmI基因显性模型、FokI基因显性模型作为自变量,进行非条件Logistic回归分析,结果显示BsmI基因CT+TT基因型、FokI基因GA+AA基因型是DR的危险因素(P<0.05,表7)。
3讨论
目前,DR发生普遍被认为与患者的高血糖有关,高血糖会促使白细胞对微血管上皮细胞的黏附,引起细胞损伤、血液流变学变化,导致视网膜破坏[7]。有研究显示,血清维生素D水平不足或缺乏会增加胰岛素抵抗作用、降低胰岛β细胞功能[8-9]。许多研究证实,T2DM患者血清25(OH)D与HbA1c、FPG呈负相关,25(OH)D水平下降可能是T2DM发生的机制之一,且25(OH)D水平下降可增加T2DM合并周围血管病变的风险[10-11]。李俊等[12]的研究阐述了T2DR的发生与患者血清维生素D的关系,发现25(OH)D水平与T2DR的发生呈负相关,认为维生素D在DR的发病过程中对视网膜具有保护的作用,而维生素D缺乏则会增加DR发生风险。关于维生素D对DR的发病机制不明确,可能为血清25-OH-VD3抑制视网膜组织中的VEGF和转化生长因子-1(TGF-1)的表达,减少因VEGF的过度表达导致的血管内皮细胞凋亡,VEGF的升高可增强血糖对神经元的毒性,加重微血管并发症,加速对玻璃体的侵袭,促进DR的发生发展[13-14]。
1,25(OH)2D3是维生素D3的主要活性形式,与VDR结合在体内发挥多种生物学效应,近几年VDR与DR的相关性已成为国内外研究的热点,其中维生素D与VDR结合,通过激活及调节多条细胞通路来发挥其生物学作用,因此,有学者认为VDR基因在DR发病过程中起到决定性作用[15]。VDR是DR候选基因之一,属于亲核蛋白,具有单核苷酸多态性。Zhong等[16]发现DR发病率与患者VDR rs2228570位点基因多态性显著相关,认为VDR的rs2228570基因位点可作为T2DR的良好生物标志物。Hong等发现韩国人VDR基因中的BsmI多态性可作为预测T2DM并发症发生的易感性标记物[17]。侯丽君等[18]研究结果显示,中国山东泰安及周边地区汉族人VDR基因FokI多态性与T2DR发病显著相关。同时,本研究发现,非DR组BsmI等位基因频率T 11.1%,C 88.9%,DR组BsmI等位基因频率T 29.6%,C 70.4%;非DR组FokI等位基因频率A 15.0%,G 85.0%,DR组FokI等位基因频率A 31.5%,G 68.5%;DR组VDR基因rs1544410位点T等位基因频率、rs2228570位点A等位基因频率均显著高于非DR组,差异有统计学意义(P<0.05)。同时,本研究分析了VDR基因BsmI、FokI基因型间DR相关生化指标的比较,发现BsmI、FokI的不同基因型之间的FBG、LDL-C、TG、HbA1c和VEGF水平差异明显(P<0.05),进一步Logistic分析中显示BsmI基因CT+TT基因型、FokI基因GA+AA基因型是DR的危险因素(P<0.05)。这些提示VDR基因BsmI、FokI多态性与DR显著相关。本研究与上述研究结果相似,但其中相关机制尚不明确,考虑可能VDR BsmI和FokI多态性导致VDR无法介导1,25(OH)2D3发挥生物学效应,无法有效发挥抑制视网膜血管增生的作用,有待进一步机制研究。但是,在李丽等[19]的研究中,VDR基因BsmI、FokI多态性与新疆汉族T2DR并无明显相关性,与本研究及其他研究结果差异较大,考虑原因可能是VDR基因多态性具有区域及种族分布差异性,与人的生活习惯及地理环境有关,或与研究的纳入标准、排除标准及试验方法的不同有关。因此,仍需更大样本量更深入的研究予以进一步证实。
综上所述,VDR基因BsmI、FokI多态性与2型糖尿病视网膜病变显著相关,但其机制尚未明确,可能是2型糖尿病视网膜病变的易感基因位点。

