白色念珠菌对口腔黏膜疾病恶性转化作用的研究进展
廖敏 程磊 周学东 任彪
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院牙体牙髓病科,成都 610041
口腔癌是指发生在口腔和口咽部的恶性肿瘤,是头颈部最常见的恶性肿瘤,也是全球十大最流行的恶性病损之一[1-2]。按组织病理学分类,口腔癌可分为上皮来源的口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)、肉瘤、淋巴瘤、黑色素瘤等,其中OSCC最为常见,所占比例超过90%[3]。流行病学资料显示,口腔癌的5年生存率仅为60%,男性的发病率和死亡率均高于女性[4-6]。口腔癌的发生与多种危险因素有关,包括吸烟、饮酒、感染、咀嚼槟榔、理化刺激等[7-8]。感染在肿瘤发生发展中扮演了重要角色,据统计,全球大约1/5的恶性肿瘤与感染有关[9-10]。口腔是一个复杂的微生态系,口腔内定植的微生物数量庞大,种类繁多,容易引发多种感染。许多研究发现,口腔微生物感染与口腔癌存在密切关系,如人乳头状瘤病毒(human papilloma virus,HPV)病毒[7]、EB(Epstein-Barr)病毒[11]、牙龈卟啉单胞菌等[12],而关于真菌的研究相对较少,但真菌在其中扮演的重要角色却不可忽视。
白色念珠菌(Candida albicans,C. albicans)是口腔中最常见的机会性致病真菌,当局部微环境改变或者机体抵抗力下降时,白色念珠菌会转变为致病菌,引起黏膜念珠菌病或系统性念珠菌病。肿瘤患者大多接受放化疗,因此处于免疫抑制的状态,较非肿瘤患者患念珠菌病的概率更高。然而,越来越多的研究发现,念珠菌病不仅仅只是患肿瘤后的易感病,白色念珠菌也可能在肿瘤的发生发展中起到能动作用,尤其是口腔癌。
早在1969年,就有学者提出了白色念珠菌与口腔黏膜癌变存在密切关系,长期的黏膜念珠菌感染可能会增加口腔黏膜癌变的风险[13-14],大量学者对其进行了相关的研究,探究其中的机制,取得了一定的进展。因此,本文就白色念珠菌感染与口腔黏膜疾病恶性转化的关系,及白色念珠菌可能作用机制作一综述。
1 白色念珠菌感染与口腔黏膜癌变的关系
1.1 白色念珠菌与慢性增生性念珠菌病
白色念珠菌感染引起的口腔黏膜念珠菌病按照临床表现可以分为四型,分别为假膜型念珠菌病、急性红斑型念珠菌病、慢性红斑型念珠菌病和慢性增殖型念珠菌病(chronic hyperplastic candidosis,CHC)[15]。其中,CHC癌变概率最高[16],其临床表现为口腔黏膜表面黏附性的、不能被拭去的增厚的白色斑块,其主要特征为念珠菌菌丝侵入上皮。据报道,若未能及时有效地治疗,10%的CHC会发展成为OSCC[17-18]。
由于CHC主要是按照其临床表现命名,因此,该病的原始病因目前尚不确定[17,19]。可能最初是由念珠菌感染所形成的增生性病变,也可能是黏膜先形成白斑,然后继发念珠菌感染。从后一个角度来看,该病也被称为“念珠菌性白斑”(candidal leukoplakia,CL)。白斑是一种癌变概率较高的癌前病变,但有研究[8,20]发现,伴有念珠菌感染的白斑比未感染念珠菌的白斑其癌变概率更高。从这个方面可见,白色念珠菌在口腔黏膜癌变过程中起到了一定的作用。
1.2 白色念珠菌与遗传病相关口腔黏膜疾病
另一种证明白色念珠菌感染与口腔癌存在密切关系的疾病是自身免疫性多内分泌腺病、念珠菌感染和外胚层营养不良综合征(autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy,APECED),一种多发于芬兰的隐性遗传病,几乎所有患者都有长期的慢性黏膜念珠菌病,且容易在早年癌变[21]。Rautemaa等[22]曾报道了6例APECED患者,在平均年龄37岁就被确诊为口腔和食管鳞状细胞癌,其中5例都曾长期患有慢性念珠菌病,据此可以推测,白色念珠菌感染可能是癌变的重要促进因素。不过,这些报道涉及的病例数量都相对较少,仍然需要继续追踪调查,提供更多的相关病例和研究。
1.3 白色念珠菌与口腔癌
临床研究[23]表明,在念珠菌感染的人群中,肿瘤的发生率显著高于无念珠菌感染的人群,包括头颈部肿瘤、血液恶性肿瘤等。据报道,74%的口腔癌患者唾液中可检出念珠菌,分离的念珠菌中,白色念珠菌所占比例最高,为84%[24-25]。在口腔癌患者黏膜表面和组织活检中,白色念珠菌的检出率和载荷量明显也高于非口腔癌患者[26-27]。进一步的比较发现,口腔癌患者与非口腔癌患者口腔黏膜表面分离的白色念珠菌菌株25SrDNA基因型存在明显差异,在口腔癌患者分离得到的白色念珠菌主要是基因型A型(450 bp),而非口腔癌患者口腔中主要是基因型B型(840 bp)[26]。这些证据提示,口腔黏膜癌变与白色念珠菌的异常定植、侵袭有关,特定基因型的菌株在其中可能起到了重要作用,而这种特定基因型是如何影响白色念珠菌的毒力及致癌能力的,还有待进一步研究。且目前的这些相关研究多是描述性研究,也可能是患者在患有口腔癌之后,造成了口腔微环境或者机体免疫状态等的改变,使得口腔癌患者白色念珠菌感染与非口腔癌患者之间出现这种差异。因此,还需要一些前瞻性的研究,提供论证强度更高的证据。
1.4 白色念珠菌促进黏膜癌变
在流行病学研究的基础上,为进一步验证白色念珠菌是否能促进黏膜癌变,有学者进行了小鼠体内实验。他们用硝基喹啉(4 nitroquinoline 1-oxide,4NQO)作为诱导上皮恶变的引发剂,预处理小鼠,再用白色念珠菌感染,观察白色念珠菌的促癌效应。结果发现,仅用4NQO处理,未引起明显的上皮病损;仅用白色念珠菌处理也只引起上皮过度增生;但4NQO预处理后加入白色念珠菌感染,口腔黏膜出现上皮不典型增生,细胞周期相关蛋白Ki-67和P16的表达显著增高[28],即在4NQO诱导上皮肿瘤生成的小鼠中,白色念珠菌能促进上皮癌变。这些结果表明口腔癌的发生是多因素共同作用所致,白色念珠菌感染是其中重要的诱因[28]。
2 白色念珠菌可能的促癌机制
2.1 破坏上皮屏障
白色念珠菌感染上皮过程包括黏附到上皮表面,继而侵袭、损伤上皮。首先,白色念珠菌通过其表面的黏附素黏附到上皮细胞表面,主要包括凝集素样序列蛋白(agglutinin-like sequence,Als)、菌丝壁蛋白(hyphal wall protein,Hwp)等[29-30]。成功黏附后,白色念珠菌可通过诱导上皮细胞内吞、主动地穿透两种机制侵袭上皮、突破上皮屏障。诱导内吞是指白色念珠菌表面的Als蛋白与上皮细胞表面E-钙黏蛋白结合,刺激上皮细胞产生伪足样结构,像一张网一样捕获真菌,将其内吞进入上皮细胞[31]。另外,白色念珠菌能分泌特异性的蛋白酶,降解基底膜和细胞外基质成分,实现主动穿透上皮屏障[17]。如分泌性天冬氨酸蛋白酶(secreted aspartyl proteinases,Sap),能降解上皮结合处的黏附蛋白,即E-钙黏蛋白[32-33]。Pärnänen等[34]发现,白色念珠菌分泌的蛋白酶,能降解基底膜的层粘连蛋白332,破坏上皮连接及基底膜的完整性。最近研究[35]发现,白色念珠菌菌丝相能分泌一种真菌肽毒素,即Candidalysin,由ECE1基因编码,能够损伤上皮细胞膜,诱导上皮细胞炎性反应,产生白细胞介素(interleukin,IL)-1α、粒细胞集落刺激因子(gra nulocyte colonystimulating factor,G-CSF)等炎性因子,释放乳酸脱氢酶(lactate dehydrogenase,LDH)。肿瘤的生长和侵袭涉及肿瘤细胞和基质细胞的多种反应,白色念珠菌的这种水解、破坏作用,不仅有利于白色念珠菌对上皮组织的侵袭,也有利于肿瘤细胞的转移和扩散[17]。
2.2 产生致癌物质
关于白色念珠菌致癌机制最为广泛接受的假说就是产生致癌物质,包括亚硝胺(nitrosamines)、乙醛(acetaldehyde)等。这些致癌物质可能直接作用于口腔上皮,或者与其他物质相互反应、共同作用,诱导上皮癌变,促进肿瘤发展[36]。
2.2.1 亚硝胺 白色念珠菌具有亚硝化作用,能够代谢前体物质N-苄基甲胺(N-benzylmethylamine,BMA),产生甲基苄基亚硝胺(N-nitrosobenzylmet hylamine,NBMA)。而这种前体物质BMA广泛存在于食物中,如胡萝卜、沙拉、鲱鱼油、冻干咖啡等,浓度高达0.2~20 μg·kg-1。不同生物型的白色念珠菌亚硝化的能力不同,106菌量代谢足量BMA能产生0~1.2 μg·kg-1NBMA,其中,恶变程度较高的口腔黏膜病损分离的菌株亚硝化能力最强,主要包括051、147、151、153、157、353生物型[37]。产生的NBMA能与DNA结合形成加合物,诱导基因突变,促进小鼠形成食管和口腔鳞状细胞癌,因此NBMA常用作诱变剂,建立动物食管癌模型[17,38-39]。Krogh等[37]认为,白色念珠菌不仅能产生亚硝胺作用于黏膜表面,还能侵入上皮组织深层,可能将唾液中一些亚硝胺的前体物质转移到上皮深层,产生的亚硝胺在组织中沉积,产生持久的致癌作用。
最近,Sanjaya等[40]提出,白色念珠菌的这一机制的直接致癌作用尚存在争议。上皮的完整性破坏、吸烟等危险因素存在会增加白色念珠菌的毒性。因此,白色念珠菌的亚硝化作用结合其他危险因素共同作用,促进口腔癌的发生发展,或许更具说服力。
2.2.2 乙醛 从正常人、口腔潜在恶性病损、OSCC患者口腔分离白色念珠菌菌株,分别代谢11 mmol·L-1乙醇(与80 kg体重男性饮3杯酒后唾液中乙醇含量相当),均能产生大量的乙醛(>40 μmol·L-1),而OSCC患者口腔分离菌株产生乙醛的能力最强[21,41-42]。研究[42]表明,40~100 μmol·L-1的乙醛就有明显的致癌性,一方面,乙醛与细胞的蛋白、DNA结合形成稳定的加合物,使其结构和功能发生异常改变,这种加合物能干扰正常的DNA复制,诱导点突变,还能影响DNA修复和胞嘧啶甲基化相关的酶,导致细胞周期打乱,促进原癌基因的激活,导致肿瘤生成。另一方面,乙醛还能损伤线粒体,增加活性氧(reactive oxygen species,ROS)的产生,从而促进DNA的损伤,促进肿瘤发生发展[36,43-44]。
口腔内乙醛的累积,是微生物代谢、机体的行为习惯和遗传背景等共同作用的结果。一般情况下,机体主要通过乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)代谢、清除乙醛,编码该酶的正常基因为ALDH2*1,但40%的亚洲人体内是ALDH2*2基因。ALDH2*2基因所编码产生的ALDH活性极低,导致体内乙醛含量增加,增高了患上消化道肿瘤的概率[44]。此外,Gainza-Cirauqui等[41]研究发现,口腔潜在恶性病损患者中,有吸烟、饮酒习惯的患者口腔白色念珠菌产生乙醛的能力明显高于不吸烟、饮酒的患者,据此推测,吸烟、饮酒可能会增加白色念珠菌产生乙醛的能力,这也就有助于解释为什么吸烟、饮酒是口腔黏膜恶变的最重要的危险因素。然而,吸烟、饮酒如何提高白色念珠菌产生乙醛能力,还需要进一步研究。
2.3 诱导慢性炎症反应
早在19世纪就有学者[45]提出了炎症与肿瘤存在密切联系,并进行了一系列的研究。从流行病学角度来看,肿瘤多发生在慢性炎症的部位,而长期服用非甾体类抗炎药能降低患某些肿瘤的风险和肿瘤造成的死亡率[46]。从分子生物学的角度来看,机体遗传学的改变,能导致炎症、异常增生和癌变;炎症可以改变局部微环境,促进肿瘤发生发展[47]。这些炎性产物一定程度上有助于募集免疫细胞、清除感染物质,同时,也是维持、促进肿瘤进展和恶变表型所必须的,如促进肿瘤组织的重建、血管生成、转移、抑制抗肿瘤的先天性免疫等[36,48]。白色念珠菌感染口腔上皮,引发的炎症反应、产生的炎性产物,在口腔癌的发生发展中起到了一定的作用。目前与口腔癌相关的炎性因子主要有前列腺素E2(prostaglandin E2,PGE2)和基质金属蛋白酶(matrix metalloproteinases,MMPs)。
2.3.1 PGE2白色念珠菌感染宫颈癌细胞系HeLa细胞,能被其表面的Toll样受体(Toll-like receptor,TLRs)识别,包括TLR2、TLR4,继而激活细胞内蛋白激酶C(protein kinase C,PKC)、P38MAPK通路和核因子-κB(nuclear factor-kappa B,NF-κB)通路,增加炎性产物环氧合酶2(cyclooxygenase-2,COX-2)的产生和PGE2的合成[49]。现有研究[50]表明,白色念珠菌感染口腔上皮细胞也能上调PGE2的表达,而作者并未对其中的机制进行阐述,由于不同的上皮细胞表面的受体及其对白色念珠菌的敏感性可能不同,白色念珠菌上调口腔上皮细胞PGE2表达是否也有相似的机制,还有待进一步研究验证。目前研究已证实,PGE2在肿瘤的发生发展中起到了重要的促进作用。Yang等[51]发现,PGE2能与口腔癌细胞表面的PGE受体(EP1)结合,激活蛋白激酶δ(proteinkinase Cδ,PKCδ)、c-Src、c-Jun、激活蛋白1(activator protein-1,AP-1)信号通路,上调细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)的表达,促进口腔癌细胞的迁移。而对一些其他肿瘤的研究表明,PGE2也能产生一些其他的促癌效应,如反式激活表皮生长因子受体,促进细胞迁移与侵袭,抑制细胞凋亡[52];上调血管内皮生长因子、成纤维细胞生长因子的表达,促进肿瘤血管生成[53];PGE2还能抑制树突状细胞分化、T细胞增殖、自然杀伤细胞和巨噬细胞的抗肿瘤活性等,产生免疫抑制的效应[54]。而PGE2对于口腔癌是否也有上述类似的促进机制,还有待进一步研究证实。
2.3.2 MMPs Claveau等[55]研究发现,白色念珠菌感染人重组口腔上皮模型,使上皮细胞MMP9表达明显增高,2型基质金属蛋白酶组织抑制剂(type 2 matrix metalloproteinase tissue inhibitors,TIMP2)表达明显降低。MMP9能降解基底膜的Ⅳ型胶原,破坏基底膜完整性,有助于白色念珠菌的播散,以及肿瘤细胞的转移和侵袭,降低患者生存率[56]。有趣的是,作者还发现,白色念珠菌感染人重组口腔上皮细胞后,MMP2仅基因转录上调,但MMP2蛋白却明显降低,为何会出现这种相反的结果及其中的机制,目前还不清楚。
2.4 免疫反应
白色念珠菌促进口腔癌发生发展可能与T细胞免疫反应及IL-17的作用有关。白色念珠菌感染口腔黏膜主要通过刺激nTh17细胞(又称TCRαβ细胞)和TCRγδ细胞产生IL-17[57]。最近有研究[35,58]表明,白色念珠菌刺激nTh17细胞的关键毒力因子是一种真菌肽毒素,即candidalysin,能直接攻击口腔上皮细胞,引发IL-1的释放;还能特异性的刺激nTh17细胞增殖,促进产生IL-17,这种刺激nTh17的增殖效应有赖于IL-1α/β相关的通路。同时,产生的IL-17又能与念珠菌素协同作用,促进IL-1产生,形成一种自我强化的前馈环路,增强机体的免疫反应。产生的IL-17对肿瘤有双重作用,一方面,IL-17能通过诱导IL-6、IL-12的产生,增强细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)的反应,产生抑制肿瘤的作用[59];另一方面,IL-17能够促进口腔癌细胞增殖、侵袭和迁移,与患者预后差密切相关[60](图1)。最近,Xiang等[61]发现IL-17能促进卵巢癌CD133+肿瘤干细胞(cancer stem cells,CSCs)的自我更新能力,促进肿瘤形成,主要与NF-kB、P38MAPK通路活化有关。此外,IL-17刺激胃癌静止的CSCs,能够使其表现出上皮间充质转化的表型,即E-钙黏蛋白表达降低,N钙黏蛋白、波形蛋白等表达增高,肿瘤形成和转移能力增强,这可能与IL-17促进细胞内STAT3信号的磷酸化有关[51]。IL-17还能够刺激成纤维细胞上调血管内皮生长因子的表达,促进炎性部位和肿瘤的血管生成[62]。据此可以推测,靶向控制IL-17及相关的信号分子,可能会成为一种新的肿瘤治疗策略。然而目前关于IL-17与口腔癌的研究相对较少,是否也能通过控制白色念珠菌感染、IL-17的产生,从而一定程度上控制口腔癌的发生发展,也有待进一步研究。
3 展望
肿瘤是多因素共同作用的疾病,而口腔是一个复杂、动态变化的环境,口腔癌与感染、宿主免疫、饮食、口腔卫生等多种因素有关。白色念珠菌在一定程度上能够促进口腔癌,也可能是机体自身状态和其他外部因素的协同作用的结果。例如,白色念珠菌能代谢乙醇产生乙醛,长期饮酒不仅会给白色念珠菌提供代谢产物,会使白色念珠菌产生乙醛的能力发生适应性增强,共同增加患癌风险[39]。有学者认为,白色念珠菌在口腔癌中的直接作用尚存在争议,更可能是一种间接的促进作用,结合吸烟会提高促癌作用[40]。
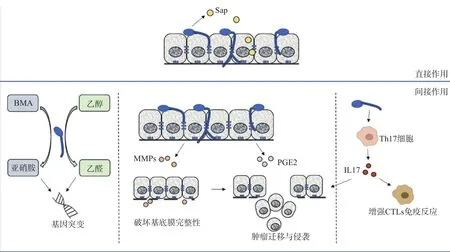
图1 白色念珠菌作用口腔癌的可能机制Fig 1 Probable mechanisms of C. albicans infection to oral cancer
目前关于口腔癌与病毒、细菌的研究较多,而关于白色念珠菌的研究还相对较少[17],其中多是流行病学分析和描述性研究,关于分子生物学的研究还比较缺乏,许多假设还有待进一步验证。白色念珠菌感染刺激T细胞分泌IL-17,IL-17能促进口腔癌细胞增殖、侵袭和迁移,但是IL-17如何作用于口腔癌细胞的具体机制尚未阐明,而IL-17在其他肿瘤中的作用有更深入的研究,或许可以作为研究其与口腔癌的相互作用提供参考[60]。此外,白色念珠菌是否存在其他可能促癌机制,以及控制白色念珠菌是否会影响口腔癌的发生,尚不清楚。因此,还需要进一步研究,来更好地认识白色念珠菌与口腔癌的关系,为口腔癌的临床防治工作提供依据。
利益冲突声明:作者声明本文无利益冲突。

