镧改性Cu-SSZ-13分子筛用于氨选择性催化还原催化剂研究
甄铁丽,李永红
(1.济南工程职业技术学院,济南 250200;2.天津大学化工学院绿色合成与转化教育部重点实验室;3.精馏技术国家工程研究中心;4.天津化学化工协同创新中心)
氮氧化物(NOx)是主要的大气污染物之一,与光化学烟雾、全球气候变暖等环境问题密切相关。氨选择性催化还原技术(NH3-SCR)的原理是通过添加NH3作为还原剂将NOx选择性还原为无害的N2后排放,具有效率高、成本低等特征,已成为目前主要的移动源脱硝技术。近几年研究者开发了SSZ-13分子筛作为NH3-SCR催化材料的载体,表现出优异的脱硝活性和水热稳定性。SSZ-13分子筛制备中使用N,N,N-三甲基金刚烷胺作模板剂,价格较高,限制了该分子筛的应用。Cu-SSZ-13催化材料主要应用于NH3-SCR领域,具有优异的催化活性和水热稳定性。任利敏等[1]用廉价的模板剂四乙烯五胺(TEPA)一步制备出Cu-SSZ-13分子筛。Xie Lijuan等[2]对一步合成出的Cu-SSZ-13分子筛进行了一次和两次硝酸铵改性并测试其在NH3-SCR反应中的催化性能。文献[3]报道用La改性分子筛可以提高其在NH3-SCR反应中的催化活性。本研究以TEPA为模板剂直接制备Cu-SSZ-13分子筛,然后用不同浓度的硝酸镧进行改性,并测定改性后分子筛的催化性能,探讨其催化反应机理。
1 实 验
1.1 催化剂制备
原料:硫酸铜(CuSO4·5H2O)、偏铝酸钠(NaAlO2)、氢氧化钠(NaOH)、四乙烯五胺(C8H23N5),分析纯,天津市光复科技发展有限公司产品;硝酸铵(NH4NO3)、硝酸镧[La(NO3)3·6H2O],分析纯,天津市华东试剂厂产品;硅溶胶(SiO2质量分数40%),青岛市海洋化工有限公司产品;去离子水,天津永源纯水开发中心产品。
分别以硅溶胶、硫酸铜、TEPA、偏铝酸钠和氢氧化钠作为硅源、铜源、模板剂、铝源和碱性调节剂。按照硅铝酸盐初始凝胶摩尔比为n(Na2O)∶n(Al2O3)∶n(SiO2)∶n(H2O)∶n(Cu-TEPA)=5.0∶1.0∶10∶200∶2.0的比例配成溶液,放入反应釜中于140 ℃晶化3天。用去离子水洗涤晶化产物至中性,在110 ℃下干燥8 h,得到初始Cu-SSZ-13分子筛样品。将制备的Cu-SSZ-13用1 mol/L NH4NO3溶液进行离子交换6 h,干燥后在600 ℃焙烧5 h,连续处理两次。称取所得样品4份(每份2.5 g),分别加入浓度为0.015,0.025,0.10,0.15 mol/L的硝酸镧溶液,于80 ℃恒温水浴中搅拌10 h进行离子交换,洗涤,干燥,500 ℃焙烧5 h。制得的样品分别标记为La0.015-Cu-SSZ-13,La0.025-Cu-SSZ-13,La0.10-Cu-SSZ-13,La0.15-Cu-SSZ-13。
1.2 催化剂表征
催化剂的X射线衍射(XRD)测试在德国Bruker公司生产的AXSD8-Focus型X射线衍射仪上进行,主要测试条件为:Cu Kα辐射,Ni滤片,管电压40 kV,管电流100 mA,扫描步长0.02°,扫描速率5(°)/min,扫描范围5°~40°。催化剂的BET比表面积和孔径分布测定在美国Micromeritics公司生产的Tristar-3000型吸附仪上进行,测定前样品先在90 ℃下抽真空预处理1 h,再在300 ℃下预处理3 h,然后在液氮温度下进行N2吸附-脱附等温线测定。催化剂的傅里叶变换红外光谱(FT-IR)在Thermo Nicolet 公司生产的Nexus FT-IR 光谱仪上进行,采用KBr压片法,扫描次数64,分辨率4 cm-1,信噪比30 000∶1,扫描范围4 000~400 cm-1。催化剂的H2程序升温还原(H2-TPR)表征在 XianQuan TP-5079 化学吸附仪上进行,通过TCD检测器检测H2消耗信号;检测前气体通过CaO+NaOH吸附净化,以便除去H2O和CO2等气体;以含H2体积分数8%的 H2/He混合气为还原气,样品用量30 mg,气体流速30 mL/min,最后以10 ℃/min的速率程序升温至900 ℃。
原位漫反射红外光谱(DRIFTS)分析装置由带MCT检测器的傅里叶变换红外光谱仪(Nicolet 6700)、漫反射原位池(ZnSe)及配气系统组成。其具体试验步骤为:称取约50 mg的样品置于原位池中的小坩埚中,在总气体流速为100 mL/min的N2气氛中于500 ℃处理0.5 h,然后冷却至175 ℃,20 min后通入NH3(体积分数500 μL/L)/N2混合气,以100 mL/min的流速吸附0.5 h,记录背景谱图和采样谱图。再通入N20.5 h以移除催化剂表面物理吸附的NH3,然后将NO+O2(NO体积分数500 μL/L,O2体积分数5%)通入到预吸附NH3的La0.015-Cu-SSZ-13催化剂中。采集红外光谱以观察表面稳定存在的吸附物种。检测条件为:扫描范围800~4 000 cm-1,分辨率4 cm-1,扫描次数64 次。
1.3 催化剂性能测试
NH3-SCR试验在微型固定床石英反应器(规格为Φ5 mm×700 mm)中进行。催化剂(20~40目)装填量为80 mg,反应压力为0.1 MPa。进气组成是NO体积分数500 μL/L,NH3体积分数500 μL/L,O2体积分数5.0%,其余为N2。总气体流速为100 mL/min,对应的体积空速为150 000 h-1。反应器出口的NO,NO2,O2,N2O气体组成用英国KANE公司生产的KM.9106型综合烟气分析仪进行在线分析。在反应30 min后达到稳态时进行数据记录。以NO转化率、NO2转化率、N2O转化率和N2选择性作为评价指标。
2 结果与讨论
2.1 XRD表征
图1为催化剂的XRD图谱。由图1可见:La改性Cu-SSZ-13催化剂在2θ为9.5°,14.0°,16.1°,17.8°,20.7°,25.0°处均出现Cu-SSZ-13的特征峰,表明La改性并未引起分子筛晶型结构的变化;XRD谱图中并未出现CuO和La2O3的特征峰,表明Cu和La物种以孤立的离子、氧化物簇或者少量的纳米颗粒的形式均匀分散在催化剂表面和分子筛孔道中。这些特征有利于 SCR 活性的提高。

图1 催化剂的XRD图谱
2.2 N2吸附-脱附表征
图2为催化剂的N2吸附-脱附等温线,表1为催化剂的物理性质。从图2可以看出:催化剂的N2吸附-脱附等温线均为Ⅰ型等温线,具有微孔材料的特征;所有催化剂的N2吸附-脱附过程都是可逆的,N2吸附量由0迅速升高,当达到某一相对压力时,N2的吸附和脱附出现回滞环,表明催化剂中含有介孔;La改性的Cu-SSZ-13对N2的吸附量较Cu-SSZ-13略高,有利于脱硝反应中提高效率。从表1可以看出,La改性后,Cu-SSZ-13分子筛的比表面积小幅增加,其中La0.025-Cu-SSZ-13的比表面积最小,可能与其La含量最低有关,其他催化剂随着La含量的增加,比表面积逐渐增大。Kwak等[4-5]报导催化剂的较大比表面积对NH3的氧化和N2选择性的提高更有利。

图2 催化剂的N2吸附-脱附等温线

表1 催化剂的物理性质
2.3 FT-IR表征
图3为催化剂的FT-IR图谱。从图3可以看出,Cu-SSZ-13和La改性Cu-SSZ-13 的FT-IR谱图均出现了类似的特征峰,表明Cu-SSZ-13经过La离子交换后对分子筛的骨架结构没有影响。波数566 cm-1处为硅氧或铝氧四面体的T—O弯曲振动峰;波数690 cm-1处为双元环的振动峰,归属于分子筛框架中 Si—O—Si或 O—Al—O 的对称振动峰和变形振动峰;波数1 000~1 300 cm-1区间有较强的吸收峰,这是骨架中O—Si—O 或O—Al—O的非对称伸缩振动峰;波数1 700 cm-1处的和缓峰归属为 NH4+中N—H键的弯曲振动;波数3 400 cm-1处为晶体结构中NH4+的N—H 键伸缩振动峰[6],该峰较为宽大,说明分子筛SSZ-13有很强的酸性。没有观察到代表CuO中Cu—O键的振动峰以及非骨架La的峰,且La改性后以上峰位均未发生偏移,说明La原子并未进入分子筛骨架中。按照一般原理,这些高度分散于Cu-SSZ-13催化剂中的La以抗衡离子存在于Cu-SSZ-13分子筛的孔道中。

图3 催化剂的FT-IR图谱
2.4 H2-TPR表征
图4为催化剂的 H2-TPR曲线。从图4可以看出,Cu-SSZ-13在 221,255,845.8 ℃处有3个具有不同峰面积的还原峰,表明孤立的Cu2+分两步被还原(Cu2+→Cu+,Cu+→Cu0)。根据文献[7]报道,221 ℃和255 ℃处的峰归属于在CHA孔结构内部的不稳定的Cu2+还原成Cu+,Cu2+在较低温度时很容易被还原。845.8 ℃处的峰归属于Cu+到Cu0的还原[7],Cu+在低温时很难被还原。如此高的还原温度进一步说明该催化剂具有很宽的操作温度窗口和高温热稳定性。相比Cu-SSZ-13催化剂的H2-TPR曲线,经La改性的Cu-SSZ-13催化剂的低温还原峰向高温方向偏移,但偏移量不大,经La改性后的Cu-SSZ-13在460~500 ℃出现的峰是La-SSZ-13所具有的特征峰。经过La改性的Cu-SSZ-13的还原峰既有原来Cu-SSZ-13的还原峰,也有La-Cu-SSZ-13的还原峰,说明La和Cu发生了协同作用。

图4 催化剂的H2-TPR曲线
2.5 催化性能
在温度为150~550 ℃、体积空速为150 000 h-1的条件下,考察催化剂的标准 SCR脱硝活性,结果见图5。从图5可以看出,Cu-SSZ-13催化剂在175~400 ℃范围内的NO转化率保持在90%以上,表现出良好的脱硝性能,从150 ℃升温,NO的转化率随温度的升高迅速增加,在225 ℃左右达到最高值,然后随着温度的增加 NO转化率缓慢下降,温度高于400 ℃时,NO转化率下降较快。La0.015-Cu-SSZ-13催化剂显示出良好的脱硝性能,150 ℃时NO转化率达到80%以上,在175~450 ℃范围内NO转化率保持在90%以上,而且在此区间NO的转化率下降不明显,表现出比Cu-SSZ-13更高的NO转化率和稳定性;La0.015-Cu-SSZ-13在500 ℃以后NO转化率才有所下降。La0.15-Cu-SSZ-13催化剂也表现出较好的催化性能,在150 ℃时NO转化率达到83.78%,除了在300 ℃时NO转化率略低于Cu-SSZ-13之外,在其他温度时NO转化率均优于Cu-SSZ-13。La0.025-Cu-SSZ-13和La0.10-Cu-SSZ-13催化剂的催化性能较Cu-SSZ-13变化不大。通过分析总结,以La0.015-Cu-SSZ-13催化剂改性效果最明显,在150~500 ℃温度范围内NO的转化率均保持在80%以上,拓宽了Cu-SSZ-13脱硝温度范围,并且提高了催化剂的活性。这主要是Cu与La物种之间的协同作用所致。由于不是所有La改性Cu-SSZ-13均具有明显改善NO转化率的效果,在相同制备条件下选择适宜的硝酸镧溶液浓度对提高NO的转化率至关重要。

图5 催化剂的脱硝活性
为了进一步考察催化剂的选择性,以La0.015-Cu-SSZ-13为催化剂进行NH3-SCR试验,结果如图6和图7所示。从图6和图7可以看出,在150~550 ℃范围内,N2O体积分数低于15 μL/L,NO2体积分数低于5 μL/L,N2选择性均高于98.5%,表明该催化剂具有相当好的N2选择性。

图6 La0.015-Cu-SSZ-13脱硝过程中NO,NO2,N2O含量随温度的变化

图7 La0.015-Cu-SSZ-13脱硝过程中N2选择性随温度的变化
2.6 原位漫反射红外光谱
为了进一步理解低温NH3和NO+O2之间的相互作用,对La0.015-Cu-SSZ-13催化剂进行原位红外光谱表征。将La0.015-Cu-SSZ-13样品加入原位池中,在N2下以10 ℃min的速率升温至500 ℃处理0.5 h,然后降温至175 ℃稳定0.5 h后采集样品的红外光谱,随后通入NH3体积分数为500 μLL的NH3N2混合气,吸附0.5 h后采集样品的红外光谱,最后通入N2吹扫0.5 h后再采集一次样品的红外光谱。NH3在La0.015-Cu-SSZ-13催化剂表面的吸附情况如图8所示。由图8可以看出:当通入NH30.5 h后,在波数3 727,3 594,3 330,3 264,3 168,1 612,1 442,1 259,1 141 cm-1等处均出现吸收峰,其中波数3 168 cm-1处的吸收峰可以归属于吸附在Cu物种上的NH3,而波数3 320 cm-1和3 264 cm-1处的吸收峰则归属于;同时在波数3 727 cm-1和3 594 cm-1处观察到了负峰,这些负峰来源于表面硅醇羟基群和结构羟基群中的O—H伸缩振动[11];波数1 141,1 259,1 612 cm-1处的峰可以归属于Lewis酸性位上的配位态NH3,而波数1 442 cm-1处的吸收峰则归属于吸附在Brønsted酸性位上的。当用N2吹扫0.5 h时,以上所有出峰位置均未发生变化,说明NH3吸收物种很稳定。
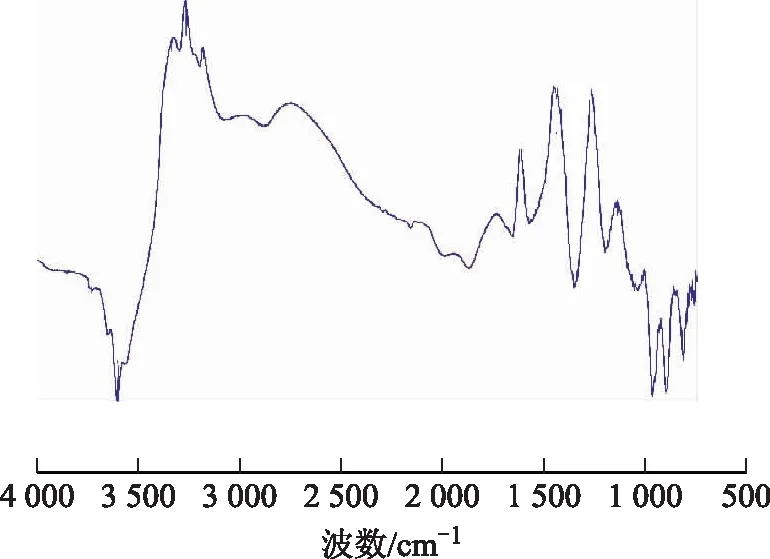
图8 175 ℃条件下通入NH3后La0.015-Cu-SSZ-13表面原位红外光谱(通入NH3 0.5 h时采集)
图9为催化剂La0.015-Cu-SSZ-13在175 ℃预吸附NH3后通入体积分数500 μLL NO和5% O2时不同时间下的红外光谱。从图9可以看出,通入NO和O220 min后,波数3 330,3 264,3 168 cm-1处的峰开始减弱,到40 min时均逐渐消失,同时,波数1 612,1 442,1 259 cm-1处的峰也有所减弱,到60 min时逐渐消失,说明这些峰对应的Lewis酸性位上的配位态NH3和Brønsted酸性位上的NH4+均与NO和O2发生了反应[11-12]。但波数1 141 cm-1处的峰在90 min后仍未消失,说明该峰对应的配位态NH3不参与反应。然后在波数1 280,1 558,1 600,1 671 cm-1处产生新的峰,波数1 671 cm-1处的峰归属于二聚物(NO)2,波数1 600 cm-1处的峰归属于气相 NO2,波数1 280 cm-1处的峰归属于cis-N2O22-[13],波数1 668 cm-1处的峰归属于桥式硝酸盐,波数1 558 cm-1和1 600 cm-1处的峰归属于二齿硝酸盐。将预先吸附了NH3的La0.015-Cu-SSZ-13上通入NO+O2的反应过程的DRIFTS光谱,与其他文献[12,14-15]结果进行对比,认为La0.015-Cu-SSZ-13和Cu-SSZ-13催化剂作用下的反应路径类似,均是通过表面氨物种和硝酸盐物种生成硝酸铵这一中间物种,然后硝酸铵被NO还原生成N2和H2O。
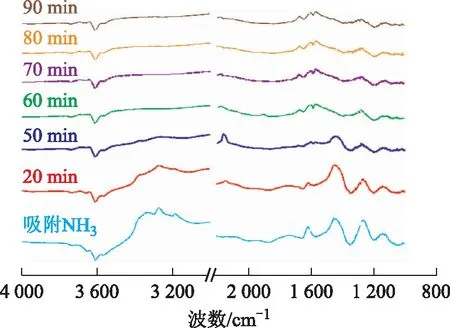
图9 预吸附NH3并通入NO和O2后La0.015-Cu-SSZ-13表面红外光谱随时间的变化
3 结 论
通过一步法制备Cu-SSZ-13分子筛,然后通过液体离子交换法制备4种不同浓度硝酸镧溶液La改性的Cu-SSZ-13分子筛,对La改性催化剂的活性测试结果表明,La0.015-Cu-SSZ-13是4种La改性催化剂中最优的NH3-SCR 催化剂,其在温度175~450 ℃内NO的转化率达到 90%以上,N2选择性也较高。XRD和FT-IR表征结果表明,La改性并未改变Cu-SSZ-13催化剂的晶型和骨架结构。H2-TPR表征结果表明,La改性过程中存在Cu和La的协同作用。原位漫反射红外光谱表征结果表明,La0.015-Cu-SSZ-13和Cu-SSZ-13催化剂作用下的反应路径类似,均是通过表面氨物种和硝酸盐物种生成硝酸铵这一中间物种,然后硝酸铵被NO还原生成N2和H2O。

