植物内生真菌产多糖类天然产物研究进展
潘峰 侯凯 刘云 吴卫
(1. 遵义医科大学 贵州省普通高等学校特色药物肿瘤防治重点实验室,遵义563000;2. 四川农业大学农学院,成都 611130)
多糖(Polysaccharide)是一类由10个以上单糖分子脱水聚合,以糖苷键连接,可形成直链或有分支的长链,水解后得到相应的单糖和寡糖的大分子化合物。虽然多糖种类丰富,结构多样,也是除核酸、蛋白质之外的另一类重要的生物大分子,但对多糖的研究远滞后于核酸和蛋白质,最主要原因是多糖本身的复杂性。与核酸、蛋白质相比,组成多糖的单糖有更多活性基团和手性原子,单糖间有多种连接方式,可形成直链或分支,还有多种异构体、衍生物等,使多糖具有丰富的多样性,大部分多糖具有复杂的结构。而且,多糖链有较高柔韧性和亲水性,易受环境影响发生空间构象变化,在复杂的一级结构基础上,存在大量的分子间作用。结构的多样性使天然多糖具有诸多的生物活性,并广泛参与细胞识别、细胞生长、组织分化、新陈代谢、胚胎发育等生命过程[1]。自从20世纪50年代发现真菌多糖具有抗癌作用以来,陆续发现多糖类化合物具有免疫调节、抗突变、降血脂、降血糖、抗病毒、抗凝血、抗溃疡和抗氧化等生物活性[2]。
植物内生真菌(Endophytic fungi)是指在其全部或部分生活史中存活于健康植物组织内,而不使宿主植物表现出明显感染症状的一类真菌[3]。通常,根据在细胞内外不同存在形式可分为:分泌到培养基的胞外多糖(Exopolysaccharide,EPS),黏附在细胞壁表面的胞壁多糖和在细胞内的胞内多糖。目前,内生真菌和糖生物学是两个研究热点,内生真菌多糖(The polysaccharide from endophytic fungi,PSEF)作为二者的交叉内容也越来越受到人们的关注,相关报道也越来越多。已有研究表明PSEF具有抗氧化、免疫调节、抗癌等功能[4-6]。加强PSEF研究不仅可获得更多具有新型结构和广泛活性的天然多糖产物,也能够帮助人们更深入理解内生真菌与其宿主间的关系和相互作用机理,从而在一定程度上改善植物生长。
据不完全统计,内生真菌均可产生多糖,但种类、产量和活性等差异较大,内生真菌多糖生物合成具有明显菌株差异性[7]。选择产量高,活性好的菌株是研究PSEF的第一步。PSEF多是水溶性的EPS,故对内生真菌水提物重量和活性测定,可初步了解多糖的产量和活性。但要获取多糖的结构信息,必须纯化后才可进一步研究。目前,人们可从内生真菌的发酵液、菌丝体等获得多种多糖成分(表1)。这也表明内生真菌可产生种类多样具有一定生物活性的多糖成分。
1 产多糖内生真菌培养条件
培养基成分,如碳源、氮源、无机离子、氧含量等都会明显影响PSEF产生。在确定发酵菌株后,配制合适的培养基对内生真菌生长和代谢产物的合成非常重要。
碳源(Carbonsource)是微生物营养所需碳元素(碳架)的营养源[27,31]。其来源广泛,但不同微生物利用碳源具有偏好性。其中,利用最广泛的是糖类;其次是醇类、有机酸类和脂类。在糖类中,单糖胜于双糖和多糖;已糖胜于戊糖;葡萄糖、果糖胜于甘露糖、半乳糖。在多糖中,淀粉优于纤维素或几丁质等纯多糖;纯多糖则优于琼脂等杂多糖和其它聚合物(如木质素)。目前,内生真菌所选用的发酵培养基多为马铃薯葡萄糖琼脂(Potato dextrose agar,PDB)培养基,其中主要碳源为土豆淀粉,不仅价格便宜,而且淀粉含量高。除淀粉外,一般会添加适量单糖或寡糖作为补充。如Subhadip等[32]通过单因素试验发现葡萄糖、鼠李糖、半乳糖、果糖、麦芽糖、棉子糖中,当添加鼠李糖时,最有利于菌丝生长,添加葡萄糖时最有利于EPS的产生。此外,Wang等[33]研究发现通过添加甘油或粗甘油可促进内生真菌Chaetomium globosumCGMCC 6882多糖生产能力,其中甘油可能就是作为一种碳源物质影响其产多糖能力。
氮源(Nitrogensource)是微生物生长繁殖所需氮元素的营养源[27]。在真菌合成蛋白质、核酸、生物碱等代谢产物,以及调节酶活性等生化反应中具有不可替代的作用。与碳源相似,真菌能利用的氮源种类即氮源谱也十分广泛。一般来说,内生真菌等异养微生物对氮源利用的顺序是:“N·C·H·O”或“N·C·H·O·X”类有机氮源(如酵母提取物、牛肉提取物、蛋白胨、尿素、甘氨酸和NH4NO3)优于“N·H”类无机氮源(如NH4Cl),更优于“N·O”或“N·O·X”类(如NaNO3、NO2),而最不易被利用的则是“N”类(如N3)。酵母提取物、麦芽提取物、蛋白胨等有机氮源也是内生真菌培养基中主要添加的氮源[8,18,27]。可见,有机氮源比无机氮源更适合内生真菌生产多糖。这可能是有机氮源能够提供丰富的易分解的蛋白质、氨基酸和维生素等物质,满足内生真菌在不同生长发育时期对氮源的需求。
无机盐离子对内生真菌的生长和代谢产物的形成也必不可少。Subhadip等[32]研究不同种类的无机 盐(HgCl2、MnCl2、FeCl3、KCl、BaCl2、NaCl、CaCl2、MgCl2)对内生真菌Fusarium solaniSD5 菌丝体生物量和EPS产量的影响发现,HgCl2和FeCl3显著抑制菌丝的生长和EPS的产生,KCl、CaCl2、MgCl2和NaCl都可促进菌丝量和EPS量的增加,其中KCl效果最好。可见,Hg2+和Fe3+对此内生真菌具有毒性,而且Hg2+可用于内生真菌的分离过程中的植物样品表面消毒。K+、Ga2+、Mg2+和Na+等离子通常参与调节细胞中一些酶的活性,调节培养基的渗透压,调节pH和氧化还原电位等。此外,当在F. solaniSD5的培养基中添加KH2PO4(0.05 g/L)时,EPS也会明显增加[32]。这可能是磷酸盐参与EPS合成关键酶的磷酸化和去磷酸化或者在可控制物质的膜转运proton-ATPase发挥作用。
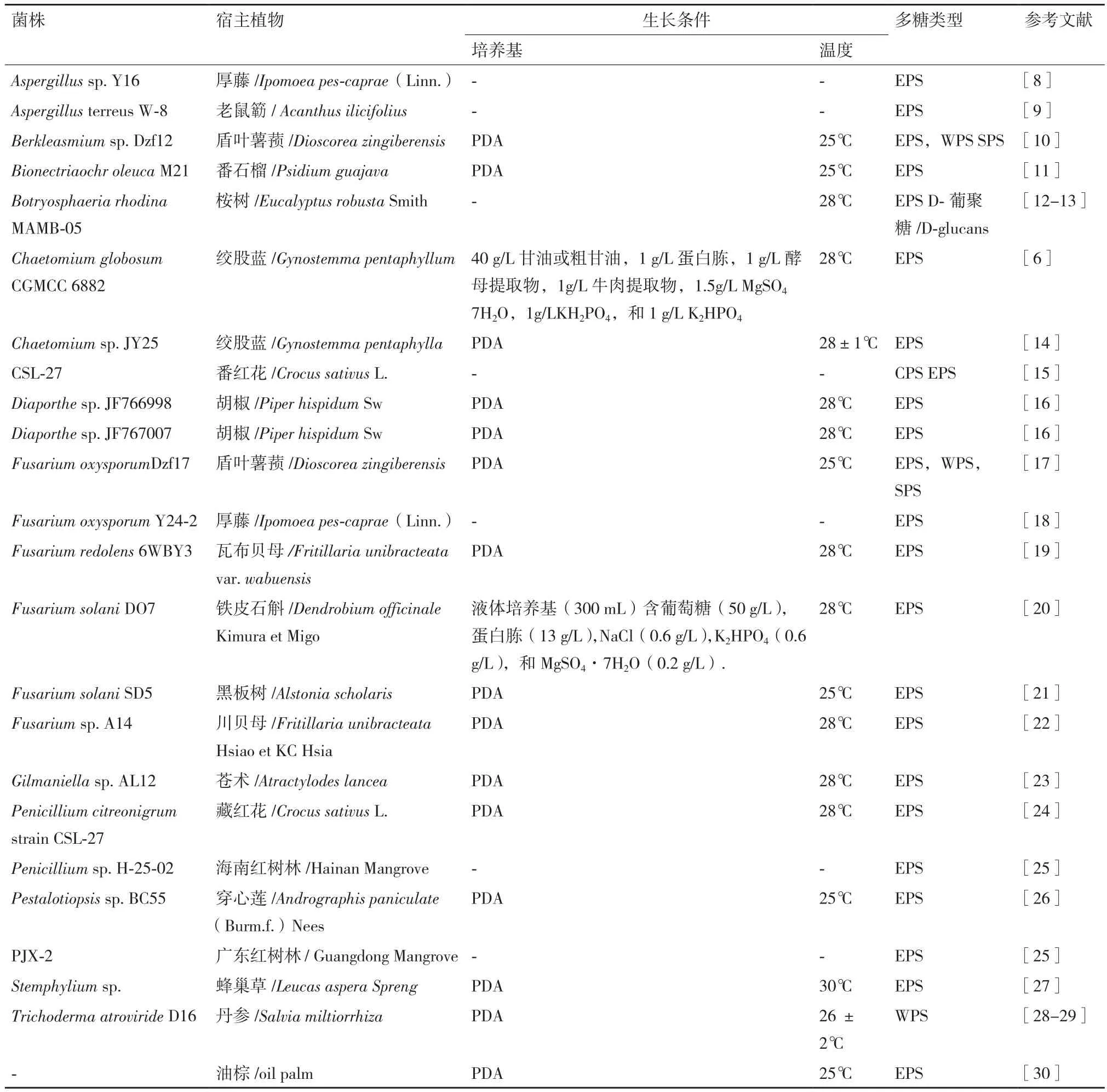
表1 不同植物内生真菌菌株产多糖
培养基的pH值也会影响PSEF的产生。例如,Pestalotiopsissp. BC55在培养基初始pH值从4-8的变化中,其EPS产量呈现先增加,后降低的规律,在pH为4时最小,在pH为7时最大,其生物量和EPS产量分别增加了3.5倍和6.9倍,随后通过响应面法分析,其最佳pH值为6.93[26]。对初始pH值的优化结果表明,内生真菌产EPS的最佳培养基初始pH值在5-7之间,过酸或过碱的环境都不利于PSEF的产生。
氧气也参与到内生真菌发酵代谢过程中。培养基中合适的氧含量对内生真菌正常生长,代谢产物的合成、运输和分泌等都有影响。目前除专业的发酵罐可直接控制培养基中氧气含量外,在普通摇瓶中较难实现精准控制,但通过控制摇瓶中培养基体积和转速可间接控制培养基与空气接触面积,从而影响氧气进入培养基的含量。例如,对内生真菌Pestalotiopsissp. BC55的研究发现,当向320 mL的发酵瓶中添加75 mL培养基时,其菌丝生物量和EPS产量均达到最高,分别较最低值提高了1.3倍和 13.2 倍[26]。
发酵时间和培养温度对PSEF产生有显著影响。内生真菌菌丝生长和多糖等代谢物的产生等生理生化过程均需在一定时间完成。不同培养时间,对PSEF产量、水提物中多糖含量、蛋白质含量、多糖类型和多糖生物活性均有不同影响。例如,分离自胡椒健康叶片中的内生真菌Diaporthesp. JF766998在培养了72、96和168 h后,其粗多糖产量分别为3.0、15.4和14.8 mg/100 mL发酵液;而且随着时间增加,总多糖含量从71%增加到99.8%,蛋白质含量也从28.5%下降到0%;对于单糖组成,在培养72 h时,葡萄糖占84%,随着时间增加,其下降到30%,而半乳糖和甘露糖的含量明显增加[34]。一般发酵时间在4-30 d之间。通常,为提高发酵效率,降低发酵时间,先通过小规模发酵,在真菌生长对数期转接到大规模发酵瓶中,此时,内生真菌生长活力较强,繁殖迅速,可缩短后期发酵所需时间。培养温度可通过影响酶活性,改变内生真菌代谢速率,甚至导致某些代谢过程出现或终止,影响多糖产生,所以合适的培养温度非常重要。由表1可见,尽管不同内生真菌发酵温度略有不同,但是大多数基本处于20-28℃之间,温度过低或者过高均不利于内生真菌的生长和多糖积累[26]。
总之,影响内生真菌生长和PSEF产量的因素存在差异,不同内生真菌受不同因素影响大小有所区别。例如,对内生真菌Berkleasmiumsp. Dzf12 EPS培养基研究发现,葡萄糖、蛋白胨和MgSO4·7H2O浓度是影响EPS产生的关键因子[35]。对内生真菌F.solaniSD5发酵条件优化试验表明葡萄糖浓度(g%)、酵母抽提物浓度(g%)、培养基pH值和发酵天数是影响EPS产生的显著因素(P<0.05)[32]。目前,为得到最佳培养基和最适发酵条件,主要通过响应面分析(Response surface methodology,RSM)来完成,即先通过单因素试验及部分因子设计(Fractional factorial design,FFD)找出最主要的影响因素和其影响范围,然后利用最陡上升法、最陡下降法和中心组合(Box-Behnken design,BBD)试验设计或者中心合成设计(Central composite design,CCD)来获取最佳培养基配比和发酵条件[11,26,32,35]。
2 内生真菌多糖的提取、分离和纯化
2.1 内生真菌多糖的提取
目前,内生真菌多糖的提取根据提取部位的不同存在一定差异。主要涉及胞外多糖、细胞壁和细胞内多糖,其中细胞壁和细胞内多糖可以通过配置不同酸碱度的水溶液,从细胞壁上提取不同类型的多糖。
对于胞外多糖,首先得通过离心或过滤将发酵液和菌丝分开,菌丝用蒸馏水进行冲洗,以清除菌丝中的EPS[11,32]。为减少乙醇用量,发酵液需减压蒸发浓缩[32],随后利用乙醇或异丙醇进行沉淀,且在 4℃环境中静置 12-24 h[8,26,32],也可通过离心代替静置,使沉淀快速分层[8]。
对细胞壁和细胞内多糖,提取方法相对剧烈。首先菌丝干燥后粉碎,有机试剂脱脂,随后依据试验设计配制不同pH的水溶液进行水提醇沉。如果需要同时提取菌丝水提多糖(Water-extracted mycelial polysaccharide,WPS),碱水提多糖(Sodium hydro-xide-extracted mycelial polysaccharide,SPS)和酸水提多糖(Hydrochloric-extracted mycelia polysaccharide,APS),通常以纯水(pH约为7)为第一步,随后再采用碱水(NaOH配置)或者酸水(HCl配置)进行提取,且二者顺序可变。但是需要注意的是纯水提取多糖,温度可高达100℃,而碱水或者酸水均易导致糖链水解,在采用碱或者酸水进行提取时,温度不宜太高,根据本课题组的经验及相关文献参考,建议不要超过30℃。如Zhong等[36]对一株内生真菌F. oxysporumFat9的菌丝多糖进行提取时,预处理后加入20倍体积水,在90℃下浸提约90 min,离心收集上清液,采用醇沉即得水提多糖;残渣再用1 mol/L NaOH溶液在室温条件下提取24 h,离心取上清液进行醇沉得碱提多糖;最后在用1 mol/L HCl在室温条件下提取24 h,得酸提多糖,且3种多糖提取重量相近,均为7 g 左右。
由于内生真菌菌丝多糖存在差异,在料液比、提取温度、提取时间、酸碱度、提取次数上会有不同,为了提高提取效率,可采用单因素和响应面法进行优化。例如,内生真菌CSL-27的菌丝多糖提取过程中,通过单因素试验发现4个关键影响因子,其影响大小顺序为液料比>最终pH>醇沉时间>醇沉温度,最后通过响应面优化,确定最佳醇沉时间为16 h,醇沉温度为37℃,pH为7.2,液料比为5∶1(L/L)[15]。利用响应面法对内生真菌F. oxysporumDzf17菌丝多糖WPS进行提取条件优化发现,提取时间为1.7 h,提取温度为95℃,料液比为 39∶1(V/W),重复提取一次的情况下,最终提取效率较之前提高 2 倍[37]。
2.2 内生真菌多糖的分离纯化
内生真菌多糖的分离纯化主要包含两部分,第一是除去多糖中色素、蛋白质、小分子物质等杂质;第二是利用分级醇沉、离子交换色谱或凝胶色谱进行分离。通常,除蛋白质的方法有Sevag法、三氟三氯乙烷法、盐酸脱蛋白法、三氯乙酸(Trichloroacetic acid,TCA法)、酶法和等电点法等。除色素的方法包括活性炭吸附色素、H2O2氧化除色素、DEAE-纤维素法脱色素、碱性离子交换树脂脱色素、膜分离技术(Membrane separation technipue,MST)和大孔吸附树脂除色素。除去小分子物质通常用半透膜透析法或纤维滤器透析法。除去淀粉常用淀粉酶法。为提高效率,PSEF可用胰蛋白酶或木瓜蛋白酶结合Sevag法除去蛋白[22],用活性炭吸附、双氧水氧化或大孔吸附树脂除色素[6,23],半透膜除小分子物质[22]。其中,利用大孔吸附树脂可同时除色素和除蛋白,而且其条件温和、效率较高、操作相对简单,受到越来越多的欢迎[38]。在多糖分离步骤中,离子交换色谱和凝胶色谱仍是最常用的多糖分离纯化方法,对收集到的馏分利用苯酚-硫酸法进行检视,以馏分管数为横坐标,吸光度为纵坐标,绘制洗脱曲线,并根据曲线合并相同多糖,并且根据多糖峰形可初步判断均一性[39],也可利用高效液相凝胶柱色谱检查多糖的均一性。
3 内生真菌多糖的结构特征研究
多糖由单糖组成,以糖苷键相连,形成线形或分支链状大分子。通常研究多糖结构主要涉及其一级结构,包含糖苷键的组成、单糖残基排列顺序、相邻单糖残基连接方式、异头碳构型、分支状态、有无蛋白质或磷脂等结合物等。由于单糖种类较多,单糖残基间存在多种连接方式,加上多糖链长度、支链等不同,造成多糖种类非常丰富,也导致多糖结构解析相较于小分子化合物而言困难更大。大部分文献仅对所得多糖的部分理化性质,结构特征进行研究。如分离自内生真菌C. globosumCGMCC 6882的多糖 GCP 由阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和葡萄糖醛酸组成,结构复杂,目前仅表征了其部分理化性质[40]。对于一些应用较广、结构相对简单的多糖也能解析出其多糖链中的主要重复单元。例如,胡椒内生真菌Diaporthesp.产多糖EPS-PD1主要由葡萄组成,经过一系列波谱和化学分析,得出其为以(1→3)键连接的吡喃葡萄糖为主链,在O-6处被葡糖基取代的重复结构单元组成的多糖[16]。目前,多糖结构描述主要涉及多糖的表观特征、多糖平均分子量、单糖组成、单糖连接类型、单糖或者糖苷键的构型、重复单元等方面。
3.1 紫外光谱(Ultraviolet spectrum,UV)和扫描电子显微镜(Scanning electron microscope,SEM)分析
分离纯化后所得的均一多糖可利用紫外分光光度计200-400 nm紫外区间的吸光谱,观察260和280 nm的波长处是否存在吸收峰,有则说明样品内存在核酸或者蛋白等成分,没有则表示多糖中无此类杂质。多糖属于大分子成分,不同多糖链所表现出的形态结构具有一定的特征,可利用电子显微镜对多糖表明进行观察。例如,本课题组对瓦布贝母内生真菌多糖进行SEM分析,发现不同多糖表明特征存在显著差异[19]。
3.2 多糖平均分子量(Relative average molecular weight,RMw)分析
均一多糖为多糖分子量在一定范围,多糖链重复单元一致的混合糖链,表示相似链长的平均分布。利用高效液相凝胶柱色谱或者普通的凝胶柱色谱对均一多糖分子量进行分析时,所得到的分子量为其平均分子量的一个推算值。通常用多分散性(Mw/Mn)来评价多糖分子量分布的范围。例如,分离自内生真菌Chaetomiumsp. JY25的均一多糖通过凝胶渗透色谱法测得其平均分子量为1.961×104g/mol,多分散性值为1.838[14]。目前,常见多糖相对分子质量测定方法有光散射法、超速离心沉降速度法、气相渗透法、端基分析法、凝胶渗透色谱法和膜渗透法。其中高效凝胶渗透色谱法由于操作方便、无需有机溶剂、时间短、分离效果好等优势常被用作大分子多糖的分析,是目前最常用的一种相对分子量分析方法。其次是利用常压的凝胶色谱对多糖进行洗脱,根据洗脱曲线进行相对分子量分析。以上两种凝胶法均根据在相同体系条件下不同标准葡聚糖的分子量和保留时间之间的线性关系推算出未知样品的平均分子量。
3.3 单糖组成分析
单糖种类、摩尔比等是研究多糖结构信息的关键步骤。由于多糖以单糖残基连成长链,为分析单糖,首先需对长链进行水解。水解法包括完全酸水解法、部分酸水解法等。完全酸水解法:将多糖与强酸(硫酸、三氟乙酸)等试剂作用,在一定温度下(80-100℃)将所有糖苷键等完全水解(4-10 h)。部分酸水解法:根据不同糖苷键稳定不同,利用弱酸或低浓度的强酸在相对较温和的条件下将较易断裂的糖苷键进行水解,然后利用柱色谱或分级沉淀等方法将水解后的多糖链分开,由于侧链与主链相连的糖苷键较易断裂,多糖部分酸水解后的醇析产物往往是多糖主链重复性结构片段、糖醛酸链片段,从这些小片段可推测多糖链部分结构特点。水解后的多糖经中和、过滤,可采用纸层析(Paper chromatography,PC)、薄层色谱(Thin layer chromatography,TLC)、气相色谱(Gas chromatography,GC)、高效液相色谱(High performance liquid chromatography,HPLC)、高效阴离子交换色谱-脉冲安培检(high performance anionexchange chromatography with pulsed ampero-metric detection,HPAEC-PAD)[8,14,18,26]等进行分析。本课题组曾利用TLC法对川贝母内生真菌Fusariumsp. A14 的胞外多糖A14EPS-1的主链和侧链的单糖组成进行了分析[22],但是该法不能定量,无法得知相关单糖间的摩尔比例。GC法和HPLC法是目前比较常见的用于多糖的单糖组分分析的方法,均可实现定量分析,但是均需进行衍生化。例如,本课题组对瓦布贝母内生真菌6WBY3的胞外多糖6WBY3EPS-3 和 6WBY3EPS-4的单糖组分进行分析时,首先利用PMP(l-phenyl-3-methyl-5-pyrazolone)进行衍生化,然后利用HPLC对衍生化产物进行分析,均获得了其单糖组成和不同单糖间的摩尔比[19],但是如果用质谱(Mass spectrometry,MS)检测器,示差检测器或者蒸发光检测器不用考虑衍生化的问题。Orlandelli等[34]利用HPAEC-PAD法,以CarboPac PA1柱(4×250 mm)为分析柱,以0.014 mol/L NaOH溶液流动相,对内生真菌Diaporthesp.JF766998胞外多糖的单糖组分进行了分析,获得了单糖组分及摩尔比。HPAEC-PAD法无需对样品进行衍生化处理,流动相无需使用有机试剂,但是该法中使用了盐溶液,不可与质谱等检测器联合使用。最后根据样品峰面积和单糖标准品的浓度和峰面积可计算求得单糖间摩尔比。
3.4 单糖结构特征分析
通常,Smith降解、高碘酸氧化、甲基化反应可分析多糖链中糖苷键连接位置。其中甲基化反应应用较多,它不仅可获得多糖中单糖连接位点,还可根据不同甲基化单糖的比例,推测这种连接键型在多糖重复单元中所占比例。例如,对植物内生真菌F.solaniSD5胞外均一多糖PS-1的甲基化分析得出该多糖具有L-鼠李糖基末端,(1→2)-L-鼠李吡喃糖基,(1→4)-D-鼠李吡喃糖基,(1→4,6)-D-鼠李吡喃糖基,其摩尔比接近1∶1∶3∶1[41]。
红外光谱是定性鉴定多糖结构的基本方法,由于灵敏度较高、所需多糖样品量少、操作简单,已经成为最常用的多糖结构特征分析方法之一。可通过红外区的特征吸收来鉴定多糖,如在3 600-3 200、3 000-2 800、1 700-1 500、1 400-1 200 和1 200-1 000 cm-1范围内的吸收峰是多糖的特征吸收峰[42];也可用于分析确定多糖中吡喃糖的糖苷键构型,如对于葡聚糖来说,840 cm-1是α-吡喃糖苷键的特征吸收峰,890 cm-1是β-吡喃糖苷键的特征吸收峰;而810和870 cm-1是甘露糖的特征吸收峰。
3.5 核磁(Nuclear magnetic resonance,NMR)分析
NMR是解析化合物结构最有效的手段,但多糖结构的复杂性使其在这一领域的应用相对落后,近年来NMR技术有了较大发展后才得以提升。该技术可提供多糖的单糖组成、单糖残基间的顺序、单糖残基糖苷键的位置和糖苷键的构型等诸多信息,成为当今分析多糖结构不可缺少的方法。然而,由于多糖结构自身的复杂性,许多多糖NMR信号相互重合,使得NMR的解析十分困难。对于一些由简单的重复单元组成的多糖,利用NMR技术已可做到迎刃而解。多糖在1H-NMR谱图上的信号多集中在δ3.5-5.5 ppm范围内,H2-H6的质子信号在δ3.5-4.5 ppm范围内,但叠加严重无法分辨,因此对于大多数多糖而言,1H-NMR的主要用途在于δ4.8-5.5 ppm范围内异头质子信号的解析及归属。一般情况下,α-构型糖基异头质子的化学位移值超过5.0 ppm,而β-型糖基异头质子的信号小于5.0 ppm,凭此可将二者区分开。借助于异头质子在NMR上的峰面积之比可大体推测各种连接方式糖基在多糖中的摩尔比。此外,通过13C NMR和2D NMR可对多糖的一些重复单元的结构进行解析。常见的二维谱有COSY、HSQC、HMBC、NOESY、TOCSY等。COSY主要分析氢氢近程相关,HSQC主要分析碳氢直接相关,HMBC主要分析碳氢远程相关,NOESY主要分析氢氢空间相关,TOCSY主要分析氢氢全相关。例如,Zeng等[43]对内生真菌F.solaniDO7多糖DY1和 DY2进行NMR分析,并结合甲基化等结果,推导出 DY1中的糖苷键主要包括(1 →)-α-D-Glcp,(1 → 3)-β-L-Rhaf,(1 → 4)-β-DXylp,(1 → 6)-α-D-Glcp,(1 → 2,6)-α-D-Glcp和(1→2)-β-D-Galp;而DY2中的糖苷键主要是(1 →)-β-D-Glcp,(1 → 2)-α-L-Rhaf,(1 → 3)-α-LAraf,(1 → 4)-β-D-Glcp,(1 → 4,6)-β-D-Glcp 和(1 → 3)-α-D-Galp。
4 内生真菌多糖的体外活性研究
4.1 抗肿瘤
肿瘤作为人类健康的一大杀手,利用PSEF来抑制肿瘤的研究相对于其它来源多糖而言较少,但从已有的报道中仍可以发现PSEF对肿瘤细胞具有较好的生长抑制作用,是值得进一步关注的大分子天然产物。Li等[11]对从番石榴的内生真菌Bionectria ochroleucaM21中分到的EPS进行了抗肿瘤活性测定,发现该EPS在浓度为0.025-1.6 mg/mL的范围内对人体肝癌HL-7702细胞系没有抑制活性,但是在0.1-0.45 mg/mL的浓度范围内,对肝癌HepG2细胞系,胃癌SGC-7901细胞系和结肠癌HT29细胞系有良好的抑制活性,并且随浓度和处理时间的增加抑制活性增强。Wen等[44]对从藏红花中分离到的内生真菌Penicillium citreonigrumCSL-27的粗EPS的抗肿瘤活性进行了研究,发现它对K562、A549、HL-60和HeLa细胞系均有良好的抑制增殖活性,而且具有明显的剂量依赖,在浓度为10 mg/mL时,该多糖对K562、A549、HL-60和HeLa细胞系的增殖抑制率分别为46.16%、44.97%、44.95%和33.10%。Wang等[6]以甘油(GCP-1)和粗甘油(GCP-2)为辅助营养成分,利用内生真菌C. globosumCGMCC 6882进行生物合成分别得到GCP-1和GCP-2两个多糖样品,活性研究发现该多糖对人类肺癌A549细胞系具有良好抑制活性。本课题组曾对川贝母内生真菌Fusariumsp. A14的EPS进行了系列分离纯化并得到两个均一多糖A14EPS-1和A14EPS-2,抗肿瘤细胞增殖试验发现A14EPS-2表现出中等的抑制人肝细胞癌HepG2细胞系的活性[22]。相对小分子天然产物而言,多糖的抗肿瘤活性较弱,但是,由于PSEF产量比小分子化合物高数十倍,甚至上百倍,且毒性低,使得从内生真菌中筛选和开发具有抗肿瘤活性的多糖具有重要的理论和实际意义。
4.2 抗氧化
氧自由基,又称为活性氧(Reactive oxygen species,ROS),是普遍存在于人和动植物体内的代谢副产物[45]。过量的活性氧会引发细胞膜磷酸酯质过氧化,蛋白质氧化,核酸损伤和酶的失活,诱发细胞调亡等[46],从而引起一系列疾病,如癌症、不育症、心脏病、阿尔茨海默病等,而且还会加速生物体衰老[47-49]。从自然界中寻找高效、安全低毒的抗氧化剂就显得十分重要。研究表明,PSEF具有广泛的抗氧化活性,是一类极其重要的抗氧化剂来源。Chen等[8]对一株红树林内生真菌Aspergillussp. Y16的EPS研究,得到均一多糖成分As1-1,其具有良好的二苯基苦酰肼基(1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧自由基清除能力。Li等[4]对从盾叶薯蓣内生真菌F. oxysporiumDzf17代谢产物中得到的EPS、水提取菌丝多糖(WPS)和氢氧化钠提取的菌丝体多糖(SPS)的抗氧化测定发现,SPS多糖抗氧化活性最强,其DPPH自由基清除活性EC50为63.37μg/mL,亚铁离子螯合活性EC50为44.91 μg/mL。Mahapatra 和 Banerjee[21]对一株从糖胶树Alstonia scholaris分到的内生真菌F. solaniSD5的均一胞外多糖成分PS-I的抗氧化活性进行研究,发现该多糖具有较强清除DPPH自由基的活性,而且安全无毒,是一种潜在的无毒外源抗氧化剂。本课题组对川贝母内生真菌A14的两个均一胞外多糖A14EPS-1和A14EPS-2抗氧化活性研究发现,其均表现出对DPPH自由基和ABTS自由基的清除活性[22]。Wang等[50]发现分离自当归的内生真菌Alternaria tenuissimaF1的EPS表现出较强超氧阴离子和羟基自由基清除活性,而且还具有良好的还原活性。此外,本课题组研究了多株分离自瓦布贝母的内生真菌的EPS发现,其均具有一定的清除自由基等抗氧化活性[19,39]。综上可见,植物内生真菌多糖的抗氧化活性普遍存在,这不仅有助于PSEF在医药和食品保健品等领域的开发与利用,而且,自由基或活性氧在植物体内表现出广泛的生理生化作用,探索该类多糖抗氧化能力在与植物共生过程中所起作用的研究也非常有意义。
4.3 抗菌
Wang等[40]研究发现,分离自中药植物绞股蓝的内生真菌能够产生抗菌活性多糖,通过分离纯化得到均一多糖GCP,其通过破坏内膜和增加细胞渗透性发挥抗菌活性,但对细胞壁没有影响,该多糖对大肠杆菌和金黄色葡萄球菌的MIC分别为1.75和0.67 mg/mL。Zeng等[20,43]从来源于铁皮石斛茎中内生真菌F. solaniDO7发酵产物中分离到两个多糖DY1和DY2,均表现出优异的抗菌活性,特别是对金黄色葡萄球菌和大肠杆菌有很强的抑制活性。但是本课题组对多株川贝母内生真菌多糖进行了抗菌研究,未发现其多糖有抗菌作用,说明并非所有多糖都具有此类活性。
4.4 其它活性
除上述生物活性外,研究还发现PSEF还具有抗炎、抗过敏、免疫增强、益生元等生物活性。Mahapatra和Banerjee研究了内生真菌F. solaniSD5均一胞外多糖PS-I在不同剂量饲养大鼠30 d后肠(粪)细菌的浓度,与对照相比,发现可显著降低Clostridium perfringens的浓度[32]。进一步研究发现多糖PS-1在剂量浓度为10、100和1 000 μg/mL时,膜稳定化的百分比分别为27.46±4.22%、45.08±2.80%和55.05±5.68%,二者间呈显著相关性,且多糖PS-1活性与标准药物吲哚美辛相当,可见PS-I可保护细胞膜免受有毒物质的影响,并通过抑制炎症介质形成来干扰早期炎症反应;对体外大鼠肠系膜肥大细胞保护研究表明,与对照相比,化合物48/80在剂量浓度为4 μg/mL时使肥大细胞发生脱离,而多糖PS-1可以抑制化合物48/80介导的肥大细胞脱离,并表现出明显的量效关系。因为化合物48/80是肥大细胞中强有力的组胺释放剂,多糖PS-1具有显著的肥大细胞稳定活性,从而间接抑制了组胺释放,表现抗过敏活性[41]。Li等[24]对藏红花内生真菌P. citreonigrumCSL-27的粗胞外多糖进行了分离纯化,得到一个均一水溶性胞外多糖EPS-2,发现该多糖显著减弱庆大霉素诱导的HEIOC1细胞损伤,增加斑马鱼细胞的存活率,显示出保护耳蜗毛细胞免受毒性物质侵害的活性。Zeng等[20]对铁皮石斛内生真菌F. solaniDO7产生的两个多糖DY1和DY2活性研究发现,DG2对人胚肾细胞无明显细胞毒作用,还可增加TNF-α、IL-6和iNOs mRNA的表达,而这可进一步促进RAW264.7中TNF-α、IL-6和NO的产生,可见DG2具有强大的免疫活性。
5 内生真菌多糖与宿主植物间的作用
植物为其内生真菌提供营养和生活场所,同样部分内生真菌也能帮助宿主植物抵抗逆境,甚至影响宿主植物的生长发育[51]。越来越多的研究表明PSEF不仅具有广泛的体外生理活性,而且还能够刺激宿主或非宿主植物某些化合物的产生或者产量的增加。例如,Li等[52]研究了内生真菌Dzf12的EPS、WPS和NaOH提的SPS以及通过水解作用分别得到 EOS(EPS-derived oligosaccharide)、WOS(WPS-derived oligosaccharide) 和 SOS(SPS-derived oligosaccharide)3种低聚糖共6种糖对盾叶薯蓣无菌苗和盾叶薯蓣细胞悬浮培养时合成薯蓣皂苷元的影响,发现其均可提高薯蓣皂苷元产量,但是受多糖浓度影响明显,其中浓度为20 mg/mL的EOS可使细胞合成的薯蓣皂苷元产量提高6.88倍。同样,从盾叶薯蓣中分离得到的另外一株内生真菌F.oxysporiumDzf17的EPS、WPS和NaOH提的SPS也均有提高盾叶薯蓣细胞悬浮培养时薯蓣皂苷元的产量,其中以水提多糖的促进作用最强[17]。丹参根部内生真菌Trichoderma atrovirideD16不仅本身可以产生丹参酮I(T-I)和丹参酮IIA[29],而且该菌株多糖可刺激其宿主植物丹参毛状根的生长和宿主植物细胞丹参酮I(T-I)和丹参酮IIA的生物合成[28]。从苦荞分离得到的一株内生真菌F. oxysporumFat9菌丝多糖和EPS也均可刺激宿主植物黄酮类产物的积累,同时提高苦荞麦提取物的抗氧化活性[36]。内生真菌Gilmaniellasp. AL12可刺激Atractylodes lancea产生挥发油,深入研究发现该菌株产生的甘露聚糖有助于该菌株和A. lancea之间形成拮抗平衡,甘露聚糖的一部分被降解为甘露糖以进行己糖激酶活化,促进光合作用和能量代谢,潜在的代谢通量流向萜类生物合成;另一部分通过G蛋白介导的信号转导和甘露聚糖结合凝集素途径直接增强了A. lancea的自身免疫,在随后的防御反应中促进了挥发油的积累[23]。可见,内生真菌多糖成分在其与宿主植物相互作用的过程中扮演了重要作用。
6 展望
内生真菌是一类极其重要的微生物资源,具有非常丰富的生物多样性,而且每种内生真菌均具有产多糖能力,也使得内生真菌产生的多糖具有广泛的多样性。目前,大型真菌多糖的研究相对较多,部分多糖结构也基本明确,而且由于多种大型真菌本身就作为食物长期使用,开发出的大型真菌多糖产品(如香菇多糖片等)市场接受度好。自1993年,Stierle等[53]从内生真菌中发现可以产紫杉醇的菌株开始,内生真菌才广泛的引起人们的注意。而内生菌多糖的研究只有几十年的历史,研究还相对落后。例如,内生真菌据推测有100万种左右[54],但到目前为止,根据不完全统计分离得到的内生真菌均一多糖不足40个(表1)。关于多糖结构、活性、工业化生产、产品开发等方面内生真菌还远不如大型食用真菌。但是,在大型真菌上的研究成果可以为内生真菌多糖的开发提供借鉴。而且,大型真菌主要属于担子菌亚门,少数属于子囊菌亚门,国内报道的食用菌不到100种,有药用价值的真菌仅有30多种[55],大型食用真菌多糖主链主要为葡聚糖和甘露聚糖[56],而植物内生真菌无论在生物多样性上还是在其多糖类型上都远多于大型真菌。同样PSEF和其它类型真菌多糖一样,也具有广泛的生理活性,表现出极大的开发价值。加强对内生真菌多糖的研究,有助于内生真菌多糖产物的开发利用。
内生真菌可以与植物和谐共存,而多糖作为内生真菌产量较大的天然产物之一,对植物和内生真菌间相互作用产生重要影响,加之多糖所具有的多重生理功能,如信号调节、免疫增加、渗透压调节等,使得以PSEF为化学物质基础来探讨植物与内生真菌间相互作用的机制具有重要意义。目前,此类研究较少,仅有通过体外获得PSEF,然后将其作为植物或植物细胞等培养的添加剂,以促使植物或植物细胞增加抗逆活性,刺激特定化合物产量提高。加强植物内生真菌多糖在内生真菌与宿主植物间相互作用中所扮演角色的研究,不仅有助于理解内生真菌如何避免植物免疫体系的作用又不对植物造成损害,而且还有助于利用多糖产物间接影响宿主植物生长发育。
内生真菌在脱离原来的生活环境后,在反复的纯培养过程中,会发生菌株的退化,这会导致内生真菌代谢发生改变。例如,从平贝母中分离到的内生真菌P7在反复培养后其产生物碱的能力就大大下降[57]。但是至今未见研究内生真菌在退化过程中其产多糖能力改变的相关报道。此外,尽管内生真菌可产生丰富的多糖,但是目前仍缺少将其投入到工业化生产的实例,加强对其开发力度也很有必要。
总之,目前关于PSEF研究尚处于起步阶段,以内生真菌为出发点,研究其多糖结构、生物学、生理生化等方面的功能正在成为内生真菌研究的一个热点,也必将取得丰硕成果。

