高通量筛选地衣芽孢杆菌DW2高产杆菌肽诱变菌株
米粱波 曾伟主 黄科学 王得明 堵国成 周景文 陈坚
(1. 江南大学生物工程学院,无锡 214122;2. 齐鲁制药(内蒙古)有限公司,呼和浩特 010080)
杆菌肽是一种由枯草芽孢杆菌和地衣芽孢杆菌产生的多肽类广谱抗生素,由多种环状同系物组成,包括杆菌肽A、B1、B2、B3、C1、C2、C3和F,其中杆菌肽A和B占有95%抗菌活性[1]。杆菌肽A易转变成无抗菌活性的杆菌肽F,且杆菌肽F具有肾毒性[2]。在实际生产过程中,为避免杆菌肽A的降解,通常在发酵终点添加Zn2+等二价金属离子,将杆菌肽转变成抗菌活性更强和更稳定的“金属-肽”螯合物[3]。杆菌肽对革兰氏阳性和部分革兰氏阴性细菌都具有强的抑菌活性,且对人和动物都没有致病性,因而广泛应用在临床医学和作为常用的动物饲料添加剂[4]。
杆菌肽的生产是一个复杂的生物转化过程,一般利用基因工程技术,通过理性改造提高杆菌肽产量的做法比较困难。目前工业上提高杆菌肽生产的方法主要集中在发酵优化和诱变选育。例如,采用正交试验和Box-Behnken响应面法对杆菌肽发酵培养基中主要原料豆粕粉或麸皮的添加量进行优化[5-6]。在此基础上,通过控制变量的方式优化杆菌肽发酵的温度、溶氧和pH以获得最佳发酵条件[7-8]。而应用传统诱变选育的方式,筛选到杆菌肽产量比对照提高的突变菌株,为杆菌肽的工业生产奠定了基础[9]。然而,随着杆菌肽生产工业化进度的深入,使利用发酵优化和传统诱变选育提高杆菌肽产量的选择更加受限。另外,自2004年地衣芽孢杆菌的全基因组测序完成以后,基因工程技术逐渐被应用在杆菌肽生产的研究中[10]。根据提高杆菌肽合成前体氨基酸的胞内含量来促进杆菌肽合成的思路,过表达葡萄糖-6-磷酸脱氢酶基因zwf,通过提高NADPH/NADH比例来保证杆菌肽前体氨基酸的胞内供给,继而实现杆菌肽效价的提高[11]。同样,通过失活或过表达支链氨基酸胞内外转运蛋白基因yhdD和brnQ,也实现了对杆菌肽合成的改善[12-13]。但遗憾的是,基因工程菌可能涉及到生物安全问题,并且简单的分子操作对工业生产菌株的育种效果往往并不明显[14]。从微生物育种技术的发展史来看,传统诱变选育由于筛选通量低和人工负担重的限制,影响了其在选育优良菌株方面的应用。随着高通量筛选(High-throughput screening,HTS)技术的兴起与发展,其作为传统诱变选育技术的升级,实现了诱变选育工作的自动化、规模化和小型化。总之,HTS技术解决了传统诱变选育“筛”的问题,并在大规模筛选和不需要了解产物合成遗传背景的优势下,用来提高杆菌肽这种次级代谢产物的产量,势必将具有更加广阔的前景。
在本研究中,采用常压室温等离子体(Atmospheric and room temperature plasma,ARTP)对细胞进行诱变,并借助流式细胞仪(Flow cytometer,FCM)分选出诱变后的活细胞至96孔板中培养。根据杆菌肽分子中酰胺键能与铜离子在碱性环境下反应的化学性质,建立了双缩脲反应结合三氯醋酸(Trichloroacetic acid,TCA)沉淀的高通量初筛方法。利用酶标仪检测反应颜色,快速锁定阳性突变,极大的提高了筛选的通量和缩短了育种的周期。总之,本研究提供了一种提高杆菌肽产量的新方法,并可以应用于其他多肽产品的研究。
1 材料与方法
1.1 材料
1.1.1 菌株 地衣芽孢杆菌(Bacillus licheniformisDW2,DW2菌株),由齐鲁制药(内蒙古)有限公司提供。
1.1.2 主要仪器 FACSAriaTMⅢ流式细胞仪,美国BD公司;ARTP 仪,无锡源清天木生物科技有限公司;Cytation3 酶标仪,美国 BioTek 公司;安捷伦 1260高效液相色谱,美国 Agilent 公司。
1.1.3 培养基 液体培养基(g/L):酵母浸膏20、氯化钠5、硫酸镁0.5;固体培养基(斜面):在液体培养基中加2%的琼脂粉;发酵培养基(g/L):豆粕粉60、玉米淀粉40、花生饼粉5、玉米干浆2、玉米浆2、碳酸钙4、硫酸铵1和高温淀粉酶0.1。上述培养基全部用2 mol/L氢氧化钠调pH值至7.5,并在121℃条件下灭菌20 min。
1.2 方法
1.2.1 ARTP诱变 挑取地衣芽孢杆菌平板单孢子至液体培养基中,37℃、220 r/min培养至OD600=1.2-1.4。取1 mL菌液离心收集细胞,用5%的甘油作为保湿剂的生理盐水洗涤3次,并取1 mL上述溶液重悬。取10 μL细胞溶液均匀涂抹至无菌载片表面,在放电功率100 W和氮气流量10 SL/min的条件下,分别处理 0 s、15 s、30 s、45 s、60 s、80 s、100 s和120 s。然后,将载片转移至装有PBS缓冲液1 mL的EP管中,充分振荡洗脱。将洗脱的菌液适当稀释,并取100 μL涂布至固体平板培养基上,37℃恒温培养24 h计数。
1.2.2 高通量初筛流程 利用FCM将单细胞分选至装有200 μL液体培养基的96孔板中,37℃、750 r/min培养20 h。取100 μL培养好的种子液转接至装有1 mL发酵培养基的48深孔板中,37℃、220 r/min发酵培养54 h。发酵结束后,加入15%的TCA溶液1 mL,在220 r/min条件下振荡2 min充分混匀,在室温静置30 min使沉淀充分。然后,将深孔板在4℃、4 500 r/min条件下离心15 min,取发酵上清液80 μL至新的96孔板中,并与120 μL双缩脲试剂反应5-10 min。最后,利用酶标仪在548 nm波长下检测吸光值,根据吸光值大小判断出高产的突变菌株。
1.2.3 摇瓶复筛 将初筛得到的突变菌株,取其96孔板保藏的种子液均匀涂布在固体斜面表面,37℃恒温培养27 h。菌体斜面用3.5 mL无菌水充分洗脱并使细胞均匀分散,取1 mL菌液接种至装有20 mL发酵培养基的250 mL摇瓶中,37℃、220 r/min发酵培养48 h,高效液相色谱(High performance liquid chromatography,HPLC)检测发酵液中杆菌肽效价。
1.2.4 死细胞染色条件优化 挑取平板活化的单孢子至液体培养基中,37℃、220 r/min培养至OD600=1.2-1.4。利用PBS洗涤和重悬细胞,并将细胞溶液沸水浴20 min。取100 μL沸水处理的细胞溶液 分 别 和 0 μL、10 μL、20 μL、40 μL、60 μL、80 μL和100 μL体积的 50 μg/mL的PI储存溶液(PBS配制)混合均匀,然后再用PBS定容至200 μL后放置冰里避光,分别反应0 min、10 min、20 min、30 min、40 min、50 min和60 min。染色结束后,立即取出染色的细胞溶液并用PBS定容至1 mL使染色停止。利用FCM分析染色结果,阳性信号比例越高则染色效果越好,信号比例由软件自动计算显示。
1.2.5 FCM分选方案 为更好的进行单细胞分选,分选前合适的圈门逻辑是实现好的分选效果的保证。首先,创建收集荧光信号的散点图FCS-A/PerCPCy5-5-A,坐标为信号对数值。利用不经过染色的空白对照设置电压,使细胞的本底荧光信号集中在101以内。其次,保持电压不变,将阳性对照样品上样分析。创建PerCP-Cy5-5-A直方图和FSC-A/SSC-A散点图,在FSC-A/SSC-A散点图中设门圈中信号,并调整门的位置和大小。当观察到PerCP-Cy5-5-A直方图为类似标准的正态分布形状时,此时圈中信号的门最佳。在分选之前应先创建FSC-A/FSC-H 和SSC-A/SSC-H散点图,去除目标细胞群中的粘连细胞信号。
1.2.6 双缩脲试剂制备 根据文献[15]配制双缩脲试剂。
1.2.7 分析方法 发酵液中的杆菌肽效价用HPLC检测,检测方法与文献[1]报道的一致。发酵样品先与40 g/L的EDTA溶液等体积混合,在4℃条件下反应2 h,杆菌肽的总效价通过计算杆菌肽A和杆菌肽B的总峰面积得到。
2 结果
2.1 ARTP致死曲线绘制
由放电产生的等离子体,可在室温下导致细胞膜通透性增加,进而损伤DNA。细胞致死曲线表明(图1),ARTP处理15 s时,细胞的致死率为26%。处理时间为15 s-100 s时,细胞致死率增加缓慢,而当处理时间超过100 s,不超过120 s时,细胞的致死率增加明显。这种增长可能与亚致死效应的增强有关,而此时有利于造成DNA的损伤。因此,选取100 s、110 s和120 s三个时间点来构建突变细胞文库,与之对应的细胞致死率在70%-80%左右。

图1 ARTP诱变致死曲线
2.2 HTS方法的建立
本研究取120 μL杆菌肽标准溶液与80 μL双缩脲试剂混匀显色,光谱扫描显示双缩脲反应颜色在548 nm处出现光吸收峰值(图2-A)。配制杆菌肽标准品梯度溶液,与双缩脲试剂充分反应后在548 nm处检测吸光值(图2-B)。结果表明,在杆菌肽浓度和吸光值之间有很好的相关性(R2=0.995 89)。为排除发酵液中杂蛋白对显色的干扰,本研究选择TCA作为沉淀剂。取1mL 15%的TCA溶液与深孔板发酵液振荡混匀并充分沉淀。取80 μL沉淀处理后的发酵上清液,与120 μL双缩脲试剂充分混匀反应,在548 nm处检测吸光值。随机取深孔板发酵液并用HPLC检测杆菌肽效价,验证深孔板中杆菌肽效价与吸光值之间相关性(图3)。结果表明,HPLC检测的杆菌肽效价与多孔板检测的吸光值之间有较好相关性(R2=0.945 28)。因此,可选择用15%的TCA溶液1mL沉淀深孔板发酵液,再用沉淀处理后的发酵上清液80 μL与120 μL双缩脲试剂反应作为高通量初筛方法。
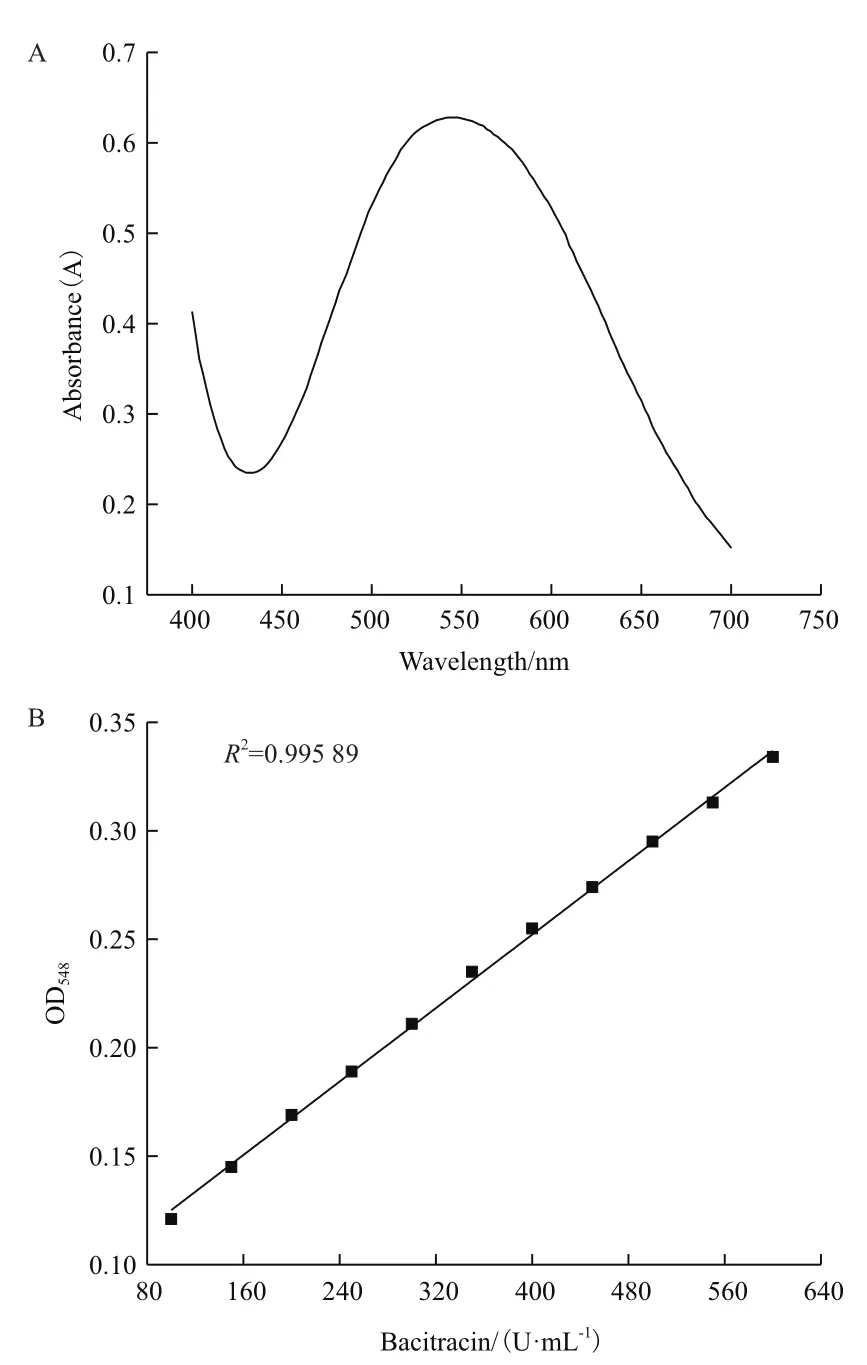
图2 双缩脲反应的光谱扫面和标准曲线

图3 多孔板检测和HPLC检测的相关性
2.3 PI染色和FCM分选
优化PI染色死细胞条件的结果如表1所示。随着PI溶液体积的增加和避光染色时间的延长,阳性信号的比例逐渐增加。而当PI储液体积大于40 μL且染色的时间超过20 min时,阳性信号的比例不再增加或明显增加。另外,为避免PI染色诱变后的活细胞,将PI染色死细胞的条件确定为100 μL细胞溶液与40 μL的PI溶液在200 μL的体系中置冰上避光染色20 min。最后通过优化的染色条件和设置合理的圈门方案,将细胞分选至96孔板中,可在固体培养基上观察到生长出单菌落(图4)。经过实践检验,此分选方案可使细胞的回收率平均达95%以上。

表1 PI染色死细胞条件优化

图4 在96孔板中生长的细胞
2.4 HTS杆菌肽高产菌株
在本研究中,将20块96孔板的1 920株突变菌株,通过高通量初筛选出14株菌用于摇瓶复筛,摇瓶中检测到最高杆菌肽效价的菌株直接用于下一轮诱变筛选。此外,用HPLC检测筛选出的14株菌其深孔板发酵液效价,并以诱变次数为横坐标作图(图5)。当诱变至第11代时,筛选到了深孔板发酵杆菌肽效价最高的突变菌株。当诱变至第6代时,筛选到第一株能够稳定遗传的杆菌肽高产菌株1#7E(图6-A和6-B),相对出发菌株提高10.8%。然后继续在高产菌株1#7E的基础上诱变至第8代获得8#6D和7#5E,相对出发菌株都提高20.9%。最后在诱变至11代时,获得高产菌株6#7E、5#8D和2#5F,分别相对出发菌株提高20.8%、19.7% 和22.2%,并通过遗传稳定性验证,最终确定为高产杆菌肽菌株,杆菌肽最高效价为912 U/mL(图6-C和6-D)。继续诱变至第15代,但未能筛选到杆菌肽产量进一步提高的突变菌株。

图5 高通量初筛

图6 摇瓶复筛
3 讨论
通常情况下,优良菌株的获得主要依靠两种策略:一是通过随机诱变结合定向筛选获取有用突变菌株;二是基于对目标产物代谢过程的理解,通过代谢工程和基因工程改造获得有用工程菌株。前者随着筛选策略和方法的发展而得到加强,后者则随着组学技术和基因工程工具的发展而得到加强。微生物学的发展使第二种方法的应用取得了巨大的成功,但对于多数工业菌株的改良而言,由于它们本身已优于利用第二种方法改造的菌株,所以仍然以第一种方法作为主要手段。
HTS技术对于利用第一种方法进行微生物育种变得越来越重要,特别是高通量培养(High-throughput cultivation)技术,解决了细胞在微型容器生长和发酵过程中关于溶氧和染菌等问题。本研究利用96孔板生长培养和48深孔板发酵培养,可以保障细胞的正常生长与发酵,为HTS技术的应用提供了可能。与此同时,HTS技术不仅仅以生产力作为筛选的唯一结果导向,培养的规模化为在筛选过程中考察细胞形态、生长周期和发酵过程的颜色甚至气味变化提供了途径,有利于扩展我们对微生物细胞的认知。除此之外,规模化的特点使利用HTS技术选育环境中有用微生物同样具有优势。FCM自20世纪问世以来就作为研究细胞的工具而得到广泛的应用,现如今FCM已发展成HTS育种的一部分[16]。本研究在FCM的帮助下,以每150 s分选96个单细胞至96孔板的速度分选,极大的节省了时间,并满足了HTS的需要。与通常情况下利用FCM分选携带荧光信号的细胞不同,本研究分选未携带荧光信号的细胞,需克服背景信号的干扰问题。通过设置空白和阳性对照进行合理的圈门,有利于划清与无效信号的界限,继而提高细胞的回收率。目前,功能最为完善的FCM可以同时分析超过50种荧光,从而能对样品中稀有细胞进行快速富集。实际上,由于选择合适的荧光标签能够区分不同类或生理状态的细胞,所以特异性染色或表达内源荧光通常对于目标细胞的筛选有事半功倍的作用。本研究结合FCM分选来满足基于多孔板HTS的需要,却对FCM分析功能的利用非常有限,这为我们下一步工作提供了改进的空间。
对于杆菌肽合成调控的认知通常停留在由Spo0A,AbrB和σH组成的三组分管理系统[17]。但由于全局调控因子AbrB的改造影响细胞生长的其他过程,所以对于杆菌肽合成调控的研究依然是个难题[18]。地衣芽孢杆菌DW2的全基因组测序已经完成,比较基因组学(Comparative genomics)将在地衣芽孢杆菌的基因组学研究中起着重要的作用[18]。将全基因组重测序与HTS育种相结合,发现有利于杆菌肽合成的变异位点并解析相关突变基因的功能,从理论上指导进一步提高杆菌肽的积累是可行的。与此同时,通过菌株工程能够在复制、转录和翻译水平上,实现对指定途径进行遗传多样性的随机操作,争取从建构突变文库方面寻找新的突破口[19]。因此,基于上述调查,HTS技术将在杆菌肽产量的研究中继续发挥作用。
4 结论
本研究建立了一种FCM协助下的HTS方法,基于ARTP诱变获得突变菌株文库,并成功从文库中筛选出杆菌肽高产菌株。这个方法的主要特征在于建立的双缩脲显色结合TCA沉淀的高通量初筛方法,并筛选到杆菌肽产量提高超过20%的地衣芽孢杆菌DW2突变菌株。利用FCM将单细胞分选至96孔板中,保证了细胞分选后的活性,使细胞回收率达到95%以上,极大的扩大了筛选规模,从而缩短了育种的周期。

