MRI及扩散加权成像对微囊型脑膜瘤与非典型脑膜瘤的鉴别诊断价值
孙秋,柯晓艾,周青,韩蕾,周俊林
兰州大学第二医院放射科,兰州大学第二临床医学院,甘肃省医学影像重点实验室,甘肃兰州 730030;*通讯作者 周俊林 lzuzjl601@163.com
微囊性脑膜瘤(microcystic meningioma,MCM)是一种罕见的脑膜瘤亚型,占颅内脑膜瘤的1.6%[1],为 WHOⅠ级肿瘤。非典型脑膜瘤(atypical meningioma,AM)约占颅内脑膜瘤的5%~7%[2],为WHOⅡ级肿瘤。两者均可发生囊变,且肿瘤边界、水肿程度及强化方式等影像学表现常交叉重叠,鉴别诊断存在困难[3]。与MCM相比,AM具有一定的侵袭性且复发率较高(5年复发率达40%),治疗主要采用手术切除并辅以放疗[4-5]。因此,术前对两者进行准确诊断非常重要。近年来,应用扩散加权成像(DWI)对脑膜瘤亚型的鉴别取得了一定的进展[6],但关于MCM与AM的鉴别诊断鲜有报道。本研究拟探讨MRI征象及DWI定量参数鉴别MCM与AM的诊断价值,为临床诊断及治疗提供依据。
1 资料与方法
1.1 研究对象 回顾性分析2013年6月—2019年5月兰州大学第二医院经手术后病理证实的MCM及AM患者,纳入标准:①经手术病理证实的MCM或AM,临床及病理资料完整;②术前1个月内行头颅MRI检查,包括平扫、增强扫描及DWI序列。排除标准:①MRI检查前接受过手术或其他治疗;②MRI图像质量不满足诊断需求。最终纳入MCM患者25例,其中女17例,男8例;年龄17~78岁,平均(57.5±10.9)岁。AM患者50例,其中女29例,男21例;年龄13~70岁,平均(56.7±12.3)岁。临床表现:头痛、头晕29例,活动障碍或肢体麻木14例,视物模糊11例,癫痫发作8例,听力下降7例,其他表现6例。所有患者检查前均签署知情同意书。
1.2 仪器与方法 使用Siemens 3.0T Verio MR扫描仪,75例患者均于术前接受T1WI、T2WI、T2WI-液体衰减反转恢复序列(T2WI-FLAIR)、DWI及增强扫描。扫描参数:梯度回波:T1WI(TR 550 ms,TE 11 ms),层厚5.0 mm,层间距1.5 mm,视野260 mm ×260 mm,矩阵256×256;TSE:T2WI(TR 2200 ms,TE 96 ms),回波时间10 ms,回波链长度8,激励次数2。T2WI-FLAIR:TR 9000 ms,TE 110.0 ms,层厚5.0 mm,层间距1.5 mm;DWI(SEEPI序列):加频率选择脂肪抑制技术,TR 4000 ms,TE 100 ms,层厚5 mm,层间距1 mm,视野260 mm×260 mm,矩阵256×192,在x、y、z轴3个方向上施加扩散梯度,b值取0、1000 s/mm²。对比剂采用钆喷酸葡胺注射液0.1 mmol/kg,流速3 ml/s,获得轴位、矢状位和冠状位增强T1WI。
1.3 图像分析与测量 所有病例图像均采用盲法分析,由2名从事10年以上MRI影像诊断工作的影像诊断医师完成,结论不一致时由第3位医师做出分析。分别记录肿瘤部位、最大径、分叶征、肿瘤囊变、瘤周水肿、瘤脑界面、脑膜尾征、强化均匀性。根据DWI原始图像经计算机后处理得到重建表观扩散系数(ADC)图,根据T1WI、T2WI以及增强图像确定病变实性成分。于ADC图中绘制感兴趣区,并避开病灶内肉眼可见的囊变坏死、出血及水肿区,在每个层面放置3~4个类圆形感兴趣区(ROI),面积为20~30 mm2,分别测量每个ROI的ADC值并取平均值。测量每个病灶的平均ADC值及对侧脑白质平均ADC值,并除以对侧脑白质平均ADC值后得到相对ADC值(rADC)。
1.4 病理检查 患者接受肿瘤全切或次全切术,术后两组病例标本经4%甲醛溶液固定,石蜡包埋,切取3.0~4.0 μm厚石蜡切片,进行HE染色。免疫标记包括上皮膜抗原(epithelial membrane antigen,EMA)、波形蛋白染色、神经胶质纤维酸性蛋白、S-100蛋白等。
1.5 统计学方法 采用SPSS 23.0软件,计量资料以表示,组间比较采用独立样本t检验;计数资料比较采用χ2检验,绘制各参数的受试者工作特征(ROC)曲线,计算曲线下面积(AUC)后确定不同参数诊断脑膜瘤亚型的临界值,以P<0.05为差异有统计学意义。
2 结果
2.1 影像特征分析 MCM和AM发病部位常见于大脑镰及矢状窦旁、幕上凸面、嗅沟及前颅底、鞍区、桥小脑角区及幕下凸面,两者组间差异无统计学意义(P>0.05);MCM与AM的肿瘤最大径差异无统计学意义(P>0.05)。两组分叶征、肿瘤囊变、瘤周水肿及瘤脑界面差异有统计学意义(P<0.05);两组脑膜尾征、邻近骨质改变及强化均匀性等比较,差异均无统计学意义(P>0.05,表1)。
2.2 病理结果 病理镜下MCM肿瘤细胞呈梭形或卵圆形,胞突细长,排列稀疏呈漩涡状,瘤细胞间空泡融合成微囊,囊腔充满黏液样物质,肿瘤间质可见薄壁血管透明样变性(图1),Ki-67指数<5%。AM肿瘤细胞呈卵圆形,细胞较密集,胞界不清,部分区域可见灶状坏死,核质比例增大,核仁明显,核分裂象>4/10HPF(图2),Ki-67指数<25%。所有瘤体EMA、波形蛋白染色均呈阳性。
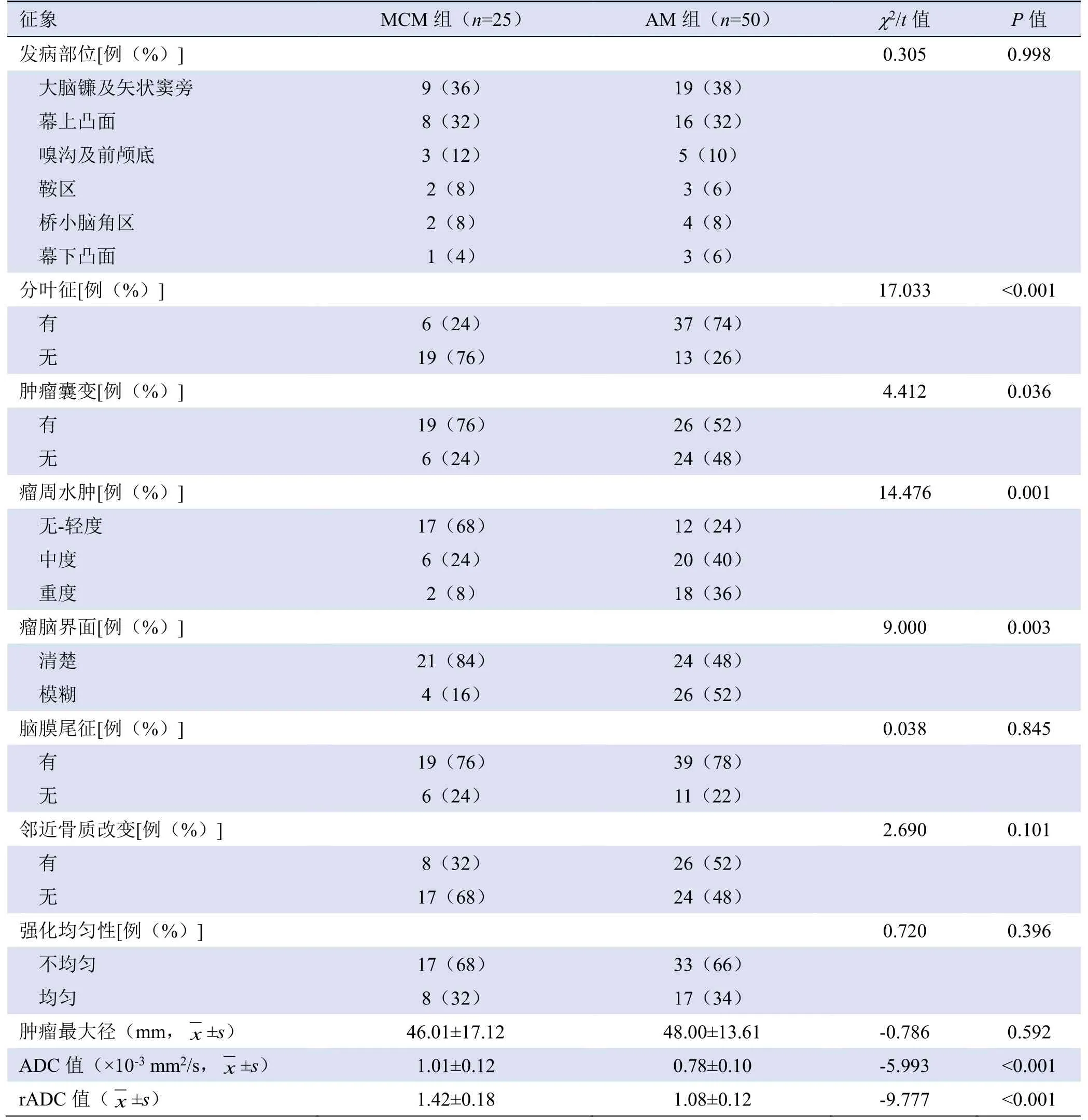
表1 MCM组与AM组患者MRI征象及ADC值比较
2.3 常规MRI表现 25例MCM中,19例(76%)MRI表现为以囊性成分为主的长T1、长T2信号肿块,肿瘤内见多发囊变,伴有分隔,周围无或轻度水肿,增强扫描呈网状强化;6例(24%)表现为长T1、长T2信号的实性肿块,瘤内囊变坏死少见,周围无或轻度水肿,增强扫描呈中度或明显强化(图1)。50例AM中,26例(52%)表现为等、稍长T1,等、稍长T2信号的囊实性肿块,肿瘤内囊变坏死多见,周围伴有中度或重度水肿,增强扫描呈不均匀明显强化(图2);24例(48%)表现为等、稍长T1,等、稍长T2信号的实性肿块,周围伴有中度或重度水肿,增强扫描强化较均匀。
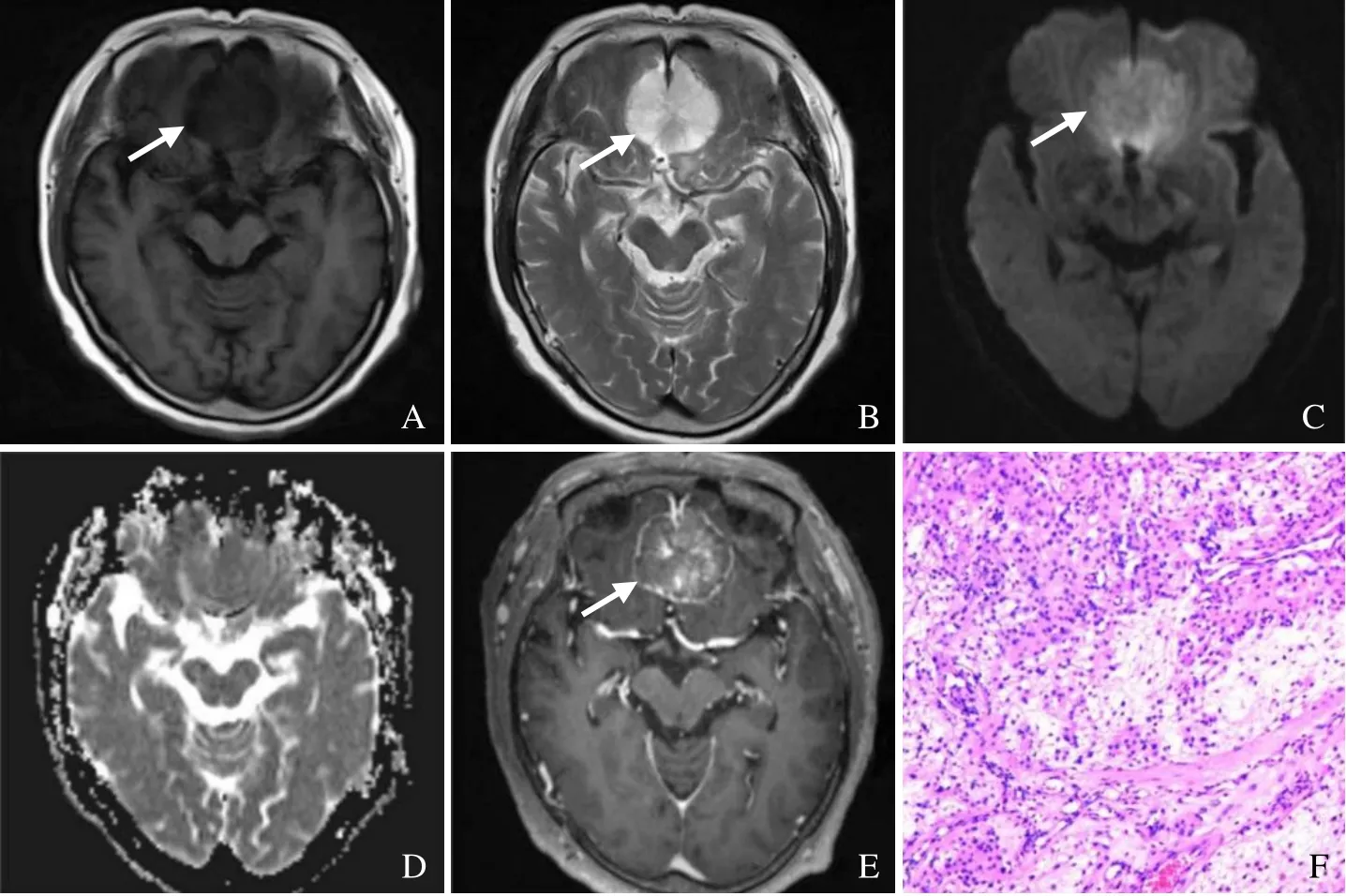
图1 女,73岁,MCM。横轴面T1WI示双侧额叶跨中线生长类圆形低信号影(箭,A);T2WI示病灶呈均匀高信号,瘤脑界限清晰,周围无水肿(箭,B);DWI实性部分呈稍高信号(箭,C);ADC呈等低信号,ADC值为1.02×10-3 mm2/s,rADC值为1.45(D);增强扫描病灶不均匀中度强化(箭,E);病理镜下见瘤细胞丰富,胞突细长,背景疏松,呈黏液状,似小囊(HE,×200,F)
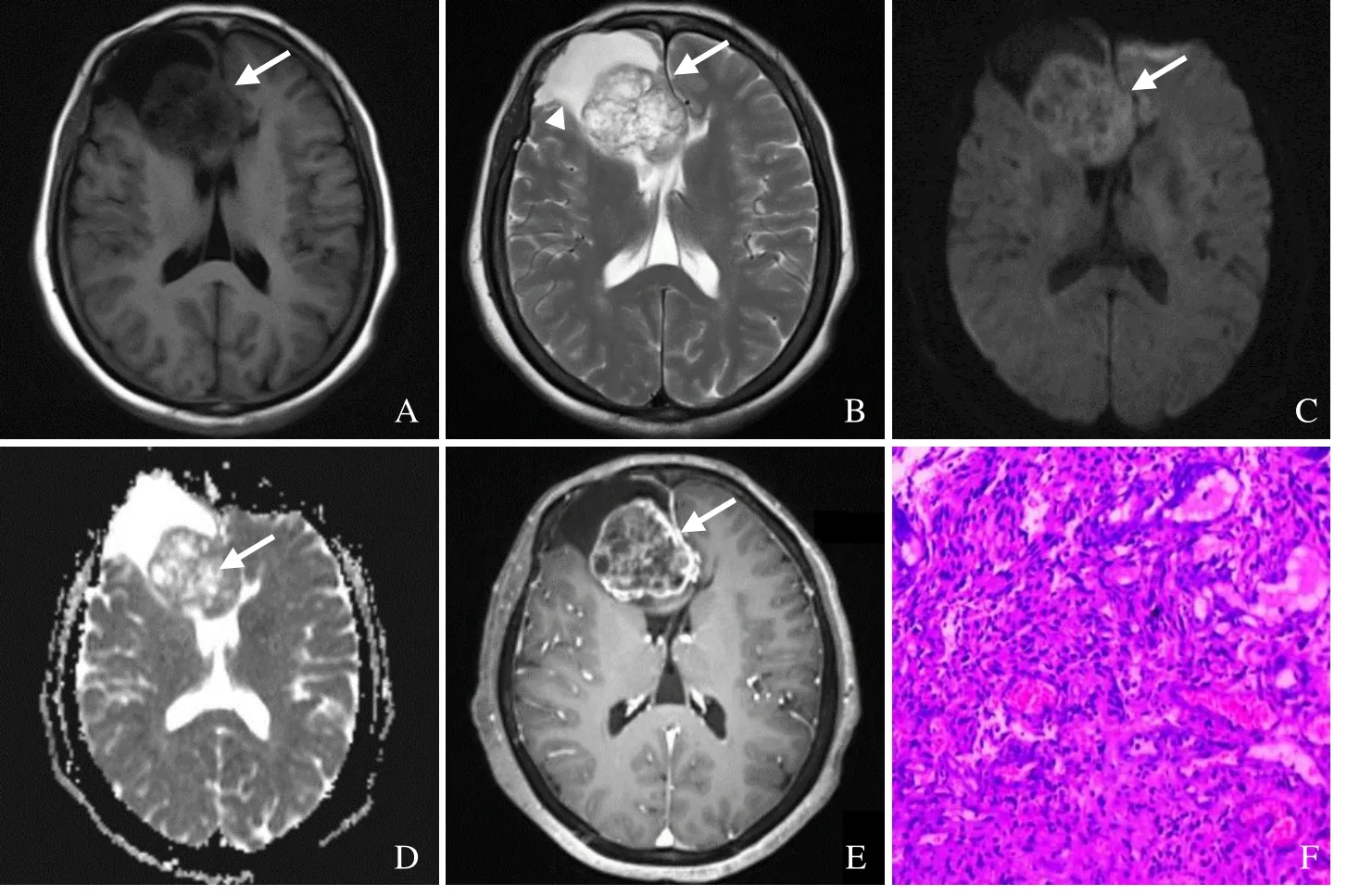
图2 男,64岁,AM。横轴面T1WI示右侧额部低信号影(箭,A);T2WI示病灶呈不均匀高信号(箭),瘤脑界限清晰,周围可见脑脊液样高信号(箭头,B);DWI示不均匀高信号(箭,C);ADC呈不均匀等低信号,内见多发片状高信号(箭),ADC值为0.78×10-3 mm2/s,rADC值为1.04(D);增强扫描病灶呈分叶状不均匀明显强化(箭,E);病理镜下见梭形细胞呈束状编织状排列,局部形成漩涡样结构,核呈短梭形(HE,×200,F)
2.4 DWI信号强度及ADC值 25例MCM中,6例(24%)肿瘤实性成分在DWI上呈高信号,15例(60%)呈稍高信号,4例(16%)呈等信号;50例AM中,24例(48%)肿瘤实性成分在DWI上呈高信号,19例(38%)呈等信号,7例(14%)呈稍高信号。MCM与AM各参数比较见表1,MCM组的ADC值及rADC值均大于AM组,差异有统计学意义(P<0.01)。
2.5 ADC值及rADC值的鉴别诊断效能 ADC阈值为0.91×10-3mm2/s时,其鉴别诊断MCM与AM的敏感度为88%,特异度为92%,AUC为0.960;rADC阈值为1.10时,其鉴别诊断MCM与AM的敏感度为100%,特异度为84%,AUC为0.950(图3)。
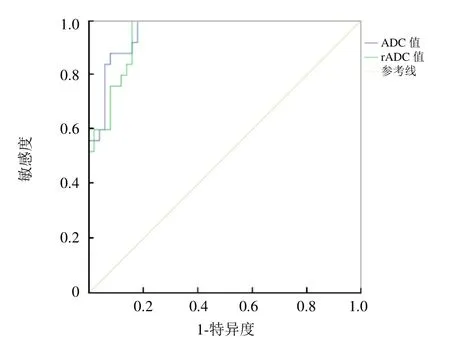
图3 ADC值及rADC值鉴别诊断MCM与AM的ROC曲线
3 讨论
MCM与AM是两类不同的脑膜瘤亚型,其中WHOⅡ级的AM侵袭性更强、疾病进展更快,甚至在手术完全切除后仍具有很大的复发风险[7]。在术前准确诊断MCM与AM能够为临床制订手术方案和治疗提供重要依据。由于两者均可伴有囊变坏死,影像学表现类似,曾有学者将其作为一类囊性脑膜瘤进行研究[8],也有研究发现在临床工作中易将MCM误诊为AM[9]。本研究结果表明,结合患者的MRI征象及DWI可提高术前诊断MCM与AM的准确性。
既往研究显示,WHOⅡ级较WHOⅠ级脑膜瘤的分叶征更加明显[10],与本研究结果相符,本研究中AM形态多不规则呈较明显分叶(74%),仅有少数MCM存在分叶征(24%),这可能是因为AM中瘤细胞增生活跃使肿瘤内增殖细胞分布不均,在各方向生长速度的各向异性导致肿瘤形态不规则。本研究结果显示,MCM囊变发生率(76%)高于AM(52%),与既往研究结果一致[3]。可能是由于MCM瘤细胞呈稀疏漩涡状排列,细胞间隙内含水样液,与细胞内含空亮的脂质等形成大量的微囊腔样结构,因此瘤体柔软并含水丰富[11],与MCM在MRI中常表现为长T1、长T2信号一致。吉子拉洛等[12]对255例脑膜瘤的影像学特征进行对比分析,结果发现肿瘤形态不规则、严重的瘤周水肿及强化不均匀是恶性脑膜瘤(WHOⅡ/Ⅲ)的独立预测因素。本研究结果显示,AM(76%)发生中-重度瘤周水肿占比高于MCM(32%),进一步验证了既往研究中恶性脑膜瘤的瘤周水肿明显重于良性脑膜瘤。瘤周水肿的发生与瘤内静脉充血及因肿瘤压迫而对邻近脑组织造成的缺血有关,其中高级别脑膜瘤中血管内皮生长因子的过表达和肿瘤分泌与肿瘤周围水肿的程度密切相关。本研究中52%的AM表现为瘤脑界面模糊,而仅有少数MCM(16%)瘤脑界面欠清,与既往研究一致[3,10]。分析其原因可能为良性脑膜瘤呈膨胀性生长仅对周围脑组织形成推挤,而AM的肿瘤细胞可向周围侵袭性生长并破坏正常脑组织。本研究结果显示,MCM与AM的脑膜尾征及邻近骨质改变均无明显差异,与童鹏飞等[10]的研究结果一致。但既往研究发现AM较MCM更易引起不同程度的骨质破坏[3],可能与纳入样本量不同有关。而在强化均匀性方面,与本研究结果不同,吉子拉洛等[12]研究显示恶性组脑膜瘤不均匀强化比例显著高于良性组,可能与其纳入较多脑膜瘤亚型有关。
近年来,DWI利用水分子的扩散运动幅度的改变,提供肿瘤内部微环境信息。随着肿瘤内细胞密度增加、核浆比升高、细胞外间隙变小,可引起水分子扩散受限,进而导致ADC图像上的信号强度降低,因此ADC值有助于多种脑肿瘤的分级分型及鉴别诊断。本研究中MCM患者的ADC值及rADC值均显著高于AM,与既往部分研究结果一致[13-14]。Surov等[13]对49例脑膜瘤进行研究发现平均ADC的阈值为0.85×10-3mm2/s时,可区分Ⅰ级和Ⅱ/Ⅲ级脑膜瘤,其敏感度、特异度分别为72.9%、73.1%。Azizyan等[14]研究发现,MCM的ADC值与其他WHOⅠ级脑膜瘤相似,并明显高于非典型/间变型脑膜瘤(P<0.01),分析其原因可能是MCM网状结构中充满水肿样液导致细胞外水分子运动幅度较高,而AM瘤细胞更致密、水分子运动受限更明显而导致ADC值较低。Barrett等[15]研究认为rADC值更稳定,能够减少不同成像技术及参数导致的误差,较绝对ADC值具有更高的敏感度及特异度,本研究中rADC值对两组脑膜瘤的诊断效能也支持以上观点。在实际工作中,rADC的测量需额外测量其他部位的ADC值,且需要进一步计算结果,因此推广性不如ADC值高。此外,部分MCM病例在DWI图中信号高于AM,但其ADC值及rADC值仍高于AM,这可能与DWI中的T2穿透效应有关[16],因此在DWI诊断中需联合测量ADC值消除T2穿透效应对诊断的影响。
本研究存在以下不足:纳入样本量较少,所得结果可能存在偏倚;未结合多模态MRI指标,如DTI、DKI、PWI等进一步对MCM与AM进行研究;本研究仅对MCM与AM进行了对比分析,需进一步对血管瘤型脑膜瘤、血管周细胞瘤等与AM进行对比分析。
总之,MR征象结合DWI对于MCM与AM的鉴别诊断具有一定的价值,其中瘤脑界面、瘤周水肿、分叶征以及囊变坏死等征象结合DWI中的定量参数可有效鉴别MCM与AM,有助于术前提高MCM与AM鉴别诊断的准确率,为临床诊疗提供更加可靠的参考依据。

