茶树CsWRKYIIcs转录因子的克隆及功能分析
肖罗丹,唐磊,王伟东,高岳芳,黄伊凡,孟阳,杨亚军,2,肖斌
(1西北农林科技大学园艺学院,陕西杨凌 712100;2中国农业科学院茶叶研究所,杭州 310008)
0 引言
【研究意义】茶树(Camellia sinensis(L.)O.kuntze)起源于我国西南地区,是一种重要的叶用经济作物[1]。全国的茶树种植分为四大茶区,跨度大、范围广,茶树在生长过程中易遭受高温、高盐、干旱等非生物胁迫的伤害,如干旱胁迫使茶树叶片脱水变枯,导致茶氨酸、儿茶素等含量减少,严重影响其品质成分的积累,降低经济效益[2]。因此,鉴定出茶树中的抗性基因,对利用分子育种技术定向筛选和培育抗性品种有重要研究价值。【前人研究进展】WRKY是植物重要的转录因子家族之一,因具有高度保守的WRKY结构域得名。根据不同数量的WRKY结构域和不同类型的锌指结构将WRKY分成I、II、III家族,I家族有2个WRKY结构域和C2H2(C-X4-5-C-X22-23-H-X-H)型锌指结构;II家族有1个WRKY结构域及与I家族相同的锌指结构类型;III家族有1个WRKY结构域,且含与I、II家族不同的C2HC(C-X7-C-X23-H-X-C)型锌指结构。依据系统发育分析和氨基酸序列差异,II家族可进一步分为IIa—e等5个亚家族,其中IIc亚家族具有1个高度保守的WRKY结构域和C-X4-C-X22-23-H-X-H型锌配体[3-5]。近年来,大量研究表明,植物中不同WRKY家族成员受病菌、干旱、高盐、高温和外源激素等诱导表达,参与多种植物对生物或非生物胁迫的抗性[6-10],其中IIc亚家族成员也参与对多种胁迫的响应过程,如拟南芥AtWRKY8、AtWRKY48、AtWRKY50、AtWRKY51和AtWRKY57对茉莉酸和水杨酸介导的信号通路有应答作用[11],棉花GhWRKY33、GhWRKY39、GhWRKY93、GhWRKY110和GhWRKY114参与低温、盐碱、干旱、外源脱落酸(ABA)等非生物胁迫的响应[12]等。【本研究切入点】目前,茶树中的WRKY基因家族已有报道[13-15],研究了不同WRKY的功能[16-22],表明WRKY与茶树的生长发育和胁迫响应密切相关。茶树的WRKY家族基因众多,笔者课题组通过对茶树高盐、干旱和高温胁迫下转录组数据分析,发现多个IIc亚家族基因差异表达,推测其在茶树响应非生物胁迫的过程中具有重要作用。【拟解决的关键问题】基于茶树基因组数据库(http://tpia.teaplant.org/)中注释的WRKY序列设计特异性引物,从‘陕茶1号’茶树中克隆CsWRKYIIcs的cDNA序列,并进行一系列的生物信息学分析,探究不同组织和胁迫下的表达模式,验证其转录活性,为后续深入研究抗逆机理提供理论参考。
1 材料与方法
试验于2018—2019年在西北农林科技大学园艺学院茶学实验室进行。
1.1 植物材料、生长条件和胁迫处理
2018年6月底于人工气候室对‘陕茶1号’一年生扦插苗进行水培预培养,生长条件:昼夜温度25℃/20℃,相对湿度70%—80%,光强度300 μmol·m-2·s-1,光周期为昼夜12 h/12 h。8月底时茶苗生长状况良好且萌发出新芽,选取生长势一致的健壮茶苗随机分成4组,每组30株,分别置于4个水培箱中进行高盐、模拟干旱、高温及外源脱落酸胁迫处理。高盐处理:将茶苗的根部全部浸入含200 mmol·L-1NaCl的溶液中;模拟干旱处理:将茶苗的根部全部浸入含20%PEG 6000的溶液中;高温处理:茶苗置于40℃的人工气候室;外源脱落酸处理:将ABA(少量95%乙醇溶解)溶于蒸馏水配制成100 μmol·L-1的溶液,均匀喷施于茶苗叶片。每个处理在0、1、2、4、8、12、24和48 h时取不同株的芽下二至三叶3—5片混匀分成3份,液氮速冻于-80℃冰箱备用。另从多株未处理的茶苗中,取初开的花朵、未木质化的嫩茎、嫩根和顶芽下第二叶各0.1 g用于组织表达分析,材料液氮速冻于-80℃冰箱保存[23-24]。
1.2 茶树CsWRKYIIcs的克隆
基于茶树基因组数据库(http://tpia.teaplant.org/)中注释的WRKY序列,以拟南芥IIc亚家族(https://www.arabidopsis.org/)的序列作为查询序列,经本地BLAST检索及冗余性检查后,获得9个CsWRKYIIcs亚家族基因。利用在线IDT网站(https://sg.idtdna.com/calc/analyzer)从基因序列起始密码子前和终止密码子后的非编码区设计特异性引物(表1),以‘陕茶1号’叶片cDNA为模板进行RT-PCR扩增,反应程序为94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 70 s,35个循环;72℃延伸7 min。将胶回收得到的PCR产物连接至pMD-19T克隆载体,并转化大肠杆菌DH5α,挑选阳性克隆送北京奥科鼎盛生物科技有限公司测序。
1.3 生物信息学分析
在ORF finder网站(http://www.bioinformatics.org/sms2/orf_find.html)分析开放阅读框。利用ExPASy网站(https://web.expasy.org/)分析理化性质。在WOLF PSORT网站(https://wolfpsort.hgc.jp/)进行亚细胞定位预测,并利用cNLS Mapper网站(http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)进行核定位信号预测。利用Meme suite 5.0.5(http://memesuite.org/)在线预测motif基序。DNAMAN 6.0.3.99进行氨基酸序列比对,并用WebLogo(http://weblogo)生成保守域序列logo图。利用MEGA7软件中邻接法(NJ)构建系统进化树,bootstrap值设置为1 000,并 利 用EvolView(http://120.202.110.254:8280/evolview/)修饰进化树。利用GSDS2.0网站构建外显子-内含子结构(http://gsds.cbi.pku.edu.cn/)。截取基因ATG上游约2 000 bp启动子区域,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件。
1.4 实时荧光定量分析
采用CTAB法[24]提取茶树不同组织及胁迫处理的总RNA,保存于-80℃备用。用5×All-In-One RT Master Mix试剂盒(abm,加拿大)合成cDNA第一链作为模板,茶树基因CsActin作为内参[16],设计9个CsWRKYIIcs的定量引物(表1),按照Eva Green 2×qPCR Master Mix-ROX试剂盒(abm,加拿大)使用说明在QuantStudio®5荧光定量PCR仪进行qRT-PCR分析,反应条件为95℃ 3 min;95℃ 30 s,60℃ 70 s,40个循环。每个样品设3个技术重复,用2-ΔΔCT法分析数据[25],用SPSS 26统计分析,GraphPad Prism 8.0.1作图。
1.5 转录活性验证
利用NovoRec® Plus PCR一步定向克隆试剂盒(Novoprotein,中国)分别将9个茶树CsWRKYIIcs的cDNA序列融合至pGBKT7表达载体上的GAL4 DNA结合域,引物见表1,构建pGBKT7-CsWRKYIIcs重组表达载体。通过PEG/LiAc法将重组表达载体转入Y2HGold酵母感受态细胞中,在SD/-Trp缺陷固体培养基上30℃倒置培养3—5 d,观察酵母菌落生长情况。挑取单菌落接种于SD/-Trp缺陷液体培养基中,在30℃下250 r/min振荡培养约24 h,取3 μL点在SD/-Ade/-His及含X-α-gal的SD/-Ade/-His缺陷固体培养基上,于30℃倒置培养3—5 d,根据菌落生长情况及是否变蓝来验证转录活性。以pGBKT7-53+pGADT7-T作为阳性对照,pGBKT7作为阴性对照[17,19]。
2 结果
2.1 茶树CsWRKYIIcs的克隆及理化性质分析
以‘陕茶1号’cDNA为模板进行RT-PCR扩增,得到9条大小在500—1 000 bp不等的特异性条带(图1),将其纯化后分别连接到pMD-19T克隆载体,挑取阳性单克隆测序,获得9条CsWRKYIIcs的cDNA序列,依次命名为CsWRKYIIc1—CsWRKYIIc9,用于后续试验分析。
理化性质分析表明,9个茶树CsWRKYIIcs的开放阅读框长度分别为561、960、936、978、897、912、720、1 008和969 bp,分别编码186、319、311、325、298、303、239、335、322个氨基酸。蛋白质相对分子质量为21.098(CsWRKYIIc1)—36.952kD(CsWRKYIIc8)。CsWRKYIIc1、CsWRKYIIc4、CsWRKYIIc7的理论等电点大于7.0,是碱性蛋白;而CsWRKYIIc2、CsWRKYIIc3、CsWRKYIIc5、CsWRKYIIc6、CsWRKYIIc8、CsWRKYIIc9的理论等电点小于7.0,是酸性蛋白。平均疏水性指标均为负值,说明它们是亲水性蛋白。另外,核定位值区间及亚细胞定位预测显示9个基因均定位于细胞核(表2)。

表1 克隆、荧光定量和构建酵母载体引物Table 1 Primers of cloning, qRT-PCR and constructing yeast vectors
图1 CsWRKYIIcs的RT-PCR扩增Fig.1 RT-PCR amplification of CsWRKYIIcs

表2 CsWRKYIIcs的理化性质分析Table 2 Physicochemical analysis of CsWRKYIIcs
2.2 CsWRKYIIcs的序列比对分析
9个茶树CsWRKYIIcs蛋白的氨基酸序列比对结果显示(图2-A),9个蛋白均具有一段高度保守的WRKYGQK序列,CsWRKYIIc7的C2H2型锌指基序缺少“H-X-H”在内的部分氨基酸残基,其他蛋白均具有完整的C-X4-C-X23-H-X-H型锌配体。此外,WebLogo分析WRKYGQK序列及C2H2型锌指结构出现频率高(图2-B),进一步验证了WRKY结构域和锌指结构的高度保守性。
2.3 进化树及保守基序分析
9个茶树CsWRKYIIcs亚家族成员与拟南芥AtWRKY家族成员(https://www.arabidopsis.org/)系统进化树分析见图3,茶树CsWRKYIIcs与拟南芥IIc亚家族成员聚集,除CsWRKYIIc1外,其他茶树成员两两成对,说明9个CsWRKYIIcs均属于IIc亚家族,并且在茶树中可能发生了复制。

图2 CsWRKYIIcs的氨基酸序列比对分析Fig.2 Amino acid sequence alignment of CsWRKYIIcs

图3 CsWRKYIIcs和AtWRKYs的进化树分析Fig.3 Phylogenetic analysis of CsWRKYIIcs and AtWRKYs
9个茶树CsWRKYIIcs与水稻(7条)、玉米(3条)、葡萄(8条)和拟南芥(12条)等不同物种的WRKYIIcs亚家族成员构建系统进化树分析显示(图4-A),39个成员被分为4个组,每组都包含茶树的CsWRKYIIcs亚家族成员。其中CsWRKYIIc8和CsWRKYIIc9与VvWRKY33和VvWRKY37关系更近;CsWRKYIIc2与VvWRKY16亲缘关系最近,并与CsWRKYIIc3及成对的CsWRKYIIc4和CsWRKYIIc7聚类;CsWRKYIIc5和CsWRKYIIc6与VvWRKY1和AtWRKY57关系更近;CsWRKYIIc1与VvWRKY3关系最近。另外,不同物种中的WRKYIIc亚家族成员有相似的保守基序(图4-B)。motif1出现在39个WRKYIIcs亚家族成员中;除了茶树CsWRKYIIc7外,其他38个成员均拥有motif2;4个组中都出现motif3和motif5,第1组、2组、3组中均含motif4。此外,同组成员拥有更多相同基序,如motif6和motif9只出现在第2组。而有的基序只出现在某一组中,如motif7只存在第1组,motif10出现在第3组,motif8只出现在第4组,说明WRKYIIcs在进化过程中不同组成员的保守基序有一定的差异。
2.4 CsWRKYIIcs的结构分析
9个茶树CsWRKYIIcs亚家族成员分为4个组(图5-A)。外显子-内含子结构分析显示9个基因的编码区包含1—2个内含子和2—3个外显子(图5-B),表明它们在进化过程中可能行使相似的功能。
2.5 顺式作用元件预测
9个茶树CsWRKYIIcs的启动子区域预测到多个与非生物胁迫相关的顺式作用元件(表3),它们重复出现在一个或多个启动子区域,可能影响CsWRKYIIcs对不同非生物胁迫的应答。值得探讨的是,每个启动子序列中高频出现响应脱落酸的作用元件ABRE及受干旱诱导的作用元件MYB,在多个启动子区域频繁出现与干旱胁迫相关的作用元件MBS和MYC,由此推测9个CsWRKYIIcs可能与干旱胁迫密切相关。
2.6 CsWRKYIIcs的表达分析
qRT-PCR结果显示(图6),CsWRKYIIc1、CsWRKYIIc8和CsWRKYIIc9在花中优势表达,根中次之,在茎和叶中的表达量最低;而CsWRKYIIc2和CsWRKYIIc3、CsWRKYIIc4和CsWRKYIIc7在根中表达量显著,花中次之,在茎和叶中的表达量相对较低;CsWRKYIIc5在根中的表达量最高,茎中次之,在叶和花中相对较低;CsWRKYIIc6在根中的表达显著高于茎、叶和花。这9个CsWRKYIIcs在根和花中的表达量明显高于茎和叶,表明其组织表达存在差异。
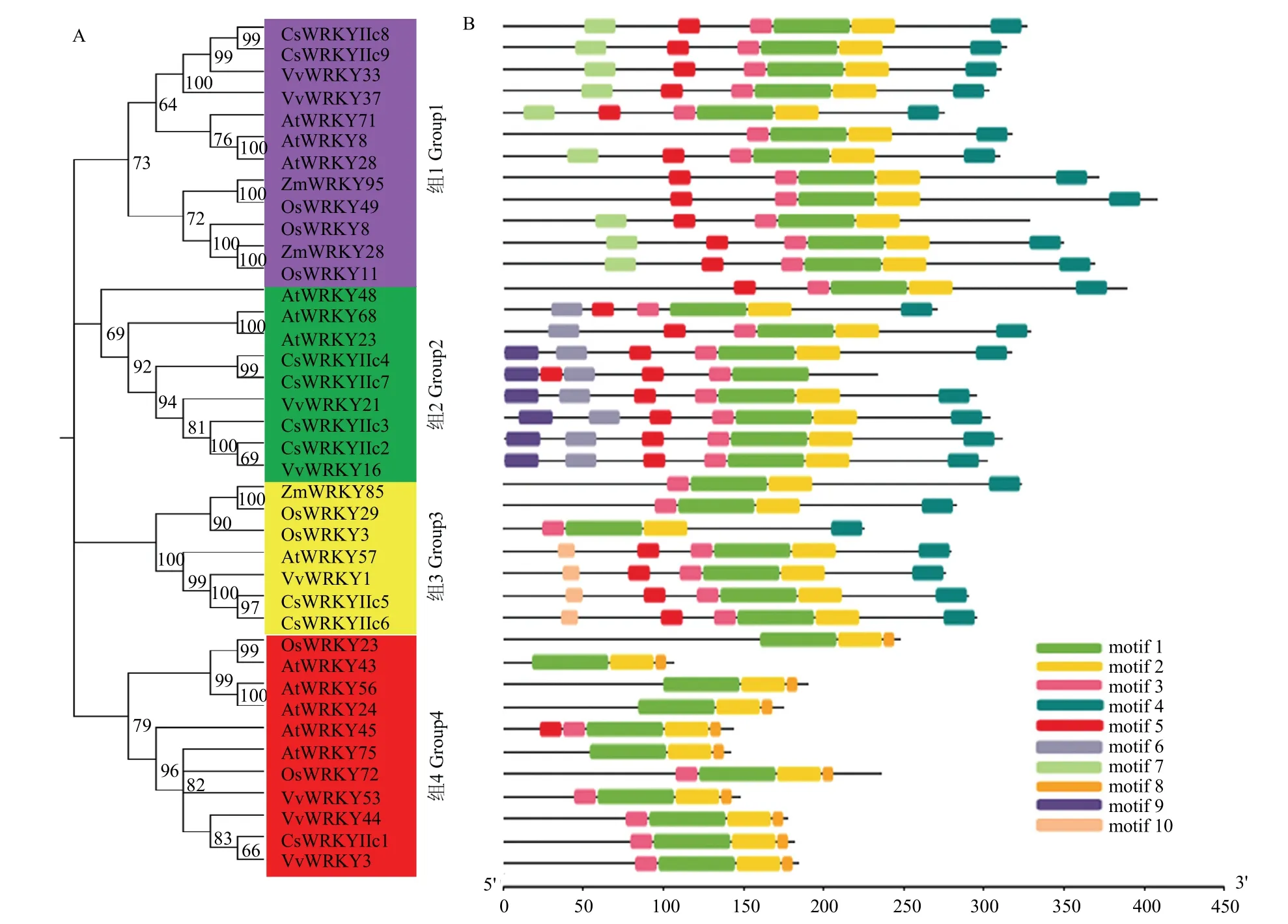
图4 不同物种WRKYIIcs的进化树和保守基序分析Fig.4 Analysis of phylogenetic tree and motifs of WRKYIIcs from different species
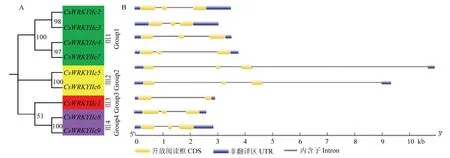
图5 CsWRKYIIcs的结构分析Fig.5 Structure analysis of CsWRKYIIcs

图6 CsWRKYIIcs在不同组织中的表达分析Fig.6 Expression analysis of CsWRKYIIcs in different tissues

表3 顺式作用元件预测Table.3 Cis-elements prediction

图7 CsWRKYIIcs在干旱胁迫下的表达分析Fig.7 Expression analysis of CsWRKYIIcs under drought stress
在干旱、ABA、高盐、高温等不同胁迫处理下,CsWRKYIIcs主要呈不同的表达模式。干旱胁迫下,不同CsWRKYIIcs被阶段性诱导(图7),CsWRKYIIc5和CsWRKYIIc6的表达量先升高后降低,在8 h时达到峰值,达0 h的8倍和10倍;其他基因在1—4 h受干旱影响较小,仅有CsWRKYIIc1、CsWRKYIIc3和CsWRKYIIc7在1 h明显上调;而8—48 h时间段总体表达水平高于前期,其中CsWRKYIIc2和CsWRKYIIc3均显著上调,CsWRKYIIc1在48 h的表达量为对照的36倍。在ABA诱导下,CsWRKYIIcs均强烈地上调表达(图8),除CsWRKYIIc1和CsWRKYIIc7稍显迟缓外,其他基因均能在1 h时快速作出反应,在随后时间段也有较高表达水平,其中CsWRKYIIc1在48 h表达量最高,达处理前的60倍以上,CsWRKYIIc7在4和24 h均达对照的70倍。在盐处理下,不同CsWRKYIIcs的表达水平不等(图9),CsWRKYIIc1仅在4和48 h时被显著诱导;CsWRKYIIc2和CsWRKYIIc3、CsWRKYIIc5和CsWRKYIIc6、CsWRKYIIc8于1—8 h变化较小,在12 h后表达量显著增加;而CsWRKYIIc4和CsWRKYIIc7在24 h表达量达最高,其中CsWRKYIIc7表达量为处理前200倍。CsWRKYIIc9分别在2、12和48 h上调显著,表达量最高可达处理前的400倍。高温胁迫下CsWRKYIIcs的表达也存在差异(图10),CsWRKYIIc2和CsWRKYIIc3在处理前期无显著变化,分别在12和8 h时上调表达,后期表达量小幅度下降;CsWRKYIIc5在各阶段上调表达,除2和8 h外;CsWRKYIIc6仅在24 h时上调表达;CsWRKYIIc1、CsWRKYIIc4和CsWRKYIIc7、CsWRKYIIc9均在12 h时表达量达到最高,特别是CsWRKYIIc1和CsWRKYIIc7可达对照的100倍;而CsWRKYIIc8在高温下的表达受到强烈的抑制。这些结果表明,CsWRKYIIcs能快速应答ABA信号,不同程度地响应干旱、高盐、高温胁迫,高盐胁迫下相对表达水平高于干旱、高温胁迫,表明其可能对盐胁迫有更高的敏感性。其中CsWRKYIIc1和CsWRKYIIc7表达量更显著,可能参与了茶树对这些胁迫的抗逆反应。
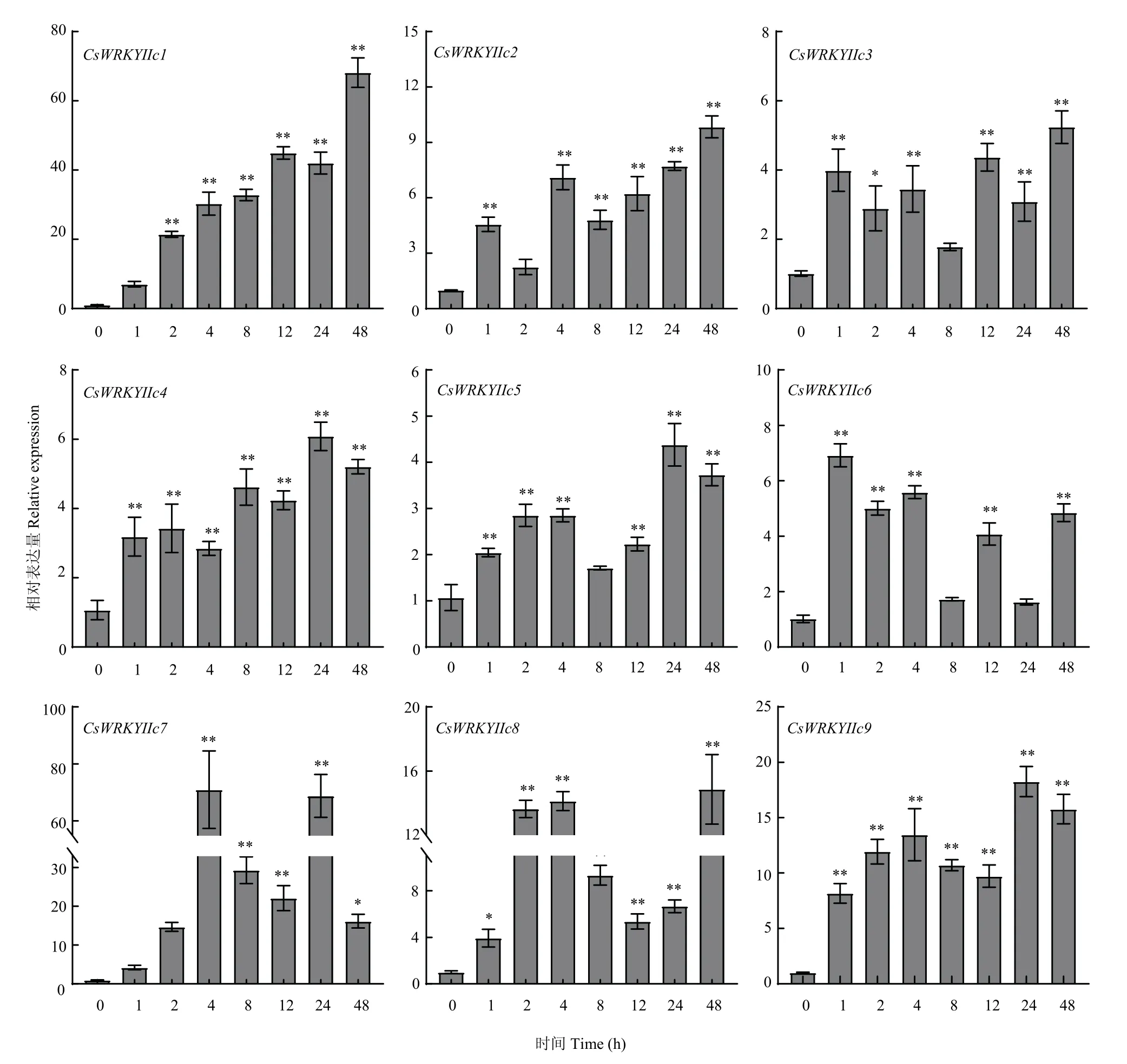
图8 CsWRKYIIcs在ABA诱导下的表达分析Fig.8 Expression analysis of CsWRKYIIcs under ABA-induced

图9 CsWRKYIIcs在盐胁迫下的表达分析Fig.9 Expression analysis of CsWRKYIIcs under NaCl stress

图10 CsWRKYIIcs在高温胁迫下的表达分析Fig.10 Expression analysis of CsWRKYIIcs under heat stress
2.7 转录活性试验结果
利用酵母试验研究CsWRKYIIcs蛋白的转录活性(图11),所有重组表达载体、阳性对照及阴性对照均能在SD/-Trp培养基上生长;所有重组表达载体及阳性对照在SD/-Ade/-His培养基上正常生长,而阴性对照生长受抑制;在加入X-α-gal的培养基上,阴性对照长势微弱且无变蓝,但所有重组表达载体及阳性对照菌斑均呈现不同程度的蓝色,表明9个茶树CsWRKYIIcs重组蛋白都具有转录激活活性。

图11 CsWRKYIIcs的转录活性分析Fig.11 Transcription activity analysis of CsWRKYIIcs
3 讨论
WRKY转录因子在植物生长发育、防御调控和胁迫应答中发挥重要作用。有研究表明植物经常发生锌指结构丢失事件,如菠萝的AcWRKY23和‘铁观音’的CsWRKY39均出现锌指结构缺失[20,26],本研究也发现CsWRKYIIc7缺少锌指残基,推测缺失可能导致其功能差异,还需要进一步研究。基因结构分析显示9个CsWRKYIIcs含有1—2个内含子和2—3个外显子,苹果MdWRKYIIcs亚家族成员也有类似现象[27],说明它们结构组成之间密切联系,可能有相似作用。
大量研究表明植物中不同WRKY的组织表达具有特异性,例如,玉米ZmWRKY58在根中表达较强[28],陆地棉GhWRKY42主要在茎中表达[29],菊花CmWRKY40在叶片中表达量最高[30]。本研究中‘陕茶1号’CsWRKYIIcs在不同组织中的表达也有一定差异,根和花中的表达量显著高于茎和叶,推测其可能在茶树的根和花中发挥重要的生物学作用。前人研究证实不同茶树品种间的WRKY存在较大差异[14],如‘龙井43号’的CsWRKY3在根中表达最强[18],CsWRKY7在老叶和根中都优势表达[22],‘铁观音’的CsWRKY48在根和茎中的表达强于叶和花,而CsWRKY6和CsWRKY31分别在老叶和花中优势表达[21],意味着不同的茶树品种和生长环境可能导致WRKY在不同组织中的表达差异。
近年来,众多研究表明植物的WRKY参与响应多种非生物胁迫[31-33],本研究结果也说明CsWRKYIIcs与茶树的逆境胁迫响应密切相关。在干旱胁迫下,CsWRKYIIcs被阶段性诱导表达,与菊花[30]等植物有类似的表达模式,说明它们参与干旱胁迫的响应。前人证实激活AtWRKY57表达可上调ABA3和NCED3,提高ABA水平增强拟南芥的抗旱性[34]。CsWRKYIIc5和CsWRKYIIc6受干旱胁迫于8 h时达对照的8倍和10倍,系统进化树表明其与AtWRKY57亲缘关系相近,推测其可能具有相似的生物学功能。前人研究表明WRKY是ABA信号途径的关键基因,如CsWRKY2通过参与到ABA下游信号途径中响应干旱胁迫[16];过表达GmWRKY16诱导体内ABA合成并调控胁迫相关基因表达从而提高植株的抗性[35]等。本研究结果显示ABA诱导下所有CsWRKYIIcs均上调表达,且反应迅速,这可能与其表达快速而瞬时的特点相关[36]。其中CsWRKYIIc1和CsWRKYIIc7表达量高于其他CsWRKYIIcs,预示着它们可能在ABA信号调控途径中起关键作用。另一方面,从启动子区域预测到多个响应ABA和干旱胁迫的顺式作用元件,推测CsWRKYIIcs可能通过ABA信号途径参与茶树的抗旱调控,将是下一步研究重点。
在盐胁迫下,CsWRKYIIcs被不同程度地诱导,与前人分析结果一致[15],表明其参与了茶树对盐胁迫的响应。有研究证实过量表达ZmWRKY17调节ABA和胁迫相关基因的表达,降低植株对盐胁迫的耐受性[37]。而ZHU等[38]证实葡萄VvWRKY30受盐胁迫强烈诱导,并通过活性氧清除和渗透压积累增强转基因拟南芥的耐盐性。本研究中CsWRKYIIcs被盐胁迫诱导较高水平表达,尤其是CsWRKYIIc7和CsWRKYIIc9可分别达对照的200和400倍,因此推测其可能在茶树抗盐反应中扮演重要角色。另外,WU等[13]分析表明不同茶树品种的WRKY受温度诱导存在差异,但又表现出群体一致性。本试验中CsWRKYIIcs的表达没有出现规律性的上调或下调,其中CsWRKYIIc1、CsWRKYIIc2、CsWRKYIIc4和CsWRKYIIc7、CsWRKYIIc9表达量在12 h达到峰值,尤其是CsWRKYIIc1和CsWRKYIIc7可达100倍,可能与ZmWRKY106和OsWRKY11具有相似的功能,即正向调控植物对高温胁迫的耐受性[9,39]。而CsWRKYIIc8被强烈地抑制,与茶树CsWRKY7和菊花多个CmWRKYs的表达趋势一致[22,30],可能在高温胁迫中起负调控作用。此外,本研究也发现组内基因之间有相似的表达趋势,如干旱胁迫下的CsWRKYIIc2和CsWRKYIIc3、CsWRKYIIc5和CsWRKYIIc6,盐处理下的CsWRKYIIc2和CsWRKYIIc3、CsWRKYIIc4和CsWRKYIIc7,高温胁迫下的CsWRKYIIc4和CsWRKYIIc7等,推测它们在逆境中可能有相似的响应机制,但还需进一步的试验证明。
另一个方面,WRKY是植物重要的转录因子家族,它的一个基本特征是具有转录激活活性,可以通过激活下游基因的表达参与调控作用[40-41]。因此,本文通过酵母试验验证茶树CsWRKYIIcs的转录活性。结果显示9个pGBKT7-CsWRKYIIcs重组表达载体在含X-α-gal的缺陷培养基上呈蓝色,表明它们都具有转录激活活性。前人报道茶树中不同CsWRKYs定位于细胞核内[16,19,22],本研究根据CsWRKYIIcs的核定位预测值和亚细胞定位预测结果,推测它们是定位于细胞核的调控蛋白。另外,研究表明WRKY的N端是表现活性的关键结构[38,42],因此,可进一步验证CsWRKYIIcs序列的活性部位,为后续试验提供一定理论依据。
4 结论
从‘陕茶1号’中克隆获得9个CsWRKYIIcs转录因子,除CsWRKYIIc7锌指基序缺失外,其他8个CsWRKYIIcs均含有1个高度保守的WRKY结构域和C2H2型锌指结构,属于IIc亚家族。9个蛋白均具有转录激活活性,可能作为转录激活因子参与茶树的逆境调控。这些基因受ABA、干旱、高盐和高温胁迫不同程度的诱导表达,而且从启动子序列预测到多个与非生物胁迫相关的作用元件,表明CsWRKYIIcs参与了茶树对多种非生物胁迫的响应;高盐胁迫下的总体表达水平高于干旱、高温胁迫,表明其可能对盐胁迫具有更高的敏感性。在ABA、干旱、高盐和高温处理下,CsWRKYIIc1和CsWRKYIIc7表达量变化显著,可作为茶树逆境候选基因进行深入研究。

