中华竹鼠源致病性大肠杆菌分离鉴定、耐药性及毒力基因检测
阎朝华 张 旭 陈国权 周碧君,3*王开功,3 赵大杰 文 明,3* 张件军
(1.贵州大学动物科学学院,贵阳,550025;2.贵州大学动物疫病研究所,贵阳,550025;3.贵州省动物疫病与兽医公共卫生重点实验室,贵阳,550025)
大肠埃希氏菌(Escherichiacoli)是普遍存在于人和动物机体中的条件性致病菌[1],自1990年中华竹鼠(Rhizomyssinensis)驯化圈养以来竹鼠大肠埃希氏菌病就偶有报道,屈孝初等[2]在2002年首次报道大肠埃希氏菌引发竹鼠水肿病,此后大肠埃希氏菌病在竹鼠养殖中时有发生,且具有发病快,死亡率高的特点,已成为近年来造成竹鼠养殖企业重大经济损失的细菌性疫病之一[3-4]。根据相关报道大肠埃希氏菌许多血清型都能够使家畜、家禽发病,目前能够引起竹鼠源大肠埃希氏菌病的血清型有O35、O111、O141等血清型[5-6]。
中华竹鼠又名竹狸、竹馏、竹根猪等,属于哺乳纲(Mammalia),啮齿目(Rodentia),竹鼠科(Rhizomyidae),竹鼠属,是中国南方珍贵的特种野生动物之一[7]。近年来随着贵州省竹鼠养殖规不断扩大,各类细菌性疫病也时常发生,因此对竹鼠疫病病原以及防控技术的研究也变得迫在眉睫[8]。2019年年初以来贵州省三穗县某竹鼠养殖场陆续出现竹鼠发病死亡现象,其症状主要表现为竹鼠精神沉郁,被毛无光泽,厌食,体型消瘦,眼睑肿胀,下牙脱落等。为查明此次竹鼠发病病因,笔者对病死竹鼠进行病原菌分离鉴定、药敏实验、耐药基因检测、动物感染试验和毒力基因检测,以期为该病的防治与分子流行病学研究提供参考依据。
1 材料与方法
1.1 送检材料
贵州省三穗县某竹鼠养殖场送检病死竹鼠2只,经剖检观察发现病死竹鼠皮下有点状出血点、腹水充盈、肺脏有白色斑块、肝脏肿大、肠道内容物有血块。
1.2 试验材料
10只昆明系杂交SPF级小白鼠,购自贵州医科大学实验动物中心;革兰染色试剂盒,购自北京索莱宝科技有限公司;细菌药敏片,购自杭州微生物试剂有限公司;鲜血琼脂培养基和LB液体培养基均由贵州大学动物疫病研究所兽医实验室自制;博检革兰氏阴性细菌鉴定系统购自青岛海博生物技术有限公司。
1.3 细菌分离培养与形态学观察
剖检观察病死竹鼠,无菌操作取送检病死竹鼠的心脏、肝脏、脾脏画线接种于鲜血琼脂平板,置于37℃恒温箱中培养24 h,待细菌长出。取单个优势菌落进行纯化培养,进行革兰染色,在显微镜下观察菌体形态。
1.4 细菌生化鉴定
参照博检革兰氏阴性细菌(Gram negative bacteria)鉴定系统说明书对纯培养菌进行生化特性鉴定。
1.5 细菌16S rDNA基因检测及序列分析
提取纯培养菌DNA为模版,以细菌16S rDNA通用引物(由生工生物工程(上海)股份有限公司合成,上、下游引物为:27F:5′-AGAGTTTGATCATGGCTCAG-3′1492R5′-TACGGTTACCTTGTTACGACTT-3′;预计扩增片段大小为1 356 bp)进行PCR扩增。25 μL PCR反应体系:2×TaqPCR Markter Mix:12.5 μL,上、下游引物各1 μL,模板DNA 2 μL,剩下用双蒸水补足25 μL。反应条件:94 ℃预变性5 min;94 ℃变性 30 s,54 ℃退火30 s,72 ℃延伸90 s,共 30 个循环;72 ℃ 延伸10 min。取10 μL PCR产物进行1.5% 琼脂糖凝胶电泳检测结果。将PCR产物送至生工生物工程(上海)股份有限公司进行基因测序,并将测序结果于NCBI数据库中进行对比分析,用 Mega 7.0软件建立系统发育树。
1.6 细菌药敏实验和耐药基因检测1.6.1 细菌药敏实验
采用制片扩散法(K-B法),取200 μL纯培养菌液均匀涂布于LB琼脂平板后粘贴药敏纸片,37 ℃培养24 h后观察并记录抑菌圈直径,判定菌株对不同药物的敏感性。
1.6.2 细菌耐药基因检测
根据药敏实验参照相关文献[8-10]设计细菌常见耐药基因引物,即I类整合子基因(Intl1)、四环素耐药基因(tetA、tetB、tetD),引物序列见表1,由生工生物工程(上海)股份有限公司合成。对分离菌纯培养物DNA进行 PCR检测,将PCR产物进行1.5%琼脂糖凝胶电泳并观察判定结果。

表1 耐药基因引物信息Tab.1 Primer information of drug resistance genes
1.7 细菌人工感染试验与毒力基因检测1.7.1 细菌人工动物感染试验
将10只健康昆明系杂交SPF级小白鼠分为试验组与对照组,每组各5只。试验组每只腹腔注射分离菌悬液0.3 mL(用灭菌生理盐水将分离菌配制成浓度2.12×109cfu/mL),对照组每只腹腔注射0.3 mL无菌生理盐水,连续观察3 d,记录小鼠的死亡情况并及时分离鉴定死亡小鼠体内病原菌
1.7.2 细菌毒力基因检测
参考文献[11-12]设计并合成肠杆菌科常见8种毒力基因,即fyuA、irp-2、ompA、papA、papC、fimH、UidA、afa,引物序列见表2。

表2 毒力基因引物信息Tab.2 Virulence gene primer information
2 结果
2.1 细菌分离培养与形态学观察结果
经剖检观察发现病死竹鼠皮下有点状出血点,腹水充盈,肺脏有白色斑块,肝脏肿大,肠道内容物有血块。在无菌条件下取病死竹鼠心、肝、脾脏接种于鲜血琼脂平板,37 ℃培养24 h可见细菌生长,形成圆形凸起、表面光滑、灰白色的菌落(图1);经革兰氏染色后镜检,菌体为革兰氏阴性短小杆菌(Gram negativeCurtobacterium),两端钝圆,多数呈单个规则排列(图2)。

图1 分离菌的菌落形态Fig.1 Colony morphology of isolated bacteria

图2 分离菌革兰氏染色镜检(100×)Fig.2 Gram staining microscopic examination of isolated bacteria(100×)
2.2 生化鉴定结果
生化鉴定结果显示该细菌可利用ONPG、赖氨酸、乳糖、葡萄糖、甘露醇、山梨醇、鼠李糖、蜜二糖,氧化酶、吲哚等反应为阳性,蔗糖、苦杏仁甙、VP等反应为阴性(表3),将该生化试验结果通过博检革兰氏阴性细菌鉴定系统检索为大肠杆菌,并命名为GZSS。

表3 分离菌生化鉴定结果Tab.3 Biochemical identification of isolated bacteria
2.3 细菌16S rDNA基因检测及序列分析结果
细菌16S rDNA基因经PCR扩增结果显示,得到大小为1 356 bp 特异性片段(图3);将测序结果与 NCBI数据库进行BLAST比对,结果显示,分离菌株 GZSS与鸭源、鸡源、牛源、羊源、猫源、鼠源性等13株大肠杆菌参考株相应序列同源性达95%—99.4%(图4);通过MegAlign软件进行系统进化树分析,发现分离菌GZSS与猪源大肠杆菌(swineE.coli)JF513979.1亲缘关系最近(图4)。综合分离菌形态学特征、生理生化特性鉴定及16S rDNA基因测序分析,判断该分离菌为大肠杆菌(GZSS)。
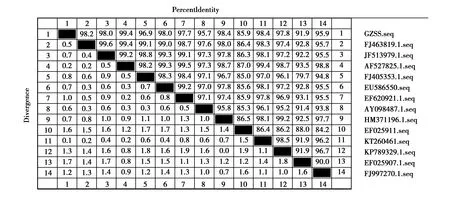
图4 分离菌株16S rDNA与其他分离株的同源性比对Fig.4 Homology comparison of 16S rDNA isolates with other isolates
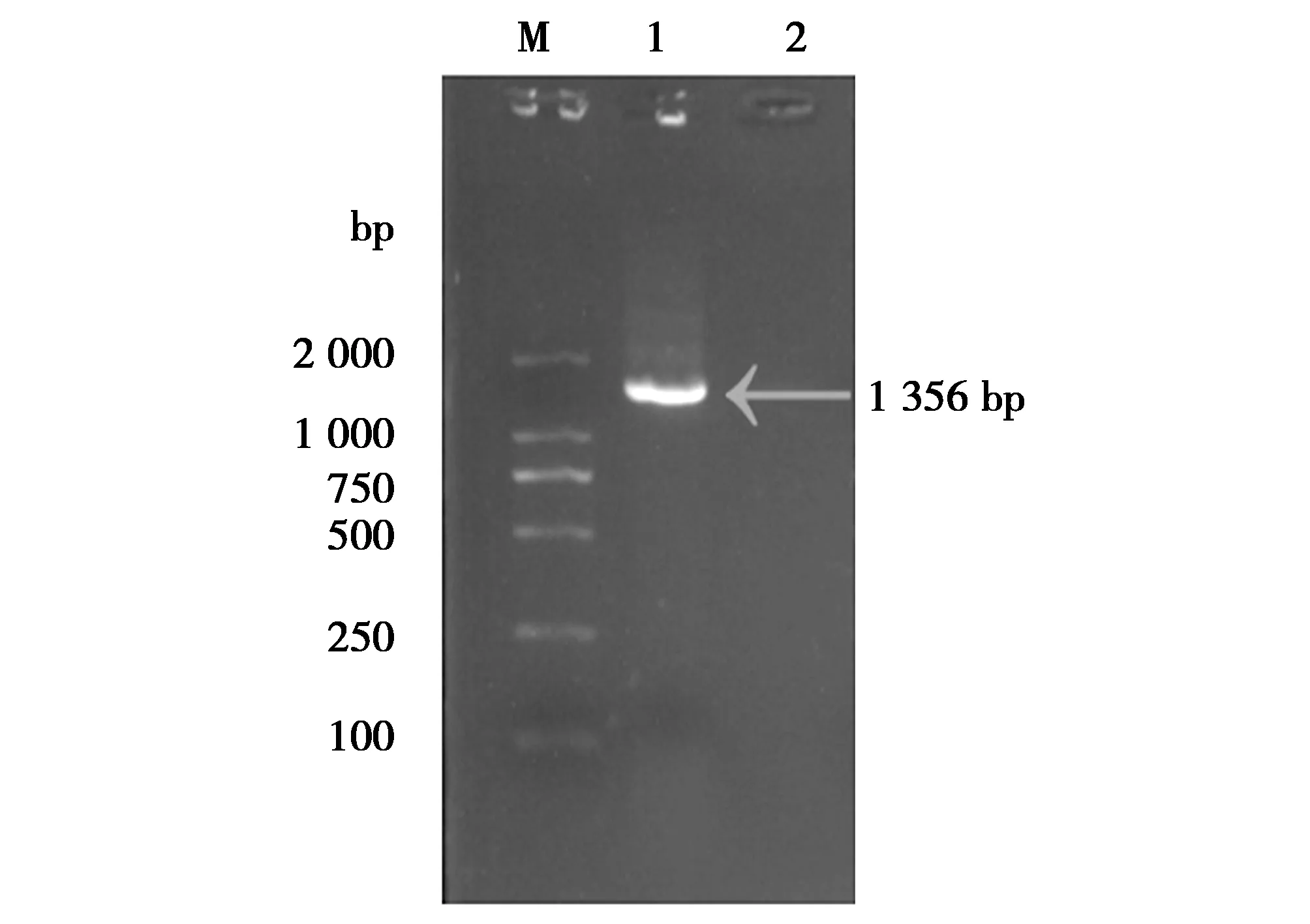
图3 分离菌16S rDNA基因序列 PCR 扩增结果Fig.3 Amplification of 16S rDNA genesequence of isolated bacteria by PCR
2.4 细菌药敏实验结果
药敏实验结果显示,该分离菌对苯唑西林、庆大霉素、复方新诺明、头孢曲松、氟苯尼考、磺胺异噁唑、卡那霉素、氧氟沙星、妥布霉素、新霉素、羧苄西林、头孢拉定、恩诺沙星、阿莫西林14种药物敏感,对多黏菌素B中度敏感,对多西环素 、四环素、米诺环素3种药物耐药(表5)。

图5 分离菌(GZSS)基于16S DNA基因序列的系统进化树Fig.5 Phylogenetic(GZSS)tree of isolated bacteria based on 16s DNA genesequence

表5 药敏试验结果Tab.5 Drug susceptibility test result
2.5 细菌耐药基因检测结果
根据药敏实验结果设计4种耐四环素类基因引物进行PCR扩增,经1.5%琼脂糖凝胶电泳显示,分离菌携带有Intl1(146 bp)、tetA(831 bp)2种耐药基因,未检测出tetB、tetC2种耐药基因(图6)。

图6 分离菌耐药基因 PCR扩增电泳Fig.6 Amplified polymerase chain electrophoresis map of drug resistance genes of isolated bacteria M,DL2000 DNA Marker.1,Intl 1.2,tetA. 3,tetB.4,tetC
2.6 细菌人工感染试验结果
经动物感染试验发现,对照小鼠在观察期内无明显临床症状和死亡,实验组小鼠在注射24 h后开始出现精神沉郁,进食减少,卷缩,嗜睡等症状,于36 h开始出现死亡现象,至72 h小鼠全部死亡。从死亡小鼠肝脏、心脏等组织处均能分离到形态一致的菌落,对其进行革兰染色镜检、生化特性鉴定和 16S r RNA 同源性比对,结果显示分离出的感染菌在外部形态、生理生化特性与初始分离得到的感染菌为同一种菌。对照组正常饮食,没有死亡现象。
2.7 细菌毒力基因 PCR检测结果
设计大肠杆菌8种毒力基因特异性引物进行PCR扩增,经1.5%琼脂糖凝胶电泳显示,分离菌携带papA(761 bp)、UidA(264 bp)、afa(251 bp)3种毒力基因,未检测出fyuA、irp-2、ompA、papC、fimH5种毒力基因(图7)。

图7 毒力因子PCR扩增结果Fig.7 Virulence factor PCR amplification results M,DL2000 DNA Marker;-,阴性对照Negative control;
3 讨论
大肠埃希氏菌是一种革兰氏阴性细菌,正常情况下主要分布于人和动物的消化道、呼吸道、泌尿系统内,当人或动物免疫力低下时在某些部位会成为致病菌[13],即条件性致病菌。致病性大肠杆菌主要有产肠毒素大肠杆(enterotoxigenicEscherichiacoli,ETEC)、产类志贺毒素大肠杆菌(shigalike toxinEscherichiacoli,SLTEC)、 肠道致病性大肠杆菌(enteropathogenicEscherichiacoli,EPEC)、败血性大肠杆菌(septicEscherichiacoli,SEPEC)及尿道致病性大肠杆菌 (urethral pathogenicEscherichiacoli,UPEC),等,在动物群体中最常见的为产肠毒素大肠杆菌[14-17]。实验从竹鼠体内分离到一株大肠埃希氏菌,在琼脂平板上呈圆形凸起、表面光滑、灰白色的菌落,与曾喻兵等[18]报道一致。此外,不同分离源的大肠埃希氏菌生化戚特性具有差异。戚伟等[19]分离的猪源大肠杆菌能分解蔗糖、葡萄糖产酸产气。本实验分离菌与宋越等[20]和余佳[21]禽源性大肠杆菌(avianEscherichiacoli,AEC)的生化特性基本一致,但葡萄糖分解不产酸和产气。因此在传统的生化实验上还需要通过16S rDNA基因序列分析鉴定才能得到准确的鉴定结果。
养殖场药物的使用情况或来源不同(鸡源、犬源)可使细菌对抗菌药物的敏感性不同,刘砚涵等[13]在对具有免疫程序的养鸡场药敏实验结果显示该鸡源大肠杆菌对氨苄西林、氯霉素、四环素、氟苯尼考等耐药。苏玉珍[22]对宠物犬源分离的大肠杆菌药敏实验结果显示其分离菌对头孢曲松、头孢他啶、氟苯尼考等耐药。通过该竹鼠养殖场技术人员的反馈,由于该养殖场规模较小和讲求“绿色生态”的原因,并未对竹鼠投喂任何药物。据上述研究表明不同来源的大肠埃希氏菌和药物的使用情况对个别药物的敏感性具有差异性。耐药基因检测出Intl1和tetA2种耐药基因,结合药敏仅对四环素类药物耐药,表明本研究分离的大肠埃希氏菌对四环素类耐药与基因型相符合。
细菌所带的毒力基因与其致病性密切相关,细菌所携带毒力因子与其致病性紧密相关,papA、UidA、afa,fyuA、irp-2、ompA、papC、fimH是大肠埃希氏菌的重要致病基因。王绍红等[23]和王洪彬等[24]研究中把papA、UidA、afa等因子作为大肠埃希氏菌病致死的主要毒力基因。综合上述研究分析引起本次竹鼠死亡的原因与分离株携带有这3种毒力基因有关。
4 结论
试验对从贵州省三穗县某竹鼠养殖场送检病死竹鼠体内分离到1株携带3种毒力基因的竹鼠源大肠埃希氏菌致病菌,通过药敏实验、耐药基因检测显示分离菌对磺胺异噁唑、阿莫西林、新霉素等药物敏感,对四环素类药物耐药,建议养殖场用敏感药物进行该细菌病的防治。

