昆仑雪菊通过NOS/NO途径改善高脂饮食诱导低氧环境大鼠海马组织的损伤*
吴 萍,张广梅,赵协慧,李冰鹄,祝君君,赵艳霞,李 卡
(青海大学医学院 西宁 810000)
一氧化氮(NO)是一种无机小分子化合物,兼有第二信使物质与神经递质的功能,是信息交换的重要载体,参与生理功能的调节。如松弛血管平滑肌,抑制血小板聚集,神经传导,细胞毒性及免疫功能等[1],并在中枢与外周神经系统中发挥着重要的作用。血红蛋白对NO 的活性具有抑制作用,由于某种原因导致血红蛋白浓度增加时,也可以引起血管痉挛;NO 释放下降可引起血小板聚集,导致血管痉挛与局部血栓形成。NO 是一种慢突触递质,保护脑细胞避免毒物的攻击及脑缺血时调整脑血供应等,小量释放可作为信使物质传递信息,而大量释放时又可以杀死脑细胞,尽管外周神经系统中释放量有限,其仍符合作为经典递质的许多标准,但同时NO 并非储存在突触颗粒中;以扩散的方式到达靶细胞,受体是GC 的活性位点上的铁离子,脑组织不同部位分布着一氧化氮合酶(NOS),尤其以海马、小脑等部位为主,NOS 在脑内的分布并不完全与GC 分布相符,因此,NO 可能还通过其它途径发挥作用这也是其相对不典型性的体现。超氧化物歧化酶(SOD)通过清除超氧阴离子自由基,保护细胞,对机体的氧化与抗氧化平衡起着至关重要的作用[2],丙二醛(MDA)是脂质过氧化反应的产物,其含量的多少可以反映组织的脂质过氧化反应的速度和强度[3]。NO、MDA、SOD、NOS 等因子均在缺血缺氧引起组织损伤中占有重要地位,且NO、MDA 含量与SOD 活力及NOS mRNA 表达的测定,均可从不同水平及角度反映组织损伤程度。
由于社会生活条件大幅度改善,人们普遍缺乏运动,体内低循环代谢加上高热量高脂肪饮食,工作和生活压力对精神的影响,使得老年心脑血管疾病发生的风险性增高。血脂代谢的异常可引发脂类物质在血管内的沉淀,从而导致动脉粥样硬化、血小板聚集异常,心脑血管疾病的致病率增高。尤其是对于中老年来说,一旦引发心脑血管疾病后,仅依靠单一的药物治疗往往无法达到满意效果,很难治愈。近年来,随着前往高原地区的低海拔地区旅游人群数量不断增加,更多的人受到低氧的影响。对于高原人群,低压低氧对机体组织器官的功能、代谢等产生着广泛的影响,且单纯慢性低氧即可引起高脂血症。同时,高原低温低氧的特点,也使高原人群饮食习惯改变,高脂饮食现象普遍增多,高脂血症的发生率增加。使低氧环境人群暴露于高脂血症的威胁增多。高原低氧环境对大鼠海马组织具有损伤性,机制可能与一氧化氮合酶/一氧化氮(NOS/NO)异常有关,主要表现为诱导型NOS(iNOS)表达增加,iNOS在缺血缺氧中起损害作用[4]。但高脂饮食对低氧环境机体海马组织的影响尚不清楚。昆仑雪菊中主要含有氨基酸、蛋白质、糖类、黄酮类、生物碱、有机酸、酚类、蒽醌类及香豆素类等,具有抗氧化损伤、血管保护等多种作用[5]。因此,本课题选用昆仑雪菊干预低氧与低氧联合高脂饮食的大鼠,通过测定实验大鼠海马组织SOD 的活力、MDA 的含量、海马区一氧化氮合酶表达、NO 含量的变化和海马病理,探讨高脂饮食对低氧环境大鼠海马的影响及昆仑雪菊干预在NOS/NO 途径中的作用及其机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD 大鼠40只(体重200.0±20.0 g),购于西安交通大学医学部实验动物中心(许可证号:SCXK(陕)2012-003),适应性饲养一周。将40只实验大鼠随机分为4 组分别为:低氧对照(H)组、低氧高脂饮食(HH)组、昆仑雪菊干预低氧(XJH)组、昆仑雪菊干预低氧高脂饮食(XJHH)组。
1.2 仪器与试剂
低压氧舱室(贵州风雷航空机械有限公司,DYC-3000),LightCycler®96(瑞士,Roche),冷冻离心机(德国,BECKMAN),高速组织匀浆机(德国,Miccra D-8)。一氧化氮(NO),超氧化物歧化酶(SOD),丙二醛(MDA)检测试剂盒(南京建成生物公司),OLYMPUS光学显微镜BC35,核酸逆转录仪(Eppendrof 6325-PCR仪)。
1.3 实验过程
将各组实验大鼠置于模拟海拔5000 m 的低压氧舱中,每天8:00am四组分别给予生理盐水、脂肪乳剂、生理盐水、脂肪乳剂;8:00pm分别给予生理盐水、生理盐水、昆仑雪菊提取液、昆仑雪菊提取液。灌胃剂量均为1 mL/100 g。实验周期为1周。
1.4 昆仑雪菊液的制备
昆仑雪菊干燥花(青海省有理堂农牧科技有限公司,许可证号:JY16301030012728)粉碎取26.8 g,将雪菊花粉置于1000 mL 的烧杯中,加开水浸泡30 min,取上清液,再次沸水浸泡30 min,取上清混匀,静置于4℃冰箱中沉淀浓缩药液达53.6 mg/mL。于4℃冰箱保存。
1.5 脂肪乳剂制备
取猪油25 g放入200 mL烧杯内,于磁力搅拌器上加热至100 ℃,加入胆固醇10g,溶化,再加入丙基硫氧嘧啶1 g,然后加入25 g 吐温80,充分搅匀制成油相。取另一200 mL 烧杯中加入蒸馏水30 mL 和丙二醇20 mL,加热至60℃,然后加入脱氧胆酸钠2 g,充分搅拌至完全溶解制成水相[6]。然后油相与水相混匀,放4℃冰箱中待用。
1.6 标本制备
20%乌拉坦按照0.5 mL/100 g 进行腹腔注射麻醉大鼠,解剖取海马组织,将部分海马组织放入4%多聚甲醛溶液固定,用于组织形态学观察,其余放入冻存管,-80℃冰箱保存备用。
1.7 指标测定
取冻存海马组织采用BCA 法测定组织蛋白浓度,TBA 比色法检测丙二醛含量,WST-1 法检测超氧化物歧化酶活力,硝酸还原酶法检测硝酸盐/亚硝酸盐(NOx)水平,均按照试剂盒步骤操作并计算。
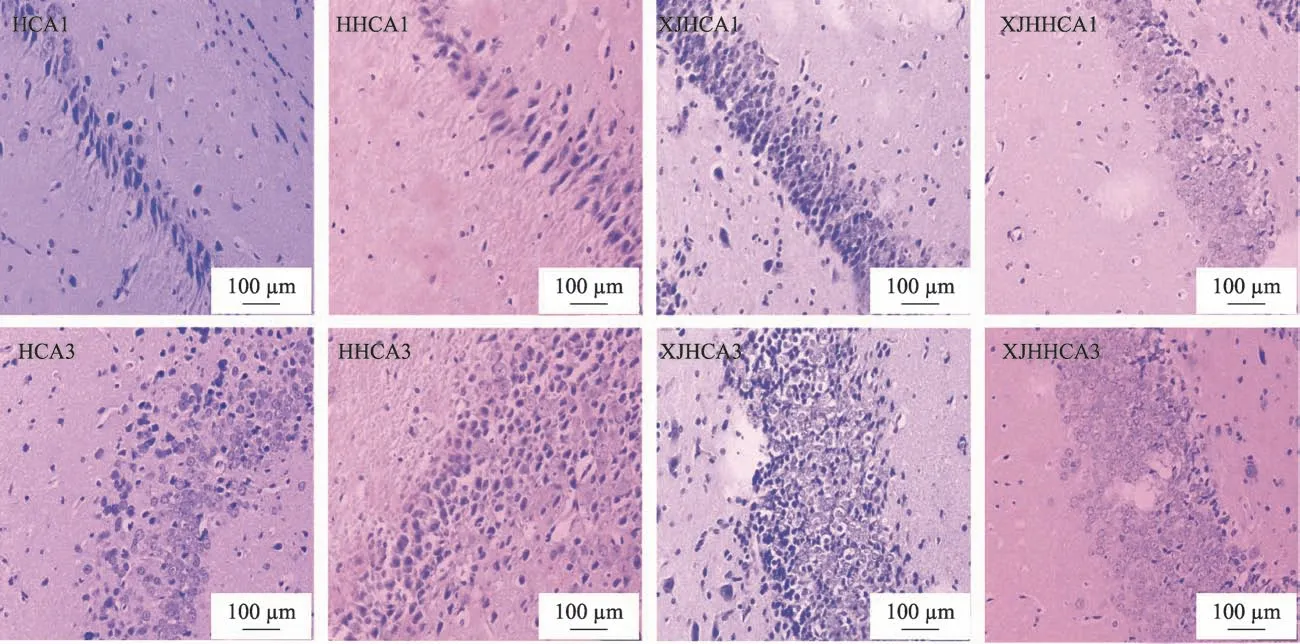
图1 大鼠大脑海马区组织形态学变化(放大倍数×400)
组织NOS 表达水平测定:组织NOS mRNA 水平检测用TRLzol RNA提取法法提取总RNA。按照Ta KaRa Fast Quant RT Kit 说明逆转录合成c DNA,目的基因引物序列:eNOS 上游5'-CTACCGGGACGAGGTACTGG-3',下游:5'-GGAAAAGGCGGTGAGGACTT-3'[7];nNOS上游:5'-GGAATATGAGGAGAAGTGTAG-3',下游:5'-CTGAGTGAGGAGTGTAG-3';iNOS 上游5'-TCTTTGC TTCTGTGCTAATG-3',下 游 5'-CAGTAGTTGTTCC TCTTCCA-3'。内参基因引物序列β-actin[8]上游5'-AGTGTGACGTTGACATCCGT-3',下 游5'-GACTCAT CGTACTCCTGCTT-3'。Real-timePCR 反应体系(20 μl体系)为:2×SYBR Select Master Mix 10 μl,40 个循环。eNOS 反应条件:Holdingstage:95℃90 s,Cycling stage:95℃5 s,60℃30 s,72℃60 s;nNOS 反 应 条 件:Holdingstage:95℃120 s,Cycling stage:95℃10 s,56℃30 s,72℃60 s;iNOS 反应条件:Holdingstage:95℃120 s,Cycling stage:95℃10 s,62℃30 s,72℃60 s,每个样品设2个复孔,目的基因与内参基因PCR反应条件一致,采集和分析数据,采用2-△△Ct法进行计算。
1.8 数据统计学分析
本研究采用SPSS 20.0软件对数据进行统计处理,采用单因素方差分析(ANOVA),组间采用LSD 比较,检验水准为α=0.05。
2 结果
2.1 海马组织形态学变化
大鼠大脑海马区组织形态学变化,如图1所示。CA1区:H组细胞结构层次排列正常紧密,胞浆深染,细胞水肿,神经元细胞胞浆疏松,有些呈空泡状,尼氏体消失,胶质细胞轻度增生。HH 组细胞结构层次增多,排列紊乱疏松,胞浆疏松,神经元细胞重度胞浆疏松,呈弥漫性空泡状,尼氏体消失,胶质细胞增生不明显。XJH 组细胞结构层次排列正常紧密,胞浆深染,胞浆疏松,神经元细胞胞浆疏松,有些呈空泡状,尼氏体存在。与XJH组相比XJHH 组细胞结构层次增多,排列紊乱疏松,胞浆疏松,神经元细胞轻度胞浆疏松,尼氏体存在。
CA3 区:H 组细胞层次结构增多,排列紊乱,见少量细胞核固缩,胞浆疏松,有些细胞胞浆呈空泡状,神经元细胞胞浆疏松,有些细胞胞浆呈空泡状。HH 组细胞层次结构增多,排列紊乱,胞浆疏松,有些细胞胞浆呈大小不等的空泡状,神经元细胞胞浆疏松,有些细胞胞浆呈空泡状。XJH 组细胞层次结构增多,排列紊乱,可见少量细胞核固缩,胞浆疏松,有些细胞胞浆呈空泡状,神经元细胞胞浆疏松,有些细胞胞浆呈空泡状。与XJH组相比XJHH 组神经元细胞轻度胞浆疏松,无空泡。
2.2 SOD活力、NO含量、MDA含量
SOD活力、NO含量、MDA含量检测,如表1所示。
与H 组相比,HH 组SOD 升高(P<0.05),MDA 降低(P<0.05),XJH 组NO、MDA 均 明显 升高(P<0.05);与HH组相比,XJHH组MDA升高(P<0.05);与XJH组比XJHH组MDA下降(P<0.05)。

表1 SOD活力、NO含量、MDA含量检测(xˉ± s)
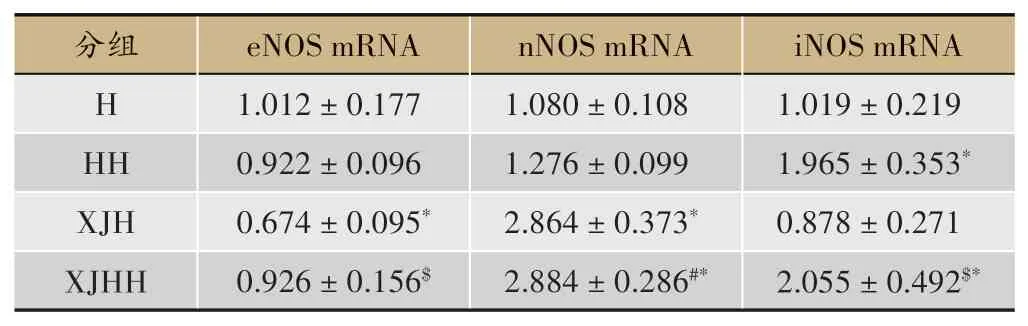
表2 海马组织NOS mRNA表达水平检测(xˉ± s)
2.3海马组织NOS mRNA表达水平
海马组织NOS mRNA 表达水平检测,如表2所示。
与H 组相比,HH 组iNOS mRNA 明显升高(P<0.05),XJH 组eNOS mRNA 降 低(P<0.05),nNOS mRNA 升高(P<0.05);与HH 组相比,XJHH 组nNOS mRNA 明显升高(P<0.05);与XJH 组相比,XJHH 组eNOS mRNA 升 高(P<0.05),iNOS mRNA 升 高(P<0.05)。
3 讨论
昆仑雪菊又称“血菊”,学名为“蛇目菊”“双色金鸡菊”,与天山雪莲齐名。既可以作为花茶饮料,又经常被当作治疗高血压、高血脂的保健药物。在北美地区,当地人使用昆仑雪菊治疗腹痛,出血等;葡萄牙则有人当茶泡饮控制糖尿病。研究表明,昆仑雪菊成分中主要含有氨基酸、蛋白质、糖类、黄酮类、生物碱、有机酸、酚类、蒽醌类及香豆素类等,具有抗氧化、血管保护等多种作用[5]。受到广泛关注与研究。昆仑雪菊各部位中,顶状花序表现出最强的抗氧化能力,其抗氧化能力顶状花序>芽部>种子>叶>茎部[9]。昆仑雪菊的提取物中含有丰富的类黄酮化合物,能够治疗链脲霉素引起的葡萄糖不耐受症和改善高脂饮食引起的高血糖症,其机理与恢复胰腺功能、调节糖代谢关键酶、抑制α葡萄糖苷酶活性和抗氧化活性等相关[10-12]。同时,具有降血压、抑制血管紧张素Ⅰ-转换酶活性和舒张血管的功效。槲皮素和木犀草素被认为是主要的功效成分,花旗松素和α,3,2'-三羟基-4'-O-β-D-吡喃葡萄糖查耳酮也被认为具有潜在降血压作用[13]。昆仑雪菊中的类黄酮物质圣草酚-7-O-吡喃葡萄糖苷能改善脂代谢紊乱和降脂的功效,有保护线粒体功能和抑制游离脂肪酸诱导的脂肪生成的作用[14]。聚炔类物质——金鸡菊苷A 和E 也被认为具有降脂作用的潜力,但还缺乏更深入的研究[15]。雪菊提取物能减弱脂多糖诱导的小胶质细胞激活,减轻神经炎症[16]。其中,奥卡宁被确定具有抗神经炎的作用[17]。且自由基清除能力最强,在细胞中也有超强的抗氧化活性且无毒害作用[18]。在研究中发现,雪菊的石油醚提取物和乙酸乙酯提取物的抗神经炎作用最佳,其中咖啡酸甲酯、奥卡宁、槲皮素、山奈酚-7-O-β-D-葡萄糖苷等被认为是主要的活性成分[19]研究表明,昆仑雪菊的总黄酮提取物能保护心肌缺血再灌注损伤、抗衰老、延缓动物脑及脏器萎缩退化的功效[20-21]。除降脂、抗炎和抗氧化的功效外,昆仑雪菊还具有一些其他的功效,如抗菌、保护细胞和清除一氧化氮等。在细胞保护方面,昆仑雪菊水提物和主要成分马里苷与黄诺玛苷都能抑制胰腺β细胞损伤作用,作用机制可能是抑制细胞的凋亡途径[22]。在体外实验中,昆仑雪菊中的总皂苷和精油提取物均有清除一氧化氮、亚硝酸盐等作用[23-24]。
一氧化氮作为生物体的一种重要活性物质越来越受到重视,其在生物体内由一氧化氮合酶(NOS)合成,目前已经发现的NOS 有三种包括:神经型一氧化氮合酶(nNOS)、诱导性一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)。在脑组织中,不同类型NOS表达的时间以及含量均受氧化应激、缺血缺氧、高脂与肥胖等各种因素影响,且每种因素的影响均有所差异[25-27]。海马区主要以神经细胞为主,有研究发现,中度低氧有利于神经细胞的增殖,过度低氧则不利于神经细胞的增殖[28]。基于昆仑雪菊的诸多研究以及海马对于缺血缺氧的敏感性,本课题以昆仑雪菊水提物干预低氧及低氧高脂条件下的大鼠,主要观察海马区NOS 的表达水平。在病理情况下(低氧、高脂)一氧化氮过量产生可能通过细胞毒性作用与细胞抑制作用导致组织损伤[29]。研究证明,昆仑雪菊水提物可以调节脂代谢紊乱[30],含有的酚类具有抗氧化活性[31],降低谷胱甘肽过氧化,清除自由基。雪菊花提取物,通过直接进入细胞膜的甘油酯后,对生物膜的超氧阴离子自由基损伤有明显保护作用,还可提高小鼠心脑耐缺氧能力。海马体对缺血缺氧最敏感,iNOS激活可表达升高,造成持久连续的损伤,有研究证明,iNOS在亚急性缺血缺氧过程中表达升高具有神经毒性作用,主要参与免疫病理变化。因此,从神经损伤学角度看,iNOS水平的升高对海马细胞的神经毒性较大[32-34]。本研究测定不同干预环境影响下各组大鼠海马区NOS不同分型表达,NO 含量,MDA 含量以及SOD 活力,实验数据表明HH 组较H 组iNOS 明显升高,且CA1 区神经元细胞结构破坏加重,证实高脂饮食加重低氧环境大鼠海马组织损伤,可能由于高脂饮食上调iNOS 所致,进而诱导细胞凋亡,产生神经毒性作用。神经胶质细胞主要在修复过程中产生,故而胶质细胞增生不明显,提示此时期处于亚急性期,SOD 的升高与MDA的降低可能与氧化应激反应有关。eNOS 主要在脑缺血缺氧的早期表达,调节脑血流量,具有保护作用[35],与XJH 组相比,XJHH 组eNOS mRNA 升高(P<0.05),iNOS mRNA 明显升高。即昆仑雪菊干预未明显降低低氧联合高脂饮食大鼠iNOS 表达,但相对于单纯低氧,低氧联合高脂饮食受到昆仑雪菊干预的eNOS 升高方面获益更明显。
nNOS 主要在中枢神经系统周围神经系统中表达,与eNOS 均为结构型一氧化氮合酶,其中脑组织的nNOS 是一种可溶性胞质酶,在缺血缺氧状态下NOS阳性神经元可抵御某些神经毒素的毒害作用[36]。与H组相比,XJH 组eNOS mRNA 降低(P<0.05),nNOS mRNA 升高显著(P<0.05),NO 明显升高(P<0.05);CA1 区无细胞水肿,细胞坏死较少,病理改变较轻。有研究发现CA1 区各层均有nNOS 的表达,且在急性低压低氧条件下可引起nNOS 表达下降,产生损害[37],由此可知nNOS 的表达可引起NO 含量增加,对大鼠海马区产生神经保护性作用。与HH 组相比,XJHH 组nNOS 升高,而eNOS 与iNOS 的表达无明显变化,结合CA3 区神经元细胞胞浆轻度疏松且无空泡,病理改变较轻,分析昆仑雪菊干预改善低氧环境下高脂饮食大鼠海马损伤的主要原因是上调nNOS 介导的保护作用。H 组和XJH 组比,HH 组与XJHH 组相比MDA 均升高,原因主要有:①由于海马区神经系统有丰富的脂质,故脂质过氧化增强[38];②nNOS通过调节NO的生成从而产生保护作用。分析昆仑雪菊对高脂饮食诱导低氧环境大鼠海马损伤的保护作用与氧化应激的调节无直接关系。
综上所述,本研究证实高脂饮食可加重低氧环境大鼠海马组织损伤,主要与上调iNOS 表达有关;昆仑雪菊干预可明显减轻高脂饮食诱导的低氧环境大鼠海马损伤,主要与上调nNOS 表达介导保护作用有关。本课题在前期研究基础上研究高脂饮食对低氧环境大鼠海马的影响及昆仑雪菊干预效果与机制,高原居民长期处于低氧和高脂饮食环境下,故本研究可为高原人群健康防护提供基础,但昆仑雪菊对高原人群的海马保护作用尚需进一步研究。

