小麦品种西农979抗赤霉病基因的转录组测序鉴定
徐佳竞,石善党,王中华,任慧莉,汪 勇,李春莲
(西北农林科技大学农学院,陕西杨凌 712100)
小麦赤霉病(Fusarium head blight,FHB)是由多种镰刀菌引起的流行性真菌病害,广泛发生在世界的温暖潮湿地带。在我国,小麦赤霉病最主要的病原菌是禾谷镰刀菌群(Fusariumgraminearumcomplex),占所有病原菌的94.5%[1]。小麦感染赤霉病后,小穗发黄枯萎,而且籽粒还会产生脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)等多种真菌毒素,危害人畜健康。为了保障小麦生产安全,寻找有效的赤霉病防治手段并培育高抗赤霉病的小麦品种显得尤为重要。1974年至今,全国共计数万份小麦材料经过赤霉病抗性鉴定,筛选出了一批优秀的抗赤霉病种质资源,极大地推动了我国乃至全球范围内小麦赤霉病抗性的研究进程[2-3]。小麦对赤霉病的抗性分为5种类型:抗侵入型、抗扩展型、籽粒抗感染、耐病型和抗毒素积累。小麦的株高、芒的有无、颖壳张开程度等穗部形态特征都会影响其赤霉病抗性[4-5]。感染赤霉病后,抗病小麦品种的细胞壁变厚,细胞壁中的木质素大量积累,DON去毒化反应速度加快。水杨酸、茉莉酸等多种植物激素、多种酶类以及病程相关蛋白等被证实与赤霉病抗性相关[6-7]。目前,研究者已经检测到数百个抗赤霉病QTL,明确的抗赤霉病基因(QTL)有小麦3BS染色体上的Fhb1、6BS染色体上的Fhb2、4B染色体上的Fhb4等[8-9]。
近年来生物信息学和转录组学、蛋白组学、代谢组学的快速发展为全面解析小麦赤霉病抗病机制带来了新途径。转录组测序技术通过新一代高通量测序技术,对样品整个cDNA进行测序,可以从转录层面便捷全面地了解样品中基因的表达。Xiao等[10]应用转录组测序技术揭示了小麦接种禾谷镰刀菌后的基因表达情况。Gottwald等[11]通过转录组技术分析了抗、感赤霉病的小麦材料接种病菌前后的基因表达差异,推测出两种可能的赤霉病抗性机制。Schweiger等[12]利用转录组学方法挖掘出了与抗赤霉病相关的脂质转移酶(LTP)基因和UDP-葡萄糖基转移酶(UTG)基因。同时,Li[13]通过基因功能验证证实,UDP-葡萄糖基转移酶基因具有赤霉病抗性。由此可见,转录组测序在筛选及挖掘抗病基因方面发挥着重要作用。
小麦品种西农979是由西北农林科技大学育成的冬性早熟、高产优质、综合抗性强的优良品种,于2005年通过国审,截止2017年累计推广面积约860×104hm2,是关中和黄淮麦区重要的小麦品种,经中国农科院植保所鉴定,对赤霉病表现为中抗[14]。张玲丽等[15]经过多年多点跟踪调查证实,西农979对小麦赤霉病具有良好的田间抗性。本研究拟利用转录组测序技术,全面分析西农979及感病品种周麦18在被禾谷镰刀菌侵染后的基因表达差异,为深入挖掘西农979的抗病基因及揭示其抗病机理奠定基础,为今后小麦赤霉病抗源的有效利用提供理论指导。
1 材料与方法
1.1 供试材料
供试植物材料中抗赤霉病小麦品种西农979和感赤霉病小麦品种周麦18均由西北农林科技大学农学院小麦遗传育种新技术创新团队提供。供试材料种植于西北农林科技大学试验田及温室,其中,试验田中的材料用于田间发病情况调查,而温室中的材料用于转录组测序。供试的禾谷镰刀菌菌株BN-8由西北农林科技大学植物保护学院提供。
1.2 赤霉病田间鉴定方法
采用单花滴注法接种赤霉病菌。开花期的小麦在穗轴中部左右两个基部小花各接种10 μL禾谷镰刀菌BN-8孢子液(浓度约为1×105个·mL-1),接种后将小穗套袋保湿,20 h后摘袋,接种后第21天观察记录赤霉病的发病情况。依据《中华人民共和国国家标准—小麦赤霉病测报技术规范》(GB/T15796-2011)[16],调查西农979和周麦18出现穗腐症状的发病小穗数及小穗病情严重度。计算病情指数,用以反映病害发生的平均水平和严重程度。
1.3 转录组测序样品的准备
温室中,西农979和周麦18接种赤霉病菌的方法同1.2。待材料开花后,于接种病菌前先取西农979的整穗颖壳,然后对西农979和周麦18的小穗接种禾谷镰刀菌株BN-8,并分别在接种12、24和96 h后取西农979与周麦18整穗颖壳,于-80 ℃保存备用。
1.4 RNA提取和反转录
样品总RNA的提取按照RNAprep Pure Plant Kit(TIANGEN, China)试剂盒提供的操作流程进行,获取总RNA后,使用Transcriptor First Strand cDNA Synthesis Kit(Roche, Basle, Switzerland)试剂盒反转录cDNA第一链,再经cDNA第二链合成、末端修复、连接测序接头和电泳切胶回收,得到cDNA,并进行测序。以上工作在北京百迈客生物科技有限公司完成。
1.5 转录组测序及基因表达定量分析
使用Illumina高通量测序平台对cDNA文库进行测序,每个处理进行3次生物学重复。测序产出大量高质量的原始数据(Raw data),经过测序质量控制得到Clean data。使用HISAT2[17]将中国春基因组作为参考进行序列比对,利用StringTie[18]对比对上的Reads进行组装和定量。采用FPKM[19](Fragments Per Kilobase of transcript per Million fragments mapped)作为衡量转录本或基因表达水平的指标,对样品中Mapped Reads的数目和转录本长度进行归一化,使片段数目能真实地反映转录本的表达水平。
1.6 差异表达基因的筛选和功能注释
使用DEseq[20]进行有生物学重复的两组样品间的差异表达分析,将Fold Change≥4且FDR<0.001作为筛选标准。差异倍数(Fold change)指两样品组间表达量的比值。错误发现率(False discovery rate,FDR)通过Benjamini-Hochberg校正方法对原有假设检验得到的显著性P值(Pvalue)进行校正得到。随后,对差异表达基因进行GO(Gene ontology)(http://www.geneontology.org/)和KEGG(Kyoto encyclopedia of genes and genomes)(http:// www.genome.jp/kegg)基因注释和通路富集 分析。
1.7 荧光定量PCR验证差异表达基因
选取7个转录组测序得到的差异表达基因,根据其全长cDNA序列,使用Primer Premier 5.0设计引物,以小麦TaActin基因为内参(表1)。使用FastKing RT Kit(With gDNase)(TIANGEN, China)试剂盒将样品RNA反转录为cDNA,按照SYBRGreen Realtime PCR Master Mix(QPK-201)说明书的反应体系和反应条件,使用ABI 7500 Real-Time PCR System(Life Technologies, America)进行荧光定量PCR反应,按照2-△△Ct算法计算基因相对表达量,每个样品进行4次技术重复。

表1 荧光定量PCR所用引物Table 1 Primers used for real-time PCR
2 结果与分析
2.1 西农979和周麦18田间抗病性鉴定结果
田间抗性鉴定结果表明,西农979病情严重度为0~2级,其中,0级2穗,1级15穗,2级3穗,75%的接种小穗为1级,病情指数为26.25;而周麦18病情严重度为0~4级,0级1穗,1级9穗,2级2穗,3级4穗,4级4穗,病情指数为51.25。小麦品种西农979与周麦18相比,具有较好的赤霉病田间抗性。
2.2 转录组测序数据及其质量控制
本研究取未接种的西农979小穗颖壳及接种后12 h、24 h、96 h的西农979和周麦18的小穗颖壳,每个处理3个重复,共计21组样品进行转录组测序分析。经质量控制,共获得135.33 Gb Clean data,每个处理的测序深度为6.18~ 6.84 Gb,测序质量Q30碱基百分比在 93.62%~ 94.88%之间,GC含量在53.65%~55.67%之间(表2)。分别将各处理的Clean reads与中国春参考基因组进行序列比对,比对效率为 86.05%~89.59%,表明转录组测序质量好,与参考基因组的比对率高。
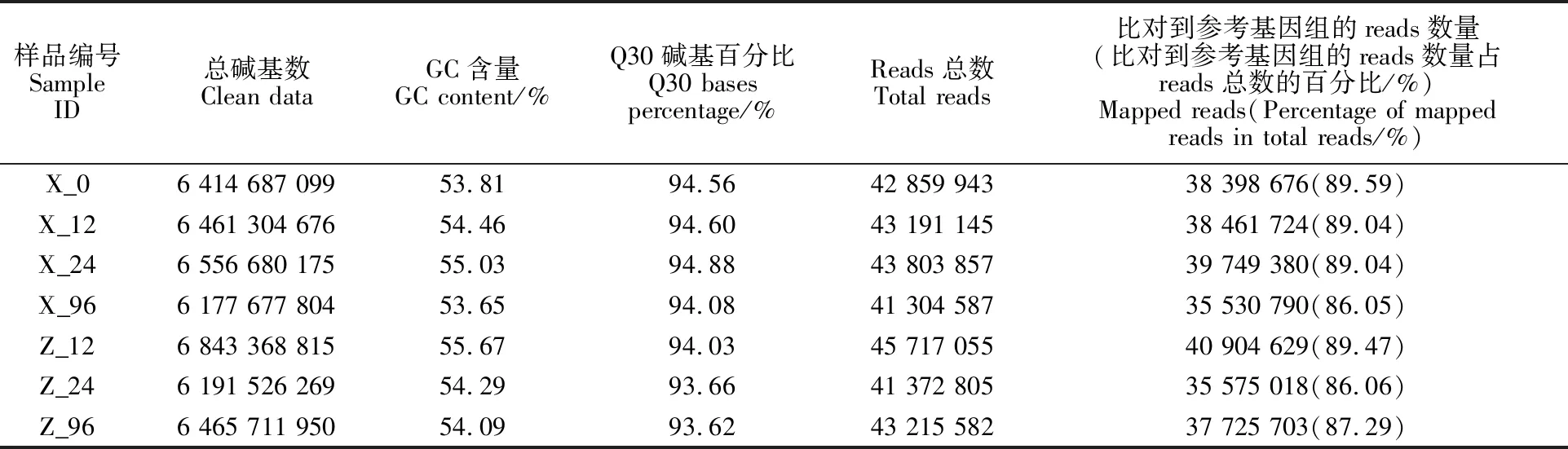
表2 转录组测序结果与比对效率Table 2 Transcriptome sequencing results and alignment efficiency
2.3 差异表达基因分析
本研究筛选了在接种病菌后12、24、96 h三个时间点未接种的西农979与接种的西农979(称为对照组合)之间的差异表达基因和接种的周麦18与接种的西农979(称为实验组合)之间的差异表达基因。结果(表3)显示,对照组合和实验组合在三个时间点均出现不同数量的差异表达基因,24 h时差异表达基因个数最多,分别为 3 140和8 864。使用韦恩图展现差异表达基因,发现两个组合在12、24、96 h时共同差异表达基因个数分别为14、1 978、142(图1A、1B、1C)。其中,有1个基因在12、24 h时都出现差异表达,11个基因在24和96 h时都出现差异表达,没有在三个时间点均出现差异表达的基因(图1D)。综合三个时间点的数据,共筛选出2 122个共同差异表达基因,这些基因可能与西农979的赤霉病抗性有关。

表3 各样本间差异表达基因统计Table 3 Statistics of differentially expressed genes between samples
2.4 共同差异表达基因的GO功能注释
将2 122个共同差异表达基因与GO数据库进行比对,有1 713个基因被注释,可分为生物过程、细胞组分、分子功能3个大类和43个亚类(图2)。其中,生物过程大类含有18个亚类,基因数量最多的3个亚类是代谢过程、细胞过程和单有机体过程,分别为830、735和648个,此外还有应激反应、生物调控、信号转导、解毒作用、免疫系统过程等亚类;细胞组分大类含13个亚类,细胞部件和细胞亚类包含基因数最多,均为991个,其次是细胞器亚类,含851个,膜、细胞器部件、膜部件含有的基因也较多,大分子复合物、细胞胞外区域等所含基因较少;分子功能大类包含有12个亚类,其中涉及结合和催化活性的基因最多,分别有805和734个,其余亚类为转运活性、电子转运活性、核酸结合转录因子活性、抗氧化活性、转录因子活性等。

A:接种后12 h差异表达基因韦恩图;B:接种后24 h差异表达基因韦恩图;C:接种后96 h差异表达基因韦恩图;D:接种后12、24、96 h共同差异表达基因韦恩图。
2.5 共同差异基因的KEGG通路富集分析
将共同差异表达基因与KEGG数据库进行比对,有405个基因得到注释,共涉及到89条信号通路。这些通路中有70条参与代谢,10条参与遗传信息过程,4条参与细胞过程,3条参与环境信息过程,2条参与有机系统。其中,内质网中的蛋白质加工通路中富集的基因最多,有48个,约占11.85%;其次是光合作用-天线蛋白通路,包含41个差异基因,约占10.12%;淀粉和蔗糖代谢通路中注释到30个差异基因,约占7.41%;27个差异基因参与植物激素信号转导通路,约占 6.67%(图3)。植物-病原体相互作用通路中富集到19个差异基因,谷胱甘肽代谢、磷酸戊糖途径等与植物抗性相关的通路中也含有较多差异基因。此外,KEGG比对结果中还涉及多种氨基酸、维生素、糖类、酯类及萜类物质的合成代谢通路。在通路富集显著性上,差异基因在光合作用-天线蛋白、植物昼夜节律、内质网中的蛋白质加工、萜骨架的生物合成及类胡萝卜素的生物合成等通路中的富集最为显著(表4)。

表4 差异表达基因显著富集的KEGG通路Table 4 KEGG pathways significantly enriched by differentially expressed genes

1:代谢过程;2:细胞过程;3:单有机体过程;4:应激反应;5:生物调控;6:定位;7:细胞组分组织或生物合成;8:发育过程;9:多细胞组织过程;10:生殖;11:生殖过程;12:多有机体过程;13:信号转导;14:生长;15:解毒作用;16:免疫系统过程;17:生物黏附;18:节律过程;19:细胞部件;20:细胞;21:细胞器;22:膜;23:细胞器部件;24:膜部件;25:大分子复合物;26:细胞胞外区域;27:膜结合蛋白;28:细胞连接;29:超分子复合物;30:细胞外区域部分;31:类核;32:结合;33:催化活性;34:转运活性;35:电子转运活性;36:核酸结合转录因子活性;37:结构分子活性;38:抗氧化活性;39:分子功能调节器;40:信号转导活性;41:分子转导活性;42:营养库活性;43:转录因子活性,蛋白质结合。
2.6 共同差异表达基因的功能归类及表达
根据共同差异表达基因的注释情况,对其进行功能归类,有27个基因被归入在植物抗病反应中扮演重要角色的植物激素信号转导通路中。其中,与生长素相关的基因最多,有12个;与茉莉酸和赤霉素相关的基因最少,各有3个;9个基因与脱落酸有关(表5)。没有发现与乙烯及水杨酸相关的共同差异表达基因。此外,有3个基因参与玉米素生物合成和1个基因参与油菜素类固醇生物合成。在植物—病原体互作通路中有10个基因参与病原物相关分子模式触发免疫(PTI),9个基因与效应子触发免疫(ETI)相关(表5)。PTI中的1个钙调素基因(CALM)也参与磷酸肌醇信号通路;参与ETI的4个分子伴侣HtpG基因(HSP90A,htpG)及4个热休克蛋白 90 kDa beta基因 (HSP90B,TRA1)也出现在内质网中的蛋白质加工通路中。此外,还筛选到一些脱毒相关蛋白基因,包括2个UDP-葡萄糖基转移酶基因、9个谷胱甘肽转硫酶(GST)基因和3个ATP结合盒转运蛋白(ABC transporter)基因。

表5 共同差异表达基因功能归类Table 5 Functional classification of common differentially expressed genes

1:胞吞作用;2:过氧化物酶体;3:吞噬体;4:植物激素信号转导;5:内质网中的蛋白质加工;6:剪接;7:泛素介导的蛋白水解;8:核糖体;9:蛋白质输出;10:光合作用—天线蛋白;11:淀粉和蔗糖代谢;12:碳代谢;13:苯丙烷生物合成;14:萜类骨架的生物合成;15:半乳糖代谢;16:谷胱甘肽代谢;17:氨基酸的生物合成;18:糖酵解/糖异生;19:甘油磷脂代谢;20:半胱氨酸和蛋氨酸的代谢;21:甘油脂代谢;22:类胡萝卜素的生物合成;23:光合作用;24:泛醌和其他萜类醌的生物合成;25:磷酸戊糖途径;26:果糖和甘露糖代谢;27:硫代谢;28:脂肪酸代谢;29:光合生物中的碳固定;30:不饱和脂肪酸的生物合成;31:莨菪烷,哌啶和吡啶生物碱的合成;32:丙酮酸代谢;33:苯丙氨酸代谢;34:酪氨酸代谢;35:牛磺酸和牛磺酸的代谢;36:类固醇生物合成;37:甘氨酸,丝氨酸和苏氨酸的代谢;38:类黄酮生物合成;39:氰氨基酸代谢;40:角质,琥珀和蜡的生物合成;41:花生四烯酸代谢;42:苯丙氨酸,酪氨酸和色氨酸的生物合成;43:脂肪酸延长;44:脂肪酸生物合成;45:生物素代谢;46:抗坏血酸和藻酸盐代谢;47:硫胺素代谢;48:维生素B6代谢;49:昼夜节律-植物;50:植物病原体相互作用。
转录组测序结果中差异基因的表达情况显示,植物激素信号转导通路中的27个基因均在接种后24 h于对照组合和实验组合中同时出现差异表达。其中,蛋白磷酸酶2C基因、丝氨酸/苏氨酸蛋白激酶SRK2基因和ABA反应元件结合因子基因上调表达;生长素内流载体基因、脱落酸受体PYR/PYL家族基因、冠菌素不敏感蛋白1基因和茉莉酸ZIM结构域蛋白基因下调表达;生长素响应蛋白基因有2个下调表达,4个基因上调表达;SAUR家族蛋白基因有2个基因下调表达,3个基因上调表达;光敏色素互作因子基因有1个基因下调表达,2个基因上调表达。在植物-病原体互作通路的19个基因中,除钙调素基因在接种后96 h同时出现上调表达外,其余18个基因均在接种后24 h出现差异表达。其中,钙结合蛋白基因、抗病蛋白RPM1基因、分子伴侣HtpG基因和热休克蛋白 90 kDa beta基因上调表达;丝裂原活化蛋白激酶激酶 4/5基因下调表达;WRKY转录因子33基因在对照组合中下调表达而在实验组合中上调表达。
2.7 差异表达基因的荧光定量PCR验证
为验证转录组测序结果数据的准确性,选取分子伴侣HtpG、丝裂原活化蛋白激酶激酶4/5、热休克蛋白90 kDa beta、冠菌素不敏感蛋白1、ABA反应元件结合因子和生长素内流载体共6个于24 h时在对照组合和实验组合中同时呈现差异表达的基因及在96 h时出现共同差异表达的1个钙调素基因,设计引物,进行荧光定量PCR。结果(表6)显示,这些基因表达趋势与转录组测序所得结果基本一致,证明测序结果准确。

表6 荧光定量PCR结果与转录组测序结果对比Table 6 Comparison of real-time PCR results with RNA-seq results
3 讨 论
本研究对病菌接种后12、24和96 h的西农979和周麦18的颖壳进行了转录组测序分析,以未接种的西农979颖壳作为对照,获得了抗感赤霉病的两小麦品种经禾谷镰刀菌侵染后的基因表达情况。将接种的西农979与未接种的西农979称为对照组合,接种的西农979与接种的周麦18称为实验组合,按对应的时间点对样品进行差异表达基因筛选。对照组合筛选到的基因反映了西农979接种禾谷镰刀菌后基因表达的变化情况,包含了西农979中所有对病菌侵染作出响应的基因。实验组合筛选到的基因则反映了西农979和周麦18被病菌侵染后基因表达的差异情况,其中包含赤霉病抗性相关基因以及因品种不同背景产生的差异表达基因,不包括两品种共有的响应病菌侵染的部分基因。将筛选到的两组差异基因取交集,即可排除两小麦品种种质背景的差异,得到西农979相对于周麦18特有的赤霉病抗病基因,这些基因可能赋予了西农979比周麦18更强的赤霉病抗性。
共同差异表达基因的GO功能注释结果说明,小麦品种西农979对赤霉病的抗性反应主要发生在细胞内部,涉及细胞器、膜结构等组分,同时也发生在细胞连接和细胞外部区域等部位,通过调节结合、催化活性、转运活性、信号转导活性、转录因子活性以及抗氧化活性等分子功能,引起代谢过程、细胞过程和单有机体过程为主,生物调控、信号转导、解毒作用、免疫系统过程等一系列生物过程的协同变化,抵抗病菌的入侵,减轻其毒素的毒害作用。共同差异表达基因的KEGG通路分析结果中涉及到的代谢通路可能与西农979的赤霉病抗性有关。除抗病相关通路外,结果中还涉及到谷胱甘肽、多种氨基酸、维生素、糖类、酯类等多种物质的合成代谢通路,这些物质有些是植物激素的前体物质,有些可能对赤霉病抗性有直接影响,有些则可能进一步形成影响赤霉病抗性的物质。显著富集的代谢通路中共同差异基因的富集程度显著高于其他代谢通路,对揭示西农979赤霉病抗性机理具有较大参考价值。在两组合的共同差异表达基因中出现了部分与昼夜节律相关和光合作用相关的基因,除了病菌入侵所致外,还可能与样品的取样时间有关。取样的时间不同,植物可能处于不同的生物节律时期,相关基因表达出现差异,而取样时植物所处的不同光照条件会对光合作用相关基因的表达产生部分影响。提前处理样品,统一取样时间,有助于减少生物节律及光照等环境条件变化造成的干扰。
前人研究表明,遭受病原菌入侵时,植物会通过茉莉酸、水杨酸和乙烯等信号分子及复杂的信号网络激发抗病基因的表达,进而产生对病原菌的抗性[8]。本研究在植物激素信号转导通路中筛选到27个共同差异表达基因,涉及生长素、脱落酸、赤霉素和茉莉酸通路。在测序结果中没有筛选到水杨酸和乙烯等通路的相关基因,提示这些信号通路没有参与西农979赤霉病抗性的产生过程。事实上,前人对水杨酸和乙烯等途径在小麦赤霉病抗性上所起作用的研究结果有很大差异。马 信[6]利用水杨酸处理感病小麦品种的穗部后发现其赤霉病发病率显著下降,认为水杨酸在小麦抗赤霉病中起重要作用。而Xiao等[10]在抗病小麦品种望水白和其感病突变体NAUH117的对比研究中发现水杨酸途径没有参与抗禾谷镰刀菌侵染的响应过程。本研究关注了水杨酸信号通路中的基因在本实验几组样品中的表达情况,发现对照组合仅在病菌侵染96 h时有2个病程相关蛋白(Pathogensis-related protein 1,PR1)基因出现差异表达,受到病菌入侵后西农979中水杨酸通路信号转导出现了变化,但这两个基因在实验组合中没有显著的表达差异,说明它们不是导致西农979比周麦18赤霉病抗性更强的关键基因,我们推测水杨酸通路与西农979的赤霉病抗性无太大关系。乙烯虽然是植物防御病原菌入侵的重要触发信号,但乙烯通路对小麦赤霉病抗性的作用尚存在争议[7]。本研究没有筛选到乙烯通路上的相关基因,推测西农979的赤霉病抗性与乙烯通路无关。以上结果表明,在植物激素信号转导的复杂网络中,生长素、脱落酸、赤霉素和茉莉酸通路及相关差异表达基因与西农979的赤霉病抗性有密切的关系,应是后续研究的重点。植物—病原体互作通路与植物对病原物入侵的响应关系密切,本研究筛选到7类共19个该通路上的相关基因,推测它们在西农979抗禾谷镰刀菌入侵时发挥了重要作用。这些基因有些已被证实与小麦赤霉病抗性相关,如小麦中转录因子TaWRKY45基因超量表达会使转基因小麦对赤霉病的抗性显著提高[21]。然而另一些基因与赤霉病抗性相关的报道较少,具有进一步探究的 价值。
植物体内还有许多具有抗性功能的分子,病程相关蛋白(PRs)、脱毒相关蛋白、抗菌肽(AMPs)和一些转录因子等都可能参与植物的抗病过程。UDP-葡萄糖基转移酶是典型的脱毒相关蛋白,它能将禾谷镰刀菌分泌的DON毒素糖基化,减弱其毒性,这是小麦赤霉病抗扩展型抗性的一种重要途径[22]。UDP-葡萄糖基转移酶基因、谷胱甘肽转硫酶基因和ATP结合盒转运蛋白基因均与禾谷镰刀菌产生的单端孢霉烯族毒素类(如DON毒素)的去毒化反应有关[23-25]。在本研究中,我们筛选到2个UDP-葡萄糖基转移酶基因、9个谷胱甘肽转硫酶(GST)基因和3个ATP结合盒转运蛋白基因,这些基因在DON毒素脱毒方面发挥着重要作用,是西农979赤霉病抗性的重要组成部分,有必要进一步验证它们的功能,探究它们在小麦赤霉病抗性反应中的具体作用机制。
最近,Su等[26]和Li等[27]分别成功克隆了小麦3BS染色体上的抗赤霉病QTL位点Fhb1,该基因编码一个富含组氨酸的钙结合蛋白,禾谷镰刀菌侵染后Fhb1基因的表达量会显著上调。此前,张玲丽等[15]通过分子鉴定方法发现西农979具有与高抗赤霉病小麦品种苏麦3号相同的抗病基因Fhb1。在本研究中,我们使用BLASTn找到了西农979和周麦18中3BS染色体上的Fhb1基因,发现西农979中该基因在病菌接种前后表达量没有发生显著变化,而与接种后的周麦18相比,接种后的西农979中Fhb1基因的表达量更低,这说明禾谷镰刀菌的侵染没有诱导西农979中3BS染色体上Fhb1基因的表达,该基因可能没有参与西农979对小麦赤霉病的抗性反应。我们推测西农979中可能还存在着其他抗赤霉病基因。
本研究通过转录组测序的方法,鉴定了抗赤霉病小麦品种西农979的抗赤霉病基因,揭示了西农979在抗小麦赤霉病过程中的基因调控情况,为今后进一步挖掘小麦抗赤霉病基因、验证基因功能、阐释小麦抗赤霉病的分子机制提供了 依据。

