原发性甲旁亢中异位甲状旁腺腺瘤的MDCT 表现
潘召城 徐学勤 方文强 严福华 芮炜玮 华子辰 宋 琦
原发性甲状旁腺功能亢进症(primary hyperparathyroidism,PHPT)是指由甲状旁腺本身病变引起的甲状旁腺激素 (parathyroid hormone,PTH)合成与分泌过多,从而导致的一系列病理生理改变。随着临床对该疾病认识的加深以及血钙筛查、PTH 检测以及影像学检查手段的不断完善,我国PHPT 的检出率有上升趋势[1]。PHPT 主要由甲状旁腺腺瘤(parathyroidadenoma,PTA)引起,大多数腺瘤为原位病灶,发生在甲状腺上、下极背侧的甲状旁腺。异位甲状旁腺腺瘤(ectopic parathyroid adenoma,EPA)比较少见,由于其发生部位的多变性和不典型性,对临床治疗尤其是外科手术定位带来了一定的难度。本文收集近年来在我院确诊的异位甲状旁腺腺瘤病例,总结其发病部位及MDCT 表现,旨在提高对该疾病的认识。
方 法
1.一般资料
收集2012 年1 月至2019 年3 月在我院诊断的有完整临床及CT 资料的PHPT 患者,并经手术切除病理证实为异位甲状旁腺腺瘤的病例19例,均为单发,共计19 处病灶。其中男性6例,女性13例,年龄33 ~76(56±14)岁。本组采用的PHPT 诊断标准为符合以下条件:①血清PTH 水平升高且伴有血钙升高或处于正常水平高值;②伴或不伴有典型的临床症状如反复泌尿道结石、骨痛等;③排除其他原因如慢性肾病、肾移植、肿瘤等引起的继发性、三发性及假性甲状旁腺功能亢进等其他疾病。
2.检查方法
扫描采用美国GE 公司的lightspeed VCT 64排和Discovery CT750 64 排多层螺旋CT,管电压120kV,管电流250mA,所有患者均行颈部及胸部增强扫描,扫描范围上至颅底、下至肺底,层厚及层间距均为2.5mm,对比剂为德国Bayer 公司的碘普罗胺(商品名优维显)注射液80ml,碘浓度370mgI/ml,注射速率2ml/s,注射对比剂后50 ~60 秒后进行增强扫描。
3.图像分析
图像由两位从事放射诊断工作10 年以上的放射科医生,在PACS 系统上独立阅片,测量并记录病灶的位置、形态、横断面最大径及最小径、有无钙化、平扫及增强CT 值、强化均匀程度等,诊断结果不同时经讨论得出一致结论。
结 果
1.EPA 发生部位
19例病灶中,颈部病灶8例,均位于气管及食管周围区域,其中气管食管沟5例,食管旁2例,气管旁1例;纵隔病灶11例,其中前上纵隔胸骨后6例,主动脉弓上血管间隙内2例,中纵隔2例,前上纵隔锁骨头后方1例。
2.EPA 的形态、大小
本组19例EPA 大部分形态规则,在横断面图像上10例病灶呈类圆形,7例为三角形,剩余2例为不规则形。病灶边界均清晰,与周围组织无粘连,最大者为4.1cm×2.6cm,最小者0.8cm×0.4cm,最大径0.8 ~4.1(1.8±1.0)cm。
3.EPA 的CT 表现

图1 女,53岁,气管右侧旁EPA。A.CT 平扫轴位示病灶位于气管旁(白箭),呈类圆形,1.7cm×1.0cm,CT 值51HU;B. 增强扫描强化不均匀,其内有小片低密度欠强化区提示为坏死囊变,肿瘤实质部分明显强化,CT 值233HU。
病灶平扫CT 值范围20 ~63(38±12)HU,其内均未发现钙化;增强后呈明显强化,CT 值94 ~233(138±38)HU。大部分病例强化均匀,少数强化不均匀,内见小片的不强化区(图1 ~3)。在本组19例病灶中,不均匀强化的病灶有7例,比例为36.8%,该7例病灶平均最大径为2.5cm;进一步分析发现,在6例最大径>2.0cm 的病灶中,有5例病灶不均匀强化,比例达83.3%。
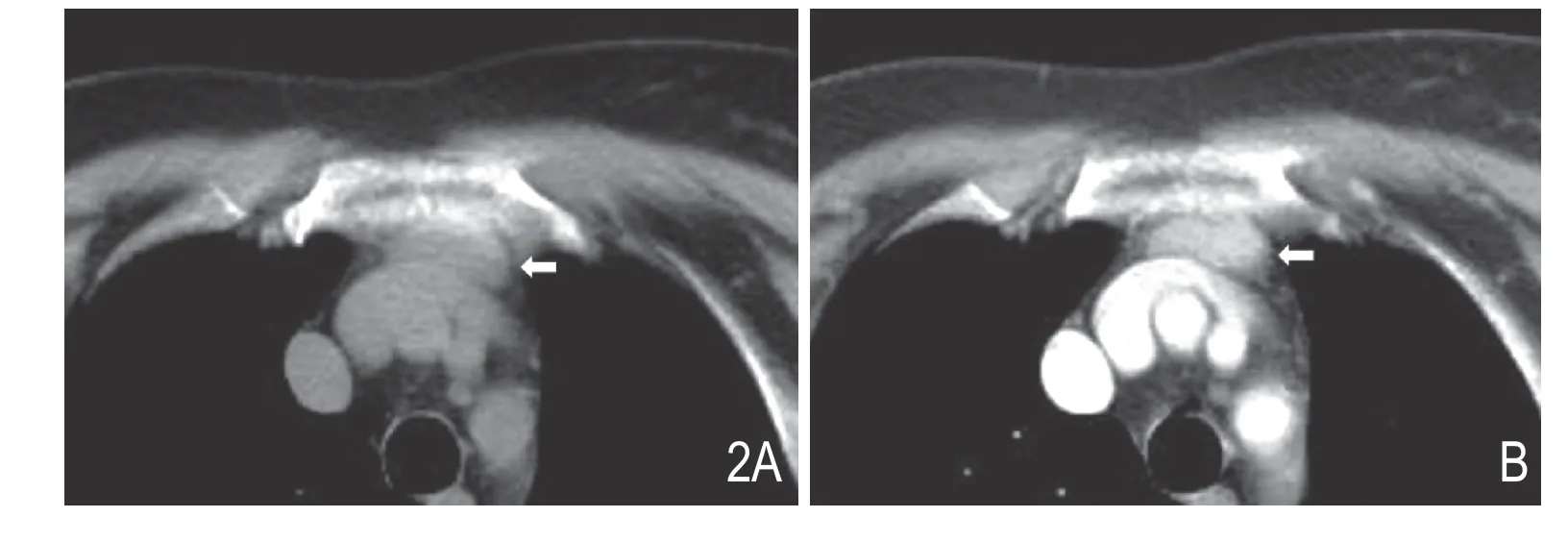
图2 女,65岁,前上纵隔胸骨后EPA。A. CT 平扫轴位示病灶位于前上纵隔胸腺窝内(白箭),形态为类圆形,2.3cm×1.0cm,密度均匀,CT 值37HU;B. 增强扫描病灶明显均匀强化,其内无坏死,CT值124HU。

图3 女,37岁,前上纵隔胸骨后EPA。A. CT 增强轴位示前纵隔胸腺窝内结节(白箭),1.3cm×0.7cm,病灶形态规则呈类圆形,密度均匀;B. 术后病理HE×50,胸腺组织(黑箭)中可见异位甲状旁腺腺瘤(白星),腺瘤与周围胸腺有纤细的纤维分隔,肿瘤细胞呈多边形,细胞胞质淡粉染或透明,细胞核圆形,未见核分裂象。
讨 论
甲状旁腺功能亢进症(hyperparathyroidism)分为四大类,包括原发性、继发性、三发性和假性甲状旁腺功能亢进症,其中原发性甲状旁腺功能亢进症是由甲状旁腺本身病变引起的甲状旁腺激素合成与分泌过多所致。PHPT 主要由甲状旁腺腺瘤引起,约占85%(单发80%,多发5%),其次为甲状旁腺增生(10%~15%),极少数(<1%)由甲状旁腺癌引起[2]。手术是目前PHPT 最有效的治疗方法,而异位病变是造成手术失败的最常见原因[3],因此准确的影像学定位诊断对手术十分重要。
深入了解甲状旁腺的组织胚胎学和解剖学知识是诊断异位甲状旁腺腺瘤的基础。人体有上、下共两对甲状旁腺,分别位于左右两侧甲状腺的背面,异位甲状旁腺临床较少见,发生率约3%~10%。上甲状旁腺起自第四对鳃囊,与甲状腺侧叶一起发生,位置相对固定,胚胎发育过程中因重力作用可降至喉返神经后方、甲状腺下动脉下方及后上纵隔、颈动脉鞘内等,成为异位上甲状旁腺病灶;下甲状旁腺和胸腺起自第三对鳃囊,并随之一同下降,途中可停留于如上腔静脉根部、肺动脉、升主动脉、主动脉弓附近等不同部位,从而形成异位病灶[3]。文献报道EPA 的最常见部位是胸骨上窝及前上纵隔,后者主要包括胸骨后区、锁骨头后方及头臂静脉-锁骨下静脉走形区域等;其次为后上纵隔食管旁、颈动脉鞘等[3];其他罕见部位则还包括如甲状腺内、梨状窝、前心包、迷走神经内及舌下神经内[4-7]等。由于EPA 发生部位的多变性,容易造成临床的漏诊、误诊,导致不必要的多次手术,有文献报道在PHPT 二次手术的患者中,异位病灶的比例最高可达66%[8]。本组19例异位病灶中,颈部病灶大部分位于气管食管沟,纵隔病灶主要位于前上纵隔胸骨后区域,少数病灶异位在主动脉弓上的血管间隙或中纵隔等部位。结合本组EPA 的异位位置及既往文献报道,笔者总结在对异位病灶进行定位诊断时,应重点关注在上至甲状腺下极、下至气管分叉、左右至两侧锁骨头水平的区域内仔细排查可疑病灶,同时尤其需要注意气管食管沟和前上纵隔等好发部位。
目前在PHPT 诊断中常用的影像学检查方法包括超声、CT、MRI 以及核素显像。超声操作简便、对PTA 原位病灶诊断准确度较高,但对于异位病灶由于其位置常较深、与淋巴结鉴别困难等原因,诊断价值十分有限[3]。磁共振检查耗时较长,费用也相对高昂,因此在PHPT 诊断中的应用不多。放射性核素显像在PTA 的诊断中有重要价值,特别是SPECT/CT兼顾了核素功能成像及CT解剖定位精准的优点,诊断准确性尤为突出,有文献报道其对PHPT 的定位诊断准确度达98%以上[9],对异位病灶诊断的敏感度也高达92%[10];然而核素显像对于设备要求较高,一般基层医院未设有核医学科,无法进行该类检查。
MDCT 在临床上应用广泛,拥有成像速度快、空间分辨率高等优势,对PTA 的定位和定性诊断有较高的价值[11],对于检出异位病灶有很大的帮助。对于拟诊PHPT 患者的术前定位检查,应完善颈部及胸部薄层(层厚≤2.5mm)增强CT 扫描,该扫描范围覆盖了EPA 的主要异位部位,以避免漏诊的发生。EPA 在临床上较少见,既往研究主要探讨发生在甲状旁腺的原位PTA 的影像表现,针对EPA 的研究很少。原位PTA 在CT 上表现为甲状旁腺区的等-低密度结节,不伴钙化,增强后明显强化,肿瘤内可出现坏死囊变区[11-12]。通过对本组19例EPA 的影像资料进行分析总结,发现其CT 表现与既往文献报道的原位PTA 病灶基本一致。EPA 形态多样,在CT横轴位图像上常呈类圆形,其次为三角形,少数为不规则形。病灶在平扫时密度通常与肌肉及血管接近,不易分辨,因此CT 平扫的诊断价值有限。由于肿瘤的间质血供丰富,增强后明显强化,强化程度较肌肉高而较血管和甲状腺组织低,有利于病灶的发现与检出。本组19例病灶平扫CT 值20 ~63(38±12)HU,增强后均呈明显强化,CT 值94 ~233(138±38)HU,平均强化值近100HU,这种强化方式印证了EPA 为富血供肿瘤。文献报道的PTA 病灶内合并囊变坏死的比例为24.2%~33.3%[11-12],本组19例异位病灶中有7例(36.8%)增强后不均匀强化、内见小片低密度区,提示病灶内存在小部分囊变坏死,较文献报道的比例略高,分析原因为本组病例的体积相对较大,平均最大径为1.8cm,而大病灶更容易发生囊变坏死:在6例最大径>2.0cm 的病灶中有5例(83.3%),内见囊变坏死,故本组病例的总体囊变坏死率较高。
EPA 尤其需要注意与淋巴结相鉴别,在增强CT上EPA 表现为明显强化的结节,而淋巴结则通常为轻-中度强化,这是两者的主要鉴别点。此外,还需要与甲状旁腺增生及甲状旁腺癌相鉴别。甲状旁腺增生通常体积较小,且一般累及多个腺体组织,因此多发小病灶时提示为甲状旁腺增生的可能性大。甲状旁腺癌临床较少见,肿瘤内可见钙化,常侵犯邻近结构并伴有淋巴结肿大。
综上所述,EPA 临床较少见,在CT 上表现为边界清晰且明显强化、密度均匀的富血供结节,大病灶则常呈不均匀强化。增强CT 对于PHPT 患者的术前定位有重要的参考价值,在疑诊为EPA 时,建议完善颈部及胸部薄层(层厚≤2.5mm)增强CT 扫描,并在常见的异位部位如气管食管沟、前上纵隔等区域仔细寻找可疑病灶,以避免漏诊。

