经导管主动脉瓣置换术中国专家共识(2020 更新版)
中国医师协会心血管内科医师分会结构性心脏病专业委员会
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR),又称经导管主动脉瓣置入术(transcatheter aortic valve implantation,TAVI),是指将组装完备的人工主动脉瓣经导管置入到病变的主动脉瓣处,在功能上完成主动脉瓣的置换。自2002年首例成功以来[1],TAVR已成为老年主动脉瓣狭窄(aortic stenosis,AS)患者的一线治疗手段。欧美国家相继颁布并更新了TAVR的指导性文件[2-6]。我国TAVR发展相对缓慢,2010年10月3日开展了首例TAVR[7]。但自2017年两款国产瓣膜上市以来,我国TAVR进入快速、全面发展阶段。中国医师协会心血管内科医师分会结构性心脏病专业委员会及中华医学会心血管病学分会结构性心脏病学组于2015年底发布了我国首个TAVR指导性文件《经导管主动脉瓣置换术中国专家共识》[8],其对TAVR在我国的初期推广起到积极引导作用。自该文件发布以来,国内外TAVR在器械研发、临床研究、应用经验等方面均取得重大进展。为及时更新对TAVR的认识,促进TAVR在我国健康、规范、快速发展,故更新了此专家共识。
1 主动脉瓣疾病流行病学特点
在西方国家,AS是老年人群常见心脏疾病,其发病率随着年龄增长逐渐增高,在年龄≥65岁人群中约占2.0%,在≥85岁人群中约占4%[9-10]。我国尚无AS确切流行病学数据。一项单中心超声心动图数据库分析提示我国AS发病率可能低于国外[11]。其他一些间接性的调查研究显示,相对于西方国家,我国TAVR候选患者和西方国家存在一些差异:二叶式主动脉瓣(bicuspid aortic valve,BAV)比例较高、主动脉瓣钙化程度较高、主动脉瓣反流(aortic regurgitation,AR)多于AS、风湿性病因比例高、股动脉内径较细[11-15]。在接受TAVR的BAV患者各解剖亚型的构成比中,我国患者0型(无嵴型)占比较西方国家高[12]。虽然我国TAVR候选人群中BAV的比例较高,但是,一项单中心研究显示,我国重度AS患者中BAV的比例(60~80岁约为50%,≥80岁约为20%)可能与国外接近[16]。另外一项基于超声心动图数据库大样本人群分析显示,我国BAV发病率及并发症发生率与西方人群接近[14]。
2 国内外TAVR开展现状
基于PARTNER2研究[4]及SURTAVI研究[5]的结果,目前欧美指南已将外科手术极高危、高危及中危患者列为TAVR的适应证。2019年美国心脏病学会(American College of Cardiology,ACC)公布了低危患者TAVR的研究包括PARTNER 3研究(使用球扩式瓣膜Sapien 3)[17]和Evolut Low Risk Trial研究(使用自膨式瓣膜Evolut R)[18],显示外科手术低危患者接受TAVR的效果优于或不劣于外科手术。基于这两项研究结果,2019年美国和欧洲政府部门批准Sapien 3及Evolut R人工瓣膜应用于外科手术低危患者。截至2019年底,国外已有十几种TAVR瓣膜获批上市应用于临床,全球共完成超过40万例TAVR。
2017年5月,两款国产瓣膜(Venus-A和J-Valve)获批上市;2019年7月另一国产瓣膜(VitaFlow)获批上市。Venus-A瓣膜、VitaFlow瓣膜为经外周动脉逆行入径的自膨式瓣膜。J-Valve为经心尖入径瓣膜,可治疗AS和AR。国产瓣膜的上市,推动了我国TAVR的快速发展。截至2019年底,全国已有20多个省市、约200家医院共完成4000余例TAVR,其中2019年完成了2600多例。我国在TAVR方面积累了自己的经验。目前从我国几大中心经验看来,BAV和三叶式主动脉瓣(tricuspid aortic valve, TAV)的TAVR效果比较,差异无统计学意义[19-22]。J-Valve瓣膜具有锚定装置,适合于AR患者的治疗。我国在AR患者的TAVR治疗方面积累了较多经验[23]。总体上,我国TAVR累计完成数量小,具有独立开展TAVR能力的中心少,较国外有一定差距,患者临床特点也与国外患者存在差异。因此,国外相关指南或指导性文件并不能完全适用于我国实际临床情况,有必要制定适合我国国情的指导性文件。
3 TAVR适应证
2017年欧洲瓣膜管理指南所列出的TAVR适应证:不适合外科手术的症状性重度AS患者(Ⅰ,B);或者是外科手术风险较高的患者,定义为美国胸外科协会(Society of Thoracic Surgery,STS)评分或欧洲心外科手术评分第2版(EuroSCORE Ⅱ)≥4%,或其他危险因素,如虚弱、瓷化主动脉、胸部放疗后,特别是适合于经股动脉入径的老年患者(Ⅰ,B)[4]。2017年美国瓣膜管理指南所列出的TAVR适应证:外科手术禁忌或高危、预期生存时间超过12个月的症状性重度AS患者(Ⅰ,A);外科手术风险中危的重度AS患者(Ⅱa,B-R)[5]。虽然美国和欧洲相关政府部门已批准Sapien 3及Evolut R人工瓣膜应用于外科手术低危患者,但欧美指南尚未对外科手术低危患者的TAVR做出推荐。我国不同地域医疗水平发展不均衡,对于外科手术高危、禁忌的认识存在差异,与国外也有所区别,对手术高危者,相对于国外认识更倾向于保守治疗[8]。结合国情及国内外研究进展,建议TAVR适应证和禁忌证如下:
3. 1 绝对适应证
(1)重度AS:超声心动图示跨主动脉瓣血流速度≥4.0 m/s,或跨主动脉瓣平均压力差≥40 mmHg(1 mmHg=0.133 kPa),或主动脉瓣口面积<1.0 cm2,或有效主动脉瓣口面积指数<0.5 cm2/m2;低流速、低压差者经多巴酚丁胺负荷试验、多普勒超声评价或者其他影像学手段评估判断为重度AS者。(2)患者有症状:如气促、胸痛、晕厥,纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅱ级以上,且该症状明确为AS所致。(3)解剖学上适合TAVR:包括瓣膜钙化程度、主动脉瓣环内径、主动脉窦内径及高度、冠状动脉开口高度、入径血管内径等。(4)纠治AS后的预期寿命超过12个月。(5)TAV。(6)外科手术极高危(无年龄要求),或中、高危且年龄≥70岁。外科手术风险评估参考2014 年美国瓣膜管理指南[3]。
同时符合以上所有条件者为TAVR的绝对适应证。外科术后人工生物瓣退化也作为TAVR的绝对适应证[24]。
3. 2 相对适应证
(1)满足上述的3.1绝对适应证1~5,外科手术低危(STS评分<4%)且年龄≥70岁。(2)满足上述的3.1绝对适应证1、2、3、4、6的BAV,或者满足上述的3.1绝对适应证1、2、3、4的BAV,同时外科手术低危且年龄≥70岁,可在有经验中心或者有经验团队(年TAVR手术量20例以上)协助下进行TAVR。(3)满足上述的3.1绝对适应证1、2、3、4且年龄60~70岁的患者(BAV或TAV),由心脏团队根据外科手术风险及患者意愿判断为适合行TAVR。
J-Valve瓣膜对单纯性AR行经心尖入径的TAVR 有效。本共识主要是针对经血管入径的TAVR,故这部分内容不做阐述。目前国内外也有部分中心使用自膨式瓣膜对单纯性AR尝试TAVR治疗[25], 但仍然缺乏足够临床证据。
3. 3 禁忌证
TAVR的禁忌证包括:左心室内血栓、左心室流出道梗阻、入径或者主动脉根部解剖形态上不适合TAVR(如冠状动脉堵塞风险高)、纠治AS后的预期寿命小于12个月。
4 术前筛选
TAVR术前筛选包括临床因素评估及影像学评估。
临床因素评估包括:(1)是否需要置换瓣膜,包括TAVR预期获益程度;(2)外科手术风险;(3)有无TAVR禁忌证。
影像学评估是TAVR术前评估的重点,包括自体主动脉瓣膜、主动脉瓣环、主动脉、冠状动脉及外周动脉解剖情况,判断是否适合TAVR及置入瓣膜的型号。(1)经胸超声心动图(transthoracic echocardiography,TTE)或经食管超声心动图(transesophageal echocardiography,TEE)。可评估心脏形态及功能、瓣膜功能及解剖、主动脉根部的解剖。对于不能耐受CT检查患者,超声心动图检查可作为术前主动脉根部解剖评估主要手段。大部分患者主动脉瓣环的形态为椭圆形,使用常规二维超声心动图从单一切面测量瓣环不够准确,三维超声心动图可弥补该缺陷。(2)多排计算机断层扫描(multislices computed tomography, MSCT)。MSCT是目前TAVR影像学评估最主要的手段之一,是判断患者是否适合TAVR及选择人工瓣膜型号的主要依据。通过三维重建,可以多切面观察瓣膜形态,评估瓣膜厚度、钙化程度及其在主动脉根部所占体积,在瓣环平面测量瓣环的周长和面积,继而计算瓣环内径,为瓣膜型号、类型选择提供依据,并可评估术后瓣周漏的风险;MSCT还可以用来评估冠状动脉开口的高度,预估冠状动脉阻塞的风险,评估冠状动脉病变。MSCT也可用来对血管入径进行评估。(3)血管造影。主动脉根部造影测量主动脉瓣环、主动脉内径以及冠状动脉高度等方面均不够准确,目前在术前很少应用。术中腹主动脉及分支造影可用来评估血管入径的情况。冠状动脉造影可用来准确评估是否合并冠心病及冠状动脉狭窄程度。
5 操作规范及术后抗栓治疗
5. 1 硬件设施及人员配备
建议TAVR在改装后的心导管室或杂交手术室进行,并建立多学科心脏团队。具体要求见《经导管主动脉瓣置换术团队建设及运行规范中国专家建议》[26]。
5. 2 操作要点
初步开展TAVR的中心,建议TAVR在全麻下,TEE及数字减影血管造影(digital subtraction angiography,DSA)引导下完成。在TAVR经验丰富的中心,对预估手术难度和风险适中的患者,也可选择于局部麻醉联合镇静下、无TEE引导实施极简式TAVR[27-28]。由于目前国内绝大多数患者使用自膨胀的瓣膜,下文主要阐述经股动脉入径置入自膨式瓣膜的操作要点如下。
(1)血管入径的建立:在瓣膜入径血管的对侧穿刺股动脉,置入动脉鞘,放置猪尾导管至主动脉根部,供测压与造影。经静脉入径放置临时起搏器导管于右心室心尖部。从对侧股动脉(辅路)置入造影导管至腹主动脉或主路分支对入径股动脉(主路)进行血管造影,在DSA引导下穿刺入径股动脉,穿刺针进入点应在股动脉前壁的中间且股动脉分支以上。血管穿刺成功后,可预先放置动脉缝合装置,随后置入动脉鞘管。入径动脉也可以采用切开分离、再行穿刺的方法。入径血管需放置引导鞘管(16~22 F),在超硬导丝的支撑、引导下缓慢将引导鞘管推进至腹主动脉水平以上。若双侧股动脉均无法作为入径,可选择其他入径,如颈总动脉、心尖部等,通常需外科医师配合建立通路。
(2)导丝进入左心室:跨瓣导丝一般选用直头导丝或直头亲水涂层导丝,指引导管一般为6 F Amplatzer L左冠状动脉造影导管。跨瓣导丝及指引导管进入左心室后,将指引导管交换为猪尾导管,退出导丝进行左心室内压力测定,再由猪尾导管导入塑型后的超硬导丝至左心室内。超硬导丝头端应塑型成圆圈状,增加与左心室的接触面积,以支撑扩张球囊及瓣膜输送系统。
(3)球囊扩张:球囊扩张应在右心室快速起搏下进行,起搏的频率应以动脉收缩压<60 mmHg、脉压差低于20 mmHg为宜,一般为180~220次/分。当起搏后血压达到目标血压时,快速充分地扩张球囊,快速抽瘪球囊,随后停止起搏。球囊充盈、排空应快速,总起搏时间应小于15 s,以免长时间低灌注造成严重的并发症。球囊预扩张有利于输送系统通过瓣口、稳定血流动力学,还可协助选择人工瓣膜型号[29]、预测瓣膜堵塞冠状动脉的风险。各中心对球囊直径选择经验有所不同,但所选用球囊直径不宜超过自体瓣环直径。
(4)释放瓣膜:瓣膜释放前,应将由辅路送入的猪尾导管放置在无冠窦的最低点作为参考。调整DSA投照角度,使得3个窦底在同一平面,术前MSCT可为此提供角度。瓣膜释放后最佳深度为0~6 mm。由于多数情况下瓣膜释放过程中瓣膜会向下移位,故起始释放深度要略高于此深度,并在释放过程中根据瓣膜移位情况随时调整瓣膜的深度。瓣膜释放过程中可根据猪尾导管、瓣膜钙化影等标记或反复多次造影确认瓣膜深度,瓣膜深度的调整可通过推拉输送系统或者超硬导丝来完成。瓣膜释放过程应缓慢,瓣膜支架从竖直状态逐渐展开到锚定状态时瓣膜容易发生移位,此过程中可辅以快速起搏(一般频率120~150次/分,起搏时间10~20 s),降低瓣膜移位的可能。若使用二代可回收人工瓣膜,对瓣膜位置或瓣膜选择不满意,可回收瓣膜再进行重复操作。瓣膜完全释放后,进行影像学、心电、血流动力学评估(主要包括瓣膜深度、瓣膜形态、跨瓣压差、瓣周漏、冠状动脉阻塞、心脏传导阻滞等)。对于瓣膜膨胀不全或者瓣周漏严重者,可采取球囊后扩张。
(5)入径处理:在手术结束前应常规地从辅路股动脉行血管造影,以排除入径血管并发症。入径血管的止血可采用外科缝合、ProStar或ProGlide缝合等方法。
球扩式瓣膜(Edward Sapien系列瓣膜)的TAVR操作要点除了瓣膜释放过程不同外,其余操作与自膨式瓣膜的TAVR大致相似。自膨式瓣膜由于支架短,所以对瓣膜支架定位精确度要求高。精确的瓣膜定位需要在猪尾导管造影或者TEE引导下完成。瓣膜释放时,猪尾导管放在右冠状窦,右冠状窦在DSA下投影处于另外两个窦之间的中央位置。瓣膜定位到理想位置后,在保证起搏器完全夺获的快速起搏心律下,使得收缩压降到50 mmHg、脉压差小于10 mmHg以下,迅速扩张、抽瘪球囊释放瓣膜。
5. 3 术后抗栓治疗
总体上,应权衡患者血栓风险和出血风险制定个体化方案。一般情况下,以双联抗血小板治疗3~6个月后,终身单药抗血小板治疗(通常为阿司匹林100 mg、每日1次联合氯吡格雷75 mg、 每日1次治疗3~6个月,之后阿司匹林100 mg、每日1次);对于发现有瓣膜血栓者,以及部分合并其他抗凝适应证的患者,予单纯抗凝治疗[4-5]。
6 并发症防治
为了统一各并发症的定义、方便各研究之间的对比,瓣膜学术研究联盟(Valve Academic Research Consortium,VARC)发表了TAVR临床研究终点标准定义,并进行了更新(VARC-2)[30],严重并发症及其防治如下:
6. 1 心脏传导阻滞
为目前TAVR最常见的并发症,主要包括新发的左束支传导阻滞(left bundle branch block,LBBB)和导致永久起搏器植入(permanent pacemaker implantation,PPM)的房室传导阻滞。TAVR其他并发症的发生率随着器械改进而进一步下降,但传导阻滞发生率并未随着器械的更新明显下降[17]。在第一代瓣膜中,新发LBBB发生率约为25%,自膨式瓣膜(18%~65%)高于球扩式瓣膜(4%~30%)[31]。TAVR导致PPM发生率为13%,自膨式瓣膜(25%~28%)发生率约为球扩式瓣膜的5倍(5%~7%)[32]。导致PPM的房室传导阻滞大多数发生于TAVR术中,但仍有30%患者发生在48 h后,有些患者甚至发生在术后1个月至6个月内[33]。PPM的危险因素包括术前存在右束支传导阻滞(right bundle branch block,RBBB)、一度房室传导阻滞、置入自膨式瓣膜、置入过深、选择直径过大的瓣膜、过大的球囊、室间隔膜部长度、无冠瓣钙化容积等解剖因素[34]。避免将瓣膜支架放得太深(>6 mm)、避免选择直径过大的瓣膜、对已存在RBBB的患者选用球扩式瓣膜、选择内径较小的扩张球囊等措施,可减少这一并发症的发生。对于术后心电图无变化且术前无RBBB患者,术后即刻可拔除临时起搏电极,术后持续心电监护24 h;对于术前存在RBBB或者术后有心电图改变的患者,需要留置临时起搏电极24 h,并进一步评估;对于术中或术后出现高度或者完全性房室传导阻滞且在术后48 h内未恢复的患者,应植入永久性起搏器[34]。
6. 2 瓣周漏
在第一代瓣膜中,瓣周漏是常见并发症。中度以上瓣周漏,自膨式瓣膜(CoreValve)可达16.0%,球扩式瓣膜Sapient为9.1%[35]。随着采用防瓣周漏技术的新一代瓣膜使用,该并发症发生率越来越低。大多数的患者瓣周漏为轻微至轻度,且自膨式瓣膜可随着时间延长可能减轻。研究显示,中度以上瓣周漏和患者远期死亡率相关。瓣膜选择过小、钙化过于严重或巨大钙化团块、瓣膜置入过浅或过深是瓣周漏发生的危险因素[35]。瓣膜置入后应对瓣周漏及其程度进行评估,使用包括主动脉根部造影、血流动力学测定(可使用主动脉反流指数)、多普勒超声等手段[36],对瓣周漏的程度、发生部位、血流动力学的影响进行综合评估;对于中度以上瓣周漏,应该尽量积极干预。可使用球囊后扩张(瓣膜膨胀不全或贴合欠佳时)、再次置入瓣膜支架(瓣膜位置过高或过低时)、封堵器封堵瓣周漏等技术。严重患者需外科干预。避免选择瓣膜过度钙化患者、选择合适型号的瓣膜、瓣膜深度的准确定位,可以降低瓣周漏的发生。
6. 3 冠状动脉阻塞
冠状动脉阻塞是TAVR少见(0.66%)却是致命性的并发症[37],也是术前影像学筛选重点以及患者被排除行TAVR主要原因之一。TAVR冠状动脉阻塞的主要机制是自体瓣膜上翻堵住冠状动脉开口。此外,瓣膜支架放置过高,裙边挡住冠状动脉开口,也可致冠状动脉阻塞。术前CT评估应从瓣叶情况、主动脉窦解剖及拟置入的瓣膜特性三个方面综合考虑(表1)。对于解剖结构不合适的患者应避免行TAVR。术中选择合适的球囊,在进行球囊扩张的同时进行主动脉根部造影,观察冠状动脉的显影情况,有助于进一步评估冠状动脉堵塞的风险。冠状动脉阻塞高风险患者防治策略:(1)允许的情况下选小一号瓣膜、置入适度深一些,可降低冠状动脉堵塞的风险,但瓣周漏的发生可能会增多;(2)可行冠状动脉保护策略,包括在冠状动脉预置导丝、球囊或支架;(3)若发生冠状动脉急性或延迟性闭塞,可行急诊冠状动脉介入或外科开胸手术行冠状动脉旁路移植术进行补救。
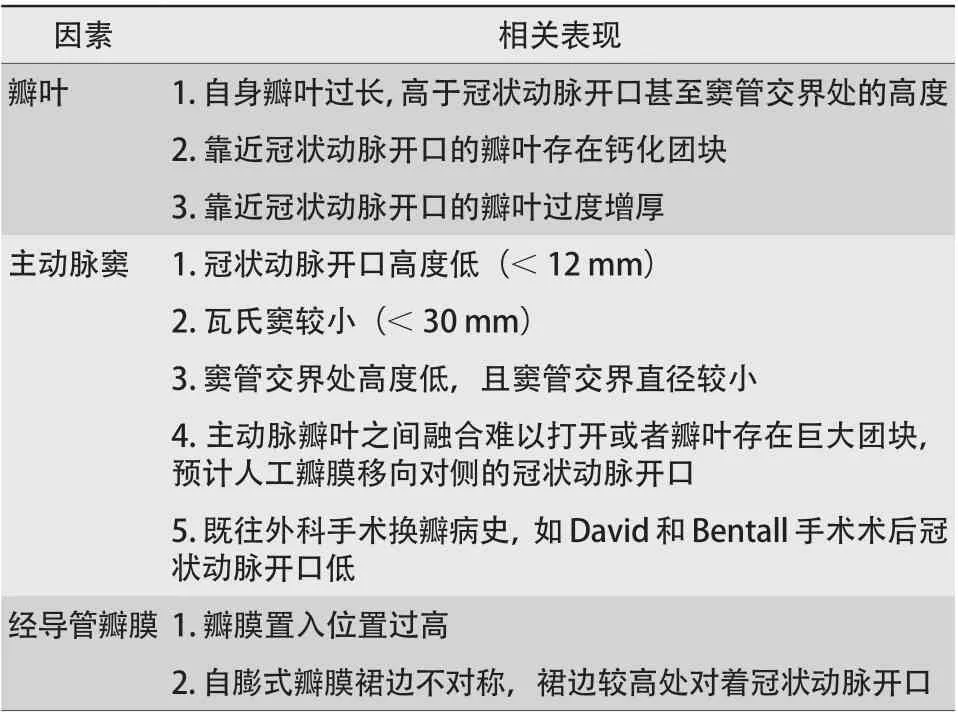
表1 冠状动脉阻塞风险相关因素
6. 4 卒中
TAVR相关的卒中可能与导管操作过程中致主动脉瓣上钙化物质脱落相关。临床有症状的卒中发生率为2%~3%,头颅磁共振成像显示,TAVR术后缺血性脑损伤常见(80%~90%)[38]。TAVR相关的卒中危险因素除了患者本身特性外,还包括球囊预扩张、输送系统在体内时间、快速起搏、瓣膜回收重置等手术因素[39]。术中应避免反复操作,减少操作次数,可能会减少卒中的发生。高危患者可考虑使用脑保护装置。临床研究显示,脑保护装置可以减少磁共振监测的脑损伤,但是否可以减少临床事件有待进一步研究[40]。若发生卒中,应请神经专科医师协同处理。
6. 5 其他并发症
(1)局部血管并发症:主要是入径血管,股动脉、髂动脉、腹主动脉出现夹层、闭塞、破裂出血等,既往发生率可达16.7%[41]。随着18 F及以下输送系统的应用,该并发症发生率降低至4.2%[42]。老年患者、特别是合并症多如高血压病、慢性肾功能不全、糖尿病、遗传性高胆固醇血症的患者,易发生血管狭窄、粥样斑块、钙化、过度扭曲等,可致血管并发症。术前应使用MSCT全面仔细评估血管入径,选择血管条件较好的入径,避免选择内径过小、过于扭曲的入径血管,避免粗暴操作。一旦出现血管并发症,可采用外周血管球囊、外周覆膜支架,必要时进行血管外科手术处理。
(2)心脏压塞:发生率为1%~2%[43]。为了减少该并发症的发生,应将加硬导丝头端塑型成圆圈状,在球囊扩张、进输送鞘管时应固定好加硬导丝。直头导丝进左心室时,应避免用力过猛,引起主动脉窦部或者左心室穿孔。
(3)主动脉夹层、撕裂:是TAVR的致命并发症。准确地测量主动脉瓣瓣环的大小、勿使用过大的扩张球囊可减少这一并发症的发生。
7 特殊病例处理
7. 1 BAV
BAV有多种分型方法,使用较多的是2007年的SIEVERS分型方法,分为0、Ⅰ、Ⅱ型,先天性二叶式畸形多为0型,1个瓣叶交界融合为Ⅰ型,2个瓣叶交界融合为Ⅱ型。目前欧美尚未将BAV钙化性狭窄列入TAVR适应证。但越来越多证据显示,BAV患者行TAVR效果不劣于TAV[19-22,44]。与TAV相比较,BAV行TAVR不利因素包括:(1)瓣环呈椭圆形,导致置入瓣膜不容易完全膨胀,可能影响长期耐久性;(2)自体瓣膜不容易完全扩开,呈现梯形瓣叶形态,出现置入瓣膜受自体瓣膜挤压而向心室下移,从而导致置入过深,瓣中瓣置入发生率较高;(3)瓣膜钙化程度不高,不对称,瓣叶不等大,容易发生残余瓣周漏;(4)升主动脉扩张远期可能有夹层风险。根据目前国内的经验,针对BAV,瓣膜选择更多依赖瓣上结构,瓣膜的周长、直径、面积仅供参考,根据瓣环周长选择合适的扩张球囊,术中进行扩张,根据球囊扩张的直径选择合适的瓣膜;自膨式瓣膜释放时起始位置一般要高些(深度为0~2 mm)。
7. 2 外科生物瓣衰败
外科手术主动脉瓣换瓣发生衰败时,二次外科手术换瓣手术风险较高, TAVR的瓣中瓣技术为此类患者提供了一种选择。操作技巧和手术要点:(1)术前明确外科生物瓣的类型、尺寸,与MSCT结果互相印证,选择合适瓣膜;(2)了解病变瓣膜的X线影像特性,为瓣膜置入深度的参照(注意有些瓣膜X线显示的环并非瓣膜支架的最低点);(3)了解瓣膜病变类型(如狭窄、反流或合并存在),以反流为主的病变可不做球囊预扩张,以降低卒中的概率;(4)有些患者外科生物瓣膜瓣环内径较小(如19 mm),主动脉瓣口压差可能是由于左心室流出道狭窄或者人工瓣膜患者不匹配导致而非瓣膜狭窄,应该观察生物瓣膜病变及开放情况,仔细鉴别。当MSCT测得瓣环内径小于17 mm时,应该谨慎。
7. 3 无钙化或轻度钙化
目前研究显示,对于瓣膜无钙化、轻度钙化的AS,使用自膨式瓣膜行TAVR是安全有效的[45-46]。非钙化性AS病因多为风湿性的。由于无钙化或轻度钙化,瓣膜释放后易移位,故瓣膜型号选择一般倾向于较大。较少使用球囊预扩张或后扩张。瓣中瓣置入概率较高。
7. 4 血管入径不良
目前,国内上市的经股动脉瓣膜输送系统为18 F或以上,一般要求股动脉最狭窄直径在6.0 mm以上。 当股动脉血管入径不佳时,如存在较严重狭窄或者钙化(非圆周形)的,可考虑采用无鞘技术,把血管直径要求降低到4.5 mm。若无鞘技术不可行或仍存在较大风险,可根据患者的实际情况选择颈动脉、锁骨下动脉、升主动脉、心尖等其他入径。
7. 5 水平型主动脉
水平型主动脉与瓣环平面角度大,瓣膜通过困难,同时输送系统与主动脉不同轴,瓣膜支架下缘释放后在X线下与瓣环平面不平行,使得瓣膜释放时定位困难,瓣膜完全释放后容易放置过深,导致瓣周漏、传导阻滞、二尖瓣功能受影响的概率大大增加。操作技巧和注意事项如下:(1)输送系统跨瓣困难时,可用抓捕器(snare)辅助,尤其是在因为瓣周漏严重需要置入第二个瓣膜时;(2)选择有可回收功能的二代人工瓣膜系统,可允许瓣膜位置不理想时重新调整位置;(3)新一代可调弯输送系统可有助于解决这问题。
7. 6 冠状动脉开口位置低
术前术中应该仔细评估,并可采取一些防治措施,详见本文6.3节冠状动脉阻塞。
7. 7 瓣膜极度钙化的AS
这类患者瓣膜极度钙化、钙化团块巨大,容易导致输送系统难以跨瓣、瓣膜支架无法充分展开、严重瓣周漏、需要球囊后扩张等不利情况。应该适当充分地预扩张,根据球囊扩张结果选择小型号瓣膜,自膨式瓣膜释放时起始位置要高些。
7. 8 肾功能不全
TAVR术中由于使用对比剂以及低灌注,可导致急性肾损伤,继而影响患者预后[47]。然而,最近研究显示由于TAVR改善患者的肾灌注,更多患者表现为肾功能改善[48-49]。因此,肾功能不全(包括尿毒症)不是TAVR患者手术禁忌证。术中应该尽量少用对比剂,避免长时间低灌注,必要时术后予血液透析。
7. 9 合并冠心病
接受TAVR的患者中15%~80%合并有冠心病,STS评分越高者发生率越高[50]。虽然观察性研究尚未证实经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)对合并冠心病患者的益处,目前指南及临床实践仍建议对近端冠状动脉狭窄大于70%的患者在TAVR前进行PCI[51]。多项研究显示在TAVR术前分期的PCI或者与TAVR同期的PCI均是可行的且结果相似[50]。但对于左心室射血分数低于30%或者STS评分大于10%者,PCI风险明显增加,建议选择同期PCI,术中先予主动脉瓣球囊扩张改善血流动力学再予PCI[52]。
7. 10 紧急TAVR
某些患者来诊时病情就已危重,出现严重心力衰竭或血流动力学不稳,无法择期TAVR,需紧急(24 h内)行TAVR。这些患者往往无法耐受MSCT检查,故术前评估主要依赖于超声心动图,尤其是三维超声心动图。术中以血管造影评估入径情况,以球囊扩张评估瓣环大小及冠状动脉堵塞的风险。有些患者左心室射血分数特别低(<25%),或者血流动力学不稳,可术前或术中使用体外膜肺氧合等循环辅助支持[53]。特别危重患者在导管室无配备人工瓣膜的情况下,亦可先行单纯主动脉瓣扩张术,待病情相对稳定再行MSCT检查评估,后择期行TAVR。
综上,相对于《经导管主动脉瓣置换术中国专家共识(2015版)》,《经导管主动脉瓣置换术中国专家共识(2020更新版)》主要更新内容为:(1)更新了流行病学认识,指出我国主动脉瓣病变患者风湿性病因比例较高,在BAV患者各解剖亚型的构成比中,我国患者0型(无嵴型)占比较西方国家高。(2)更新了适应证,根据最新临床试验结果,将高龄(≥70岁)、外科手术低危险纳入相对适应证;外科手术极高危行TAVR无具体年龄要求;中危、年龄≥70岁患者也为TAVR适应证;60~70岁的患者,由心脏团队根据外科手术风险及患者意愿判断为适合行TAVR。(3)对瓣膜置入操作步骤进行更新,强调了球囊预扩张可用于协助选择人工瓣膜型号、预测瓣膜堵塞冠状动脉的风险,指出瓣膜释放过程可辅以快速起搏降低瓣膜移位的可能性。(4)增加了术后抗栓方案,一般情况下,以双联抗血小板治疗3~6个月后,终身单药抗血小板治疗;对于发现有瓣膜血栓者,以及部分合并其他抗凝指征的患者,予单纯抗凝治疗。(5)对心脏传导阻滞、冠状动脉堵塞及瓣周漏等三个重要的并发症的防治进行更详尽的阐述及更新。(6)在特别病例处理中,增加了肾功能不全、合并冠心病以及急诊TAVR等三种临床常见情况的处理。
执笔:周达新(复旦大学附属中山医院),潘文志(复旦大学附属中山医院),吴永健(中国医学科学院阜外医院), 宋光远(中国医学科学院阜外医院)
核心专家组成员(按姓氏汉语拼音排序):陈良龙(福建医科大学附属协和医院),陈茂(四川大学华西医院),霍勇(北京大学第一医院),孔祥清(江苏省人民医院),刘先宝(浙江大学医学院附属第二医院),罗建方(广东省人民医院),宋治远(陆军军医大学第一附属医院),苏 (武汉亚洲心脏病医院),陶凌(空军军医大学西京医院),王建安(浙江大学医学院附属第二医院),王焱(厦门大学附属心血管病医院),杨剑(空军军医大学第一附属医院),张海波(首都医科大学附属北京安贞医院),赵仙先(海军军医大学第一附属医院),周玉杰(首都医科大学附属北京安贞医院)
专家组成员(按姓氏汉语拼音排序):安健(山西省心血管病医院),白明(兰州大学第一医院),陈维(上海市第十人民医院),陈韵岱(解放军总医院第一医学中心),方军(福建医科大学附属协和医院),方臻飞(中南大学湘雅二医院),冯沅(四川大学华西医院),郭然(大连医科大学附属第一医院),郭延松(福建省立医院),何奔(上海市胸科医院),胡海波(中国医学科学院阜外医院),江磊(青岛大学附属医院),姜正明(郑州大学第一附属医院),晋军(陆军军医大学第二附属医院),李飞(空军军医大学第一附属医院),李捷(广东省人民医院),李元十(哈尔滨医科大学附属第一医院),李智博(吉林大学第二医院),刘长福(解放军总医院第一医学中心),刘巍(首都医科大学附属北京安贞医院),刘煜昊(阜外华中心血管病医院),卢成志(天津市第一中心医院),陆方林(海军军医大学第一附属医院),马根山 (东南大学附属中大医院),马为(北京大学第一医院),宁忠平(上海健康医学院附属周浦医院),潘湘斌(中国 医学科学院阜外医院),尚小珂(华中科技大学同济医学 院附属协和医院),盛国太(江西省人民医院),王斌(北部战区总医院),王斌(厦门大学附属心血管病医院),王玉林(山东省立医院),王震(河北医科大学第一医院),徐凯(北部战区总医院),杨毅宁(新疆医科大学第一附属医院),于波(哈尔滨医科大学附属第二医院),袁义强(河南省胸科医院),张曹进(广东省人民医院),张戈军(中国医学科学院阜外医院),张浩(江苏省人民医院),张龙岩(武汉亚洲心脏病医院),张瑞岩(上海交 通大学医学院附属瑞金医院),张玉顺(西安交通大学第 一附属医院),张志辉(陆军军医大学第一附属医院),朱政斌(上海交通大学医学院附属瑞金医院)

