老年人骨盆脆性骨折的诊治进展
李珂璇,梁永辉
(航天中心医院骨科,北京 100049)
随着老龄化时代的演进,老年人骨盆脆性骨折(fragility fractures of the pelvis,FFP)的重要性不断攀升。与年轻人常因高暴力导致骨盆骨折的致伤机制不同,老年人骨盆骨折常由低能量损伤所致,如站立姿势的跌倒等。脆性骨折的概念恰与此对应。根据世界卫生组织的定义[1],脆性骨折是指在不足以引起正常骨发生骨折的作用力下导致的骨折,其原因是骨的抗压强度和抗扭强度的下降。老年人FFP的发病率近年来出现了显著的上升。芬兰一项流行病学调查发现,≥60岁老年人骨盆骨折中脆性骨折占比由1970年的65%提升至了1997年的94%[2]。
虽然脆性骨折的发病机制常为低能量损伤,但由于老年人的基础疾病和卧床可能带来的并发症,其死亡风险不容小觑。Chong等[3]发现年龄是预测骨盆骨折死亡风险的独立因素,<60岁的骨盆骨折患者总死亡率为8%,而≥60岁患者的死亡率为37%。
鉴于此,本文将对近年来国内外老年FFP的危险因素、评估、诊断与治疗的研究进展进行综述。
1 危险因素及评估
老年人骨盆骨折的危险因素主要包括以下几个方面。(1)低骨密度。<45岁时的骨折次数、母亲髋部骨折、吸烟、子宫切除术会增加骨盆骨折的风险,而近期的绝经期激素治疗、高体质量指数则为保护因素。(2)日常生活能力。使用助行器、日常起居需要他人帮助,均可显著增加骨盆骨折的风险。(3)跌倒相关因素。癫痫会使骨盆骨折的风险显著增高,而帕金森病、脑卒中史、佩戴眼镜、佩戴助听器虽然会增加风险,但差异不具有统计学意义[4]。(4)共病。除骨质疏松外,高血压、糖尿病等也会显著提高骨折风险[5]。危险因素分析对于采取一级预防措施具有提示意义。
FFP的相关研究与髋部骨折相比明显不足,虽然可普遍应用于骨科术后结局预测的量表亦可用于评估,但类似于诺丁汉髋关节骨折术前评分标准等可针对性预测FFP预后结局的量表仍然缺乏[6]。这可以成为后期研究方向。
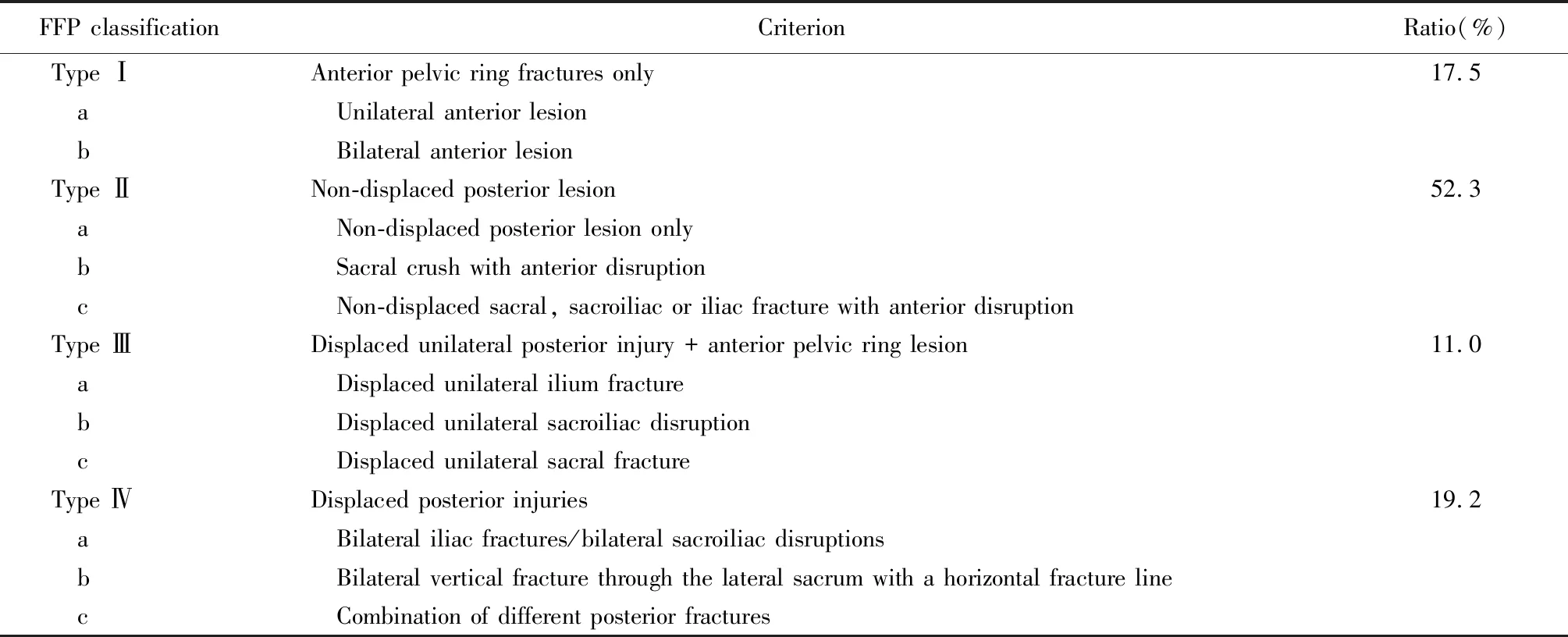
表1 Rommens FFP 分型[14]
2 影像学检查
由于老年人FFP的致病机制特点,以腹股沟区、下背部、腰骶部疼痛为主诉的老年人,不论是否跌倒,都应进行影像学评估。传统的骨盆X线包括骨盆前后位、入口位、出口位和Judet斜位片(闭孔斜位和髂骨斜位),多用于首诊初步评估。然而,由于肠气和膀胱对于骨盆后环区域的干扰及脆性骨折低暴力特性导致的移位不明显,X线常仅能提示耻骨支骨折,而对于骨盆后环骨折的提示意义有限[7]。以计算机断层扫描(computed tomography,CT)三维重建为标准,汪金平等[8]发现X线片对骶骨或髂骨骨折的漏诊率达到了42.3%。因此,首诊X线评估的意义值得商榷。
目前,CT和核磁共振成像(magnetic resonance imaging,MRI)应用价值较高。CT对于骨盆前环和后环骨折均有较好的灵敏度,分别达到了100%和68%。MRI是诊断老年人FFP的金标准,骨折部位在T1相显示为低信号,在T2相显示为高信号,短时间反转恢复(short TI inversion recovery,STIR)序列对于骨髓水肿的灵敏度最佳[9]。MRI对骨挫伤的灵敏度远高于CT。而骨挫伤实际意味着松质骨的微骨折,如不进行治疗,2~3周后CT即可显示皮质骨的骨折[10]。
一些新的影像学技术也在逐渐崭露头角。Palm等[10]的研究显示,双能量CT(dual-energy CT,DECT)同样可以显示骨髓水肿,其应用价值可比肩MRI,在FFP诊断中敏感度和特异度均为100%,且与MRI相比,用时更短;其放射线水平和扫描时间与传统CT类似。DECT结合了CT和MRI 2种影像学检查的优势,其缺陷是难以区分水肿的骨髓和造血的骨髓,年轻人可表现为假阳性,但对于骨质疏松和脂肪化的老年人来说却十分适用。
3 分型
Tile分型和Young-Burgess分型是目前骨盆骨折的常用分型方法,两者均对高能量骨折的治疗和预后判断有较好的指导意义[11]。然而,老年人FFP的特点与因高能量创伤导致的骨盆骨折有显著差异。由于老年人常由站立位向侧方跌倒,若使用Young-Burgess分型,老年人中侧方挤压型(lateral compression,LC)骨折是前后挤压型(anterior-posterior compression,APC)骨折发生率的5倍,而全年龄段的LC型骨折约占38.2%,APC型约占52.4%[12]。Tile分型虽然可以满足对于稳定性的判断,但未能基于老年人骨折的特点(如骶骨翼易发生H型骨折)进行进一步的亚组划分。另外,由于老年人与青年人相比更不耐受保守卧床治疗,使用Tile分型指导手术常常导致更多的老年人被划入保守治疗的范围,对预后可能有不利影响。因此,为了进一步细分FFP的亚型,基于其致病机制和影像学特点,以骨折的部位和稳定性为分类依据,Rommens提出了FFP[13]分型(表1)。
4 治疗
FFP分型的最重要意义之一即提示治疗手段。FFP Ⅰ型和Ⅱ型的骨折被推荐行保守治疗,Ⅲ型与Ⅳ型则推荐手术治疗。
4.1 保守治疗
Rommens等[13]推荐的保守治疗包括24 h血流动力学监测、镇痛、在可耐受的条件下进行早期功能锻炼、骨质疏松的评估和治疗、查明跌倒原因等。其中,骨质疏松的治疗是预防后期脆性骨折发生的重要环节。除了膳食维生素D和钙的摄入,抗骨吸收和促骨形成类药物也应当考虑。二磷酸盐类药物如阿仑膦酸钠、利塞膦酸钠对于预防脆性骨折的作用已经过循证医学研究的验证,但其对于术后骨愈合的促进作用仍有争议。地诺单抗可以抑制破骨细胞的活动,临床试验证实其应用可以将髋关节骨折的发病率降低40%。雷尼酸锶除了可以预防脆性骨折,还对骨折愈合有促进作用[15]。重组人甲状旁腺激素也有类似的效果。Peichl等[16]的队列研究发现,通过重组人甲状旁腺激素(1-84)注射,平均骨折愈合时间由12.6周缩短至7.8周。
值得注意的是,Rommens等虽然建议了不同分型的治疗策略,但是没有给出保守治疗失败的时间范围和备选方案。Ueda等[17]提出,对于2周保守治疗后疼痛仍持续且运动功能无明显改善的患者,可能预示FFP分型进展。如进展至FFP Ⅲ型或Ⅳ型,则需手术治疗。
4.2 手术治疗
FFP Ⅲ型和Ⅳ型骨折因其不稳定性而难以自愈。老年患者长期卧床可能导致并发症发生率增加、死亡风险提高,早期手术、快速康复的重要性不言而喻。
4.2.1 开放手术治疗 自20世纪中期以来,外固定架和切开复位内固定术开始应用于骨盆骨折的治疗[18]。外固定架被广泛应用于高能量的骨盆骨折,但在老年人中由于感染和退钉的并发症常见,并不受推荐。切开复位内固定术以复位精准为优势,对于年轻骨盆骨折患者治疗效果确切,但对手术耐受力差的老年人而言,在保证稳定性的前提下,精准复位不应以提高并发症发生率为代价。Ma等[19]研究发现,经皮内固定的方式与切开复位内固定相比,手术时间短,出血少,术后住院时间短,且复位评级为优秀的比例无显著统计学差异。综上所述,目前对于老年人而言,我们推荐经皮内固定术等微创术式。
4.2.2 微创手术治疗
4.2.2.1 前环骨折的术式选择 若移位不明显,耻骨支和髋臼前唇骨折推荐经皮的逆行经耻骨螺钉内固定[13]。腹侧内支架也是一种可采用的微创术式。股外侧皮神经损伤和异位骨化是其常见的并发症。Vaidya等[20]在91例行腹侧内支架术后的患者中观察到30%的患者发生了股外侧皮神经的一过性损伤,1例患者出现了不可逆的损伤;35%的患者发生异位骨化,彻底冲洗术区对其有预防作用。
4.2.2.2 后环骨折的术式选择 骶椎成形术是一种在影像技术引导下、将骨水泥经皮注射入骨折部位以恢复其稳定性的术式。其可显著提高稳定性、缓解疼痛,但骨水泥渗漏和对后期骶髂螺钉固定的阻碍是其缺陷[13]。虽然骶椎成形术并非FFP最受推崇的术式,但其骨水泥加强的方式启迪了术式优化。骶髂螺钉内固定在FFP治疗中的效果确切,但其最大的缺陷是由于患者骨质疏松,螺钉锚定力不足,退钉风险较高。其处理方法是骨水泥强化[21, 22]。Höch等[23]研究发现,经骨水泥强化的骶髂螺钉内固定未见与骨水泥注射相关的并发症,术后疼痛在1年随访期可见明显好转,患者生活质量和行动能力与同年龄、同性别的普通人群无明显差异。何红英等[11]认为,对于骶骨Ⅱ区骨折合并骶神经损伤的患者,不建议采用螺钉内固定术式,而推荐采用背侧内支架系统固定,可撑开减压,缓解神经损伤。
5 总结与展望
随着经济发展和医疗水平提升,人口老龄化正在成为疾病谱演变不可忽视的影响因素。FFP严重影响老年人的行动能力,可导致卧床及其继发的一系列问题,其危险性不亚于髋部骨折,应当引起重视。我国人口基数大,老年人群数量多,对我国FFP的发病率与死亡率趋势进行流行病学调查对于指导治疗具有重要的价值。此外,对于FFP的预后评估的因素分析及对于不同分型FFP骨折的具体术式选择,目前仍无共识,FFP治疗的精准化仍在路上。

