黄山药总皂苷对晚期糖基化终产物诱导心肌老化的保护作用及机制
徐婉莹,查志敏,冯楚炎,郭妍*
(1南京医科大学第一附属医院老年心血管内科,南京 210029, 2苏北人民医院老年科,江苏 扬州 225001)
晚期糖基化终产物(advanced glycation end products,AGEs)是脂质、核酸、蛋白质等生物大分子的氨基在非酶促条件下,与还原糖经过一系列复杂的反应后重排折叠最终形成的不可逆产物。随着年龄增长,AGEs在体内的积累也越来越多,影响身体重要器官心脑肾的功能[1]。去乙酰化酶家族中,沉默信息调节因子(silent mating type information regu-lation 2 homolog-3,SIRT3)被称为“长寿蛋白”,是存在于线粒体内的一种依赖烟碱胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的组蛋白去乙酰化酶。它参与调节氧化应激、线粒体代谢、线粒体动力学及自噬等方面,参与介导衰老过程,对不同病态下的心肌有保护作用。黄山药总皂苷(total saponins of dioscorea pathaica,TSDP)是薯蓣科植物黄山药根茎中提取物,主要成分为甾体皂苷类,具有治疗心肌缺血、降血脂和抗肿瘤等作用,临床上对于心肌缺血的应用得到了广泛关注,而它对心肌衰老的影响尚无研究。本实验旨在研究TSDP对AGEs引起心肌细胞老化的影响,并探讨涉及的通路。
1 材料与方法
1.1 材料
每次实验需订购出生 1~3 d SD 乳大鼠10只(南京青龙山动物养殖场);共需180只乳大鼠。Ⅱ型胶原酶(Sigma公司,美国);DMEM培养基、胎牛血清(Gibco公司,美国);AGEs(ab51995,abcam,美国); 细胞内活性氧(reactive oxygen species,ROS)检测试剂盒(DCFH-DA)、SA-β-Gal染色试剂盒(上海碧云天公司);p53,p16(Proteintech,中国);SIRT3,超氧化物歧化酶-2 (superoxide dismutase-2,SOD2)(CST,美国)。CCK-8试剂盒(cell counting kit-8,CCK-8)(APExBIO,美国);黄山药总皂苷提取物原粉(成都地奥制药公司提供)。
1.2 方法
1.2.1 原代心肌细胞的分离与培养 无菌条件下取SPF级SD乳大鼠10只,剪开胸壁取出心脏,立即置于预冷的无菌PBS洗3次,剪碎成约1 mm×1 mm×1 mm大小,用0.1%的Ⅱ型胶原酶消化6 min×7次,每次将收集消化后液体滴入预冷的含有血清及完全培养基的终止液中。7次消化完毕后,将收集的溶液于4℃ 、1 000转/min离心10 min,弃上清,用含10%胎牛血清的DMEM培养基重悬后,铺板于10 cm皿中放在37℃温箱中,1.5 h后,收集含有心肌细胞的上清,吹匀后铺板于6孔板中,用10%胎牛血清的DMEM培养基培养48 h。
1.2.2 实验分组与干预 不同浓度(0.0,0.5,1.0,1.5,2.0,4.0,8.0,10.0 μg/ml)的TSDP处理细胞48 h,观察细胞活性,于时间梯度(0、6、12、24、36、48 h)干预细胞,检测细胞活性及蛋白水平。
实验分组:将培养48 h的原代心肌细胞分为以下5组(每组设6个复孔):不干预的对照组,AGEs组(100 ng/ml),TSDP + AGEs组(10 μg/ml TSDP处理细胞2 h后,加入100 ng/ml AGEs),TSDP组(2 μg/ml),TSDP组(10 μg/ml)。每组处理48 h。
1.2.3 CCK-8检测细胞活力 将原代心肌细胞铺于96孔板培养48 h后换液,加入不同浓度TSDP(0.0,0.5,1.0,1.5,2.0,4.0,8.0,10.0 ng/ml)的培养基继续培养48 h。每组设6个复孔。弃培养基,每孔加入含10%WST-8的培养基100 μl,37℃孵箱避光孵育4 h,用酶标仪测450 nm波长处的吸光度(A450 nm),心肌细胞活力=(A450 nm实验组-A450 nm空白组)/(A450 nm对照组-A450 nm空白组)×100%。
1.2.4 测定SA-β-Gal活性 药物干预细胞48 h后,弃细胞培养基,加入1 ml染色固定液每孔,室温下15 min。弃固定液,PBS洗3次,吸除PBS,每孔加入1 ml染色工作液,用保鲜膜包裹后放入无CO2孵箱过夜。光学显微镜观察,计数。
1.2.5 细胞内活性氧测定 将孔板中的培养基吸除,避光加入稀释好的DCFH-DA1 ml(10 μmol/ml)。细胞培养箱中静置20 min,用DMEM洗3次,于荧光显微镜下观察,用Image J 测荧光强度。
1.2.6 Western-blotting检测蛋白水平 用RIPA裂解液(含1 mmol/L PMSF)提取心肌蛋白。用BCA法测蛋白浓度。配制12%的分离胶及6%的浓缩胶,80 V电泳30 min,120 V继续电泳至溴酚蓝达到分离胶底部。100 V 1 h转膜,4℃下牛奶封闭2 h。加入一抗β-actin、SOD、p53、p16、SIRT3(1∶1 000),4℃过夜。次日洗膜后加入二抗,4℃孵育2 h,洗膜,用 ECL 试剂盒化学发光,显示目的蛋白条带。
1.3 统计学处理
2 结 果
2.1 TSDP对心肌细胞活性的影响
48 h内干预对心肌细胞活性影响差异无统计学意义(图1A)。干预48 h,TSDP浓度<10 μg/ml的药物剂量同未加药干预组的细胞活性差别无统计学意义(图1B)。说明<10 μg/ml以内可作为药物的安全剂量范围,最终选取TSDP浓度为2 μg/ml及10 μg/ml的药物干预细胞。
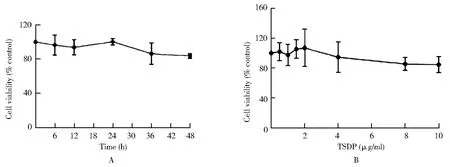
图1 不同浓度及时间TSDP对心肌细胞活性的影响
2.2 TSDP时间梯度对衰老指标的影响
TSDP(10 μg/ml)干预细胞24、36、48 h后,p53水平下降差异有统计学意义(P<0.05,图2B),干预36、48 h时,p16减少显著,差异有统计学意义(P<0.05,图2C)。
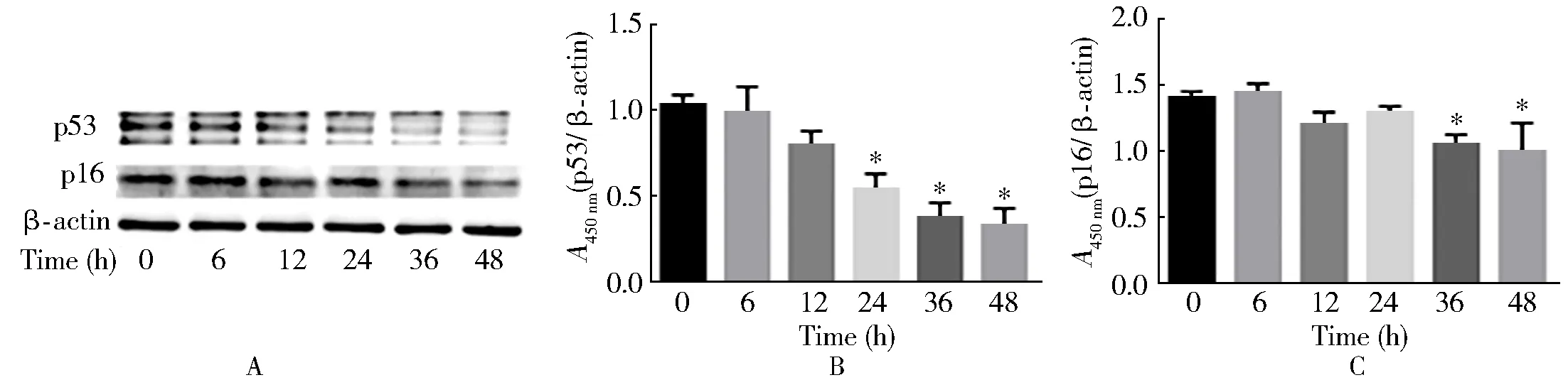
图2 不同时间对衰老指标的影响
2.3 TSDP时间梯度对SOD2和SIRT3蛋白水平的影响
干预6、12、24、36、48 h时, SIRT3蛋白水平较未干预组增加,差异有统计学意义(P<0.05,图3B)。干预12、24、36、48 h时,SOD2蛋白水平较未干预组增加,差异有统计学意义(P<0.05,图3C)。
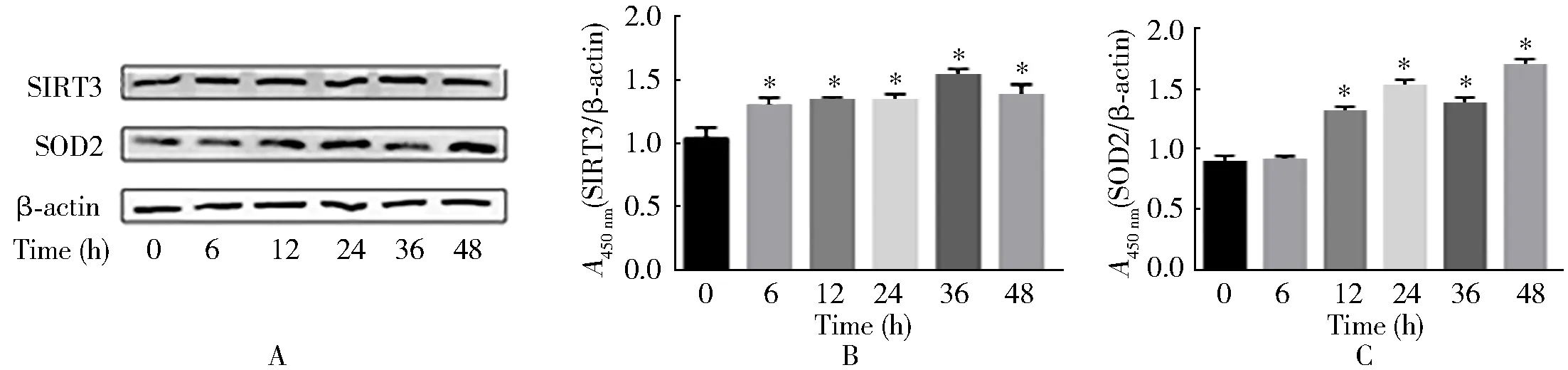
图3 不同时间对SIRT3及SOD2蛋白水平的影响
2.4 TSDP对心肌细胞老化的影响
与空白对照组比较,AGEs组SA-β-Gal活性增加,p53和p16蛋白水平增加。TSDP(10 μg/ml)预先加入AGEs干预的心肌细胞后,AGEs引起的SA-β-Gal增强及p53和p16蛋白水平增加均得到了缓解(P<0.05, 图4)。
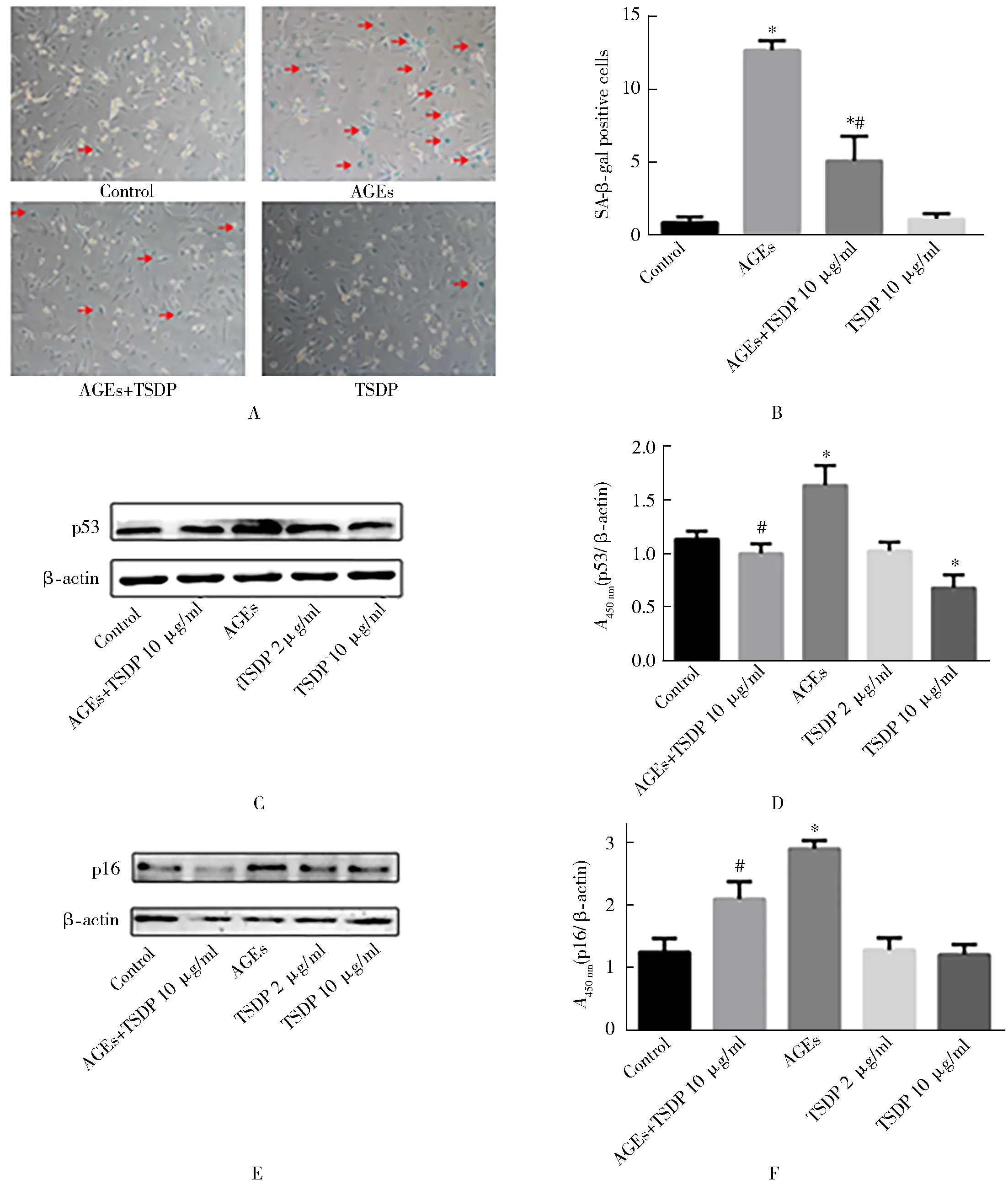
图4 TSDP对AGEs引起的心肌细胞老化的影响
2.5 TSDP对SIRT3蛋白水平的影响
与空白对照组比较,AGEs组SIRT3蛋白水平下降。TSDP(10 μg/ml)干预心肌细胞后,SIRT3增加。TSDP(10 μg/ml)预处理AGEs干预的心肌细胞后, SIRT3蛋白水平较AGEs组升高(图5,P<0.05)。
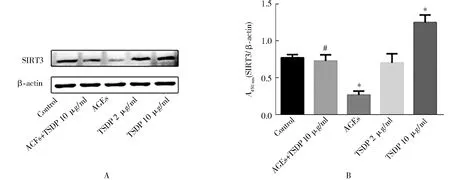
图5 TSDP对 AGEs干预后的心肌细胞SIRT3蛋白水平的影响
2.6 TSDP对 AGEs 引起的 ROS 变化的影响
与对照组相比,AGEs组 ROS增加,SOD蛋白水平下降,差异有统计学意义(P<0.05)。TSDP(10 μg/ml)预先加入AGEs干预的心肌细胞后,AGEs引起的ROS增强及SOD蛋白水平的减少均得到了缓解(P<0.05,图6)。
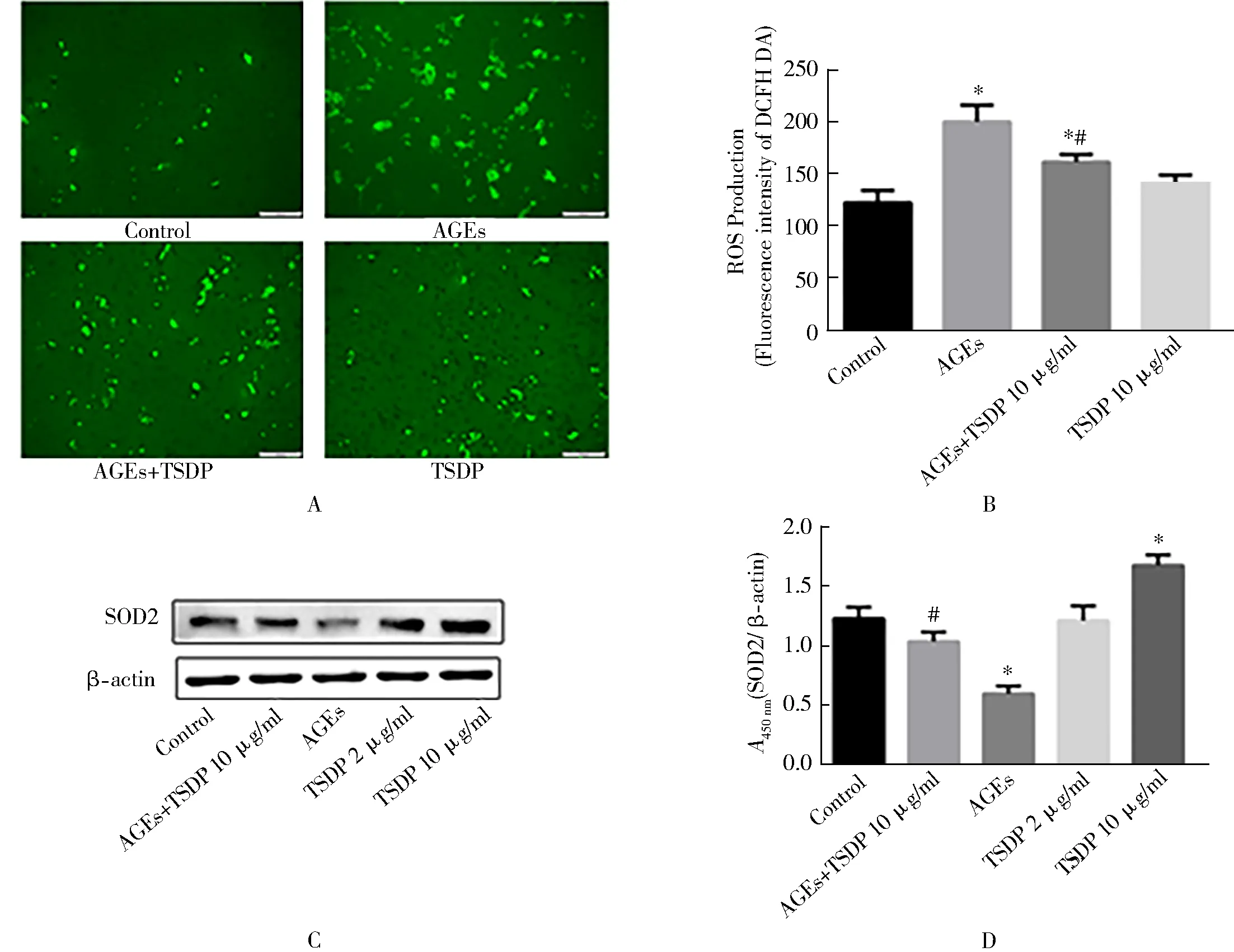
图6 不同处理组心肌细胞中 ROS 和SOD的水平
3 讨 论
研究衰老机制,寻找抗衰老方法一直是人类想攻克的难题。在众多衰老学说中,糖基化致衰老学说引起越来越多研究者的重视。晚期糖基化终产物AGEs是还原糖的羧基与大分子物质如核酸、蛋白质等的氨基结合后经过重排脱水等反应形成的不可逆产物。AGEs的积累激活炎症信号通路,引起活性氧产生,影响心脑肾功能,继而加速衰老[1,2]。体内实验也证明,人体内存在缓慢糖基化过程。随着年龄增长,血浆及各组织中的AGEs水平逐步增高。SA-β-Gal是细胞老化过程中最常用的生物标志物,p53增加与细胞增殖抑制密切相关,p16通过抑制细胞分裂周期关键酶活性使G1细胞周期停滞,两者也被认为是老化的标志。我们的前期研究结果表明,AGEs干预后SA-β-Gal活性明显增强, p16、p53蛋白水平显著升高,活性氧ROS产生明显增加[3]。如何改善AGEs引起的老化引起越来越多研究者们的关注。
黄山药为我国特有的薯蓣科薯蓣属植物,有效成分为甾体总皂苷。以其为主要成分的国家级中药地奥心血康具有明显活血化淤、改善机体微循环、扩张冠状动脉血管、改善心肌缺血、降低血脂的作用[4],在临床上广泛用于心肌缺血性疾病的治疗,它的抗损伤的分子机制主要涉及增加了SOD2的表达、降低氧化应激水平、降低心肌细胞的凋亡率、抑制炎症因子的生成、改善微循环等[5]。因而我们思考TSDP可能对 AGEs通过氧化应激引起的心肌细胞老化有着保护作用。我们的研究结果发现,TSDP减少了AGEs干预后SA-β-Gal的活性增加及p53,p16蛋白水平的增加,由此推测TSDP对AGEs诱导的心肌细胞的衰老起保护作用。
我们的实验探讨了上述过程中可能涉及的机制。去乙酰化酶家族对维护心脏功能稳态、老化、疾病及代谢等多方面有重要的作用。而其中沉默信息调节因子SIRT3在长寿人群中表达量高,又被称为长寿蛋白。它是一种存在于线粒体内NAD依赖的去乙酰化酶,通过参与能量代谢、清除活性氧、参与调节细胞凋亡与生长、细胞内自噬等对不同病态下的心肌细胞具有保护作用。随着年龄的增长,心肌细胞 SIRT3水平逐渐降低。敲除 SIRT3 或表达下降与衰老导致代谢异常的心肌疾病如心脏疾病、糖尿病、高血压等的发生相关[6,7]。已有研究发现,AGEs干预内皮祖细胞后降低了SIRT3表达,而过表达SIRT3保护了AGEs诱导的EPCs功能障碍和增强的抗氧化能力[8]。椎间盘退行性病变时,AGEs在髓核细胞中积累,而过表达SIRT3减轻了髓核细胞的氧化应激和凋亡进而预防AGEs诱导的椎间盘退行性病变[9]。本次试验证实了AGEs干预原代心肌细胞后, SIRT3的表达下降。我们推测心肌细胞中AGEs所致衰老可能与SIRT3的减少有关。以往研究发现富含SIRT3激活剂的食物可改善机体代谢,姜黄素具有心脏保护和抗衰老特性[10]。白藜芦醇通过激活SIRT3改善糖尿病性心肌病[11]。所以,增加SIRT3的活性可能是减轻心脏衰老影响的潜在策略。本实验中,TSDP干预心肌细胞后增加了SIRT3及抗氧化酶SOD2的蛋白水平。同时TSDP增加了AGEs引起的SIRT3蛋白水平和SOD2蛋白水平的下降。
许多研究已证明,过表达SIRT3可以增加SOD2和过氧化氢酶CAT的表达,进而对抗由ROS诱导的细胞氧化损伤[12]。ROS在冠心病的发生、发展中发挥重要的作用,是造成心肌细胞损伤加重和患者死亡的重要因素。它的产生和细胞对其解毒能力之间的不平衡扰乱了细胞还原环境,导致氧化应激。低ROS水平通过诱导适应性反应的防御机制,继而提高抗压能力,有助延长寿命。高ROS水平导致适应不良,导致衰老的发生和发展[13]。AGEs被认为是一个重要的促进ROS产生和造成氧化应激、继而引发心肌损伤的因素[14]。我们前期研究也证明了AGEs增加了心肌ROS产生,促进心肌衰老。SOD2活性的高低可间接反应细胞清除氧自由基的能力,及时清除ROS保护内环境至关重要。热量限制可通过激活SIRT3,进而去乙酰化 SOD2,减少氧化应激[15]。在本次试验中,AGEs减少了SOD2蛋白水平的表达,增加了ROS产生。预先干预TSDP后,AGEs引起的ROS增强及SOD2蛋白水平减少均得到了缓解。因此,我们推测TSDP可能通过增加SIRT3,进而增加SOD2的水平,对 AGEs通过氧化应激引起的心肌细胞老化起到保护作用。
综上所述,本研究结果显示,TSDP可改善AGEs引起的心肌细胞衰老现象,为祖国传统药物干预老化治疗提供了理论依据。其作用机制可能与升高SIRT3、调节氧化应激有关。但其中具体作用机制及其他信号通路仍需进一步研究。

