基于重组氧化葡萄糖酸杆菌生物合成吡咯喹啉醌
叶润乐,李沣,丁凡,赵振辉,陈晟,袁建锋,2
1 浙江师范大学 行知学院,浙江 兰溪 321100
2 浙江师范大学 浙江省野生动物生物技术与保护利用重点实验室,浙江 金华 321004
在大部分细菌中,吡咯喹啉醌 (Pyrroloquinoline quinone,PQQ)是与膜结合脱氢酶相关的非常规氧化还原辅基,并以非共价结合的方式与脱氢酶相结合[1],氧化底物并将电子直接传递给呼吸链。PQQ在生命活动中起着重要的作用,如调节免疫[2]、清除自由基[3]、防治神经损伤[4-5]、促进农作物生长[6-7]、应用于生物电化学[8]、参与微生物的信号转导[9]等。研究表明,PQQ在许多生物过程中都参与反应,包括作为营养物质,因此,PQQ也被认为是第15种维生素[10]。
PQQ广泛存在于植物、细菌、动物等生物体内,但仅部分革兰氏阴性细菌可合成PQQ,如扭脱甲基杆菌Methylobacterium extorquens[11-12]、甲基营养菌Methylotrophic bacteria[13-14]、成团泛菌Pantoea ananatis[15]、氧化葡萄糖酸杆菌Gluconobacter oxydans[16-17]、生丝微菌属Hyphomicrobium[18]、肺炎克雷伯氏菌Klebsiella pneumoniae[19]等。关于PQQ生物合成途径的研究已有30余年,通过对不同生物PQQ合成基因进行标记,发现生物之间存在一定的差异,如M. extorquensAM1含有一个pqqABC/DE操纵子单元,其中的pqqC与pqqD为嵌套融合基因,而pqqFG基因与其他 3个基因形成另外的操纵子[20-21];Goosen报道[22]醋酸钙不动杆菌Acinetobacter calcoaceticus中只有pqqABCDE基因簇,而不含有pqqF基因;Stover等报道[23]铜绿假单胞菌Pseudomonas aeruginosa中pqqABCDE基因簇与pqqF基因相互分离;而在G. oxydanse[16]和K. pneumonia[24]中均以简单pqqABCDE基因簇形式存在。然而,PQQ生物合成途径及其代谢调控机制却仍未完全阐明。Kleef等[18]利用13C同位素标记物对培养基进行跟踪,并通过磁共振成像(Magnetic resonance imaging,MRI) 对PQQ合成途径进行深入分析发现,Glu和Tyr是PQQ合成所需的重要氨基酸,这与pqqA基因编码的保守肽段Glu-X-X-X-Tyr序列相符合,并提出了PQQ生物合成的Glu和Tyr缩合假说[25]。
随着医药、化妆品、保健品、环境和食品行业的发展,PQQ市场需求量逐年增加。目前,全球市场需求100多t,主要供应商是日本的三菱瓦斯化学,另有部分通过植物提取制备PQQ,但植物含量低、提取难度高,化学合成则过程复杂、收率低、对环境易造成污染,不适于推广。相比之下,生物法制备PQQ具有反应条件温和、合成过程易于控制、对环境无污染等优点,是未来工业化生产PQQ的发展方向[26]。目前,生物法合成PQQ还未见工业化应用的报道,主要存在的问题是PQQ产量过低,生产成本过高。据报道[1],一部分细菌能产生极少量PQQ供自身代谢所需,如恶臭假单胞菌P. putida;另外一部分如甲基利用型细菌,能产PQQ约2–3 mg/L,甚至有的能达几十毫克每升。孙继国[27]利用不同启动子,分别在大肠杆菌Escherichia coli和K. pneumoniae中表达5.5 kb的pqqABCDEF基因簇,并在优化培养基条件基础上,PQQ产量为1 700 nmol/L。Meulenberg等[28]在E. coli中克隆表达来源于K. pneumoniae的6.7 kbpqq基因簇,PQQ产量仅为280 nmol/L。李盼盼[29]以G. oxydans621H作为出发菌株,对培养基进行单因素及正交实验优化,并考察前体物对PQQ合成影响,最终PQQ产量为0.813 mg/L。王朝绚[30]在E. coliBL21(DE3) 中融合表达PQQ合成基因簇及信号肽pelB基因,使得PQQ产量提高24%,达40.73 mg/L。
综上,人们已经将目光投向微生物法合成PQQ,并进行一定尝试性研究,但目前PQQ产量仍然较低。本文在前期研究的基础上,以G. oxydanDSM2343作为研究对象,通过代谢工程手段敲除宿主菌副产物乙酸代谢途径,同时强化宿主菌PQQ合成模块,并对发酵培养基添加物和发酵条件进行优化,以提升PQQ生物合成产量,为PQQ高效生物合成奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本实验相关菌株及使用质粒见表1。
1.1.2 主要试剂
PrimeSTAR GXL DNA Polymerase套装、LATaqDNA聚合酶套装、限制性内切酶、T4 DNA连接酶等购自 TaKaRa公司;无缝定向克隆试剂盒 (pEASY-Uni Seamless Cloning and Assembly Kit) CU101购自TansGene Biotech公司;SanPrep柱式PCR产物纯化试剂盒、SanPrep柱式DNA胶回收试剂盒、细菌基因组提取试剂盒、质粒提取试剂盒、抗生素 (Cefoxitin、Ampicillin sodium、Kanamycin Sulfate)及分子级别化学试剂均购自生工生物工程 (上海) 股份有限公司;酵母抽提物和蛋白胨,购自 Oxoid公司;PQQ标准品购自Sigma-Aldrich公司;PCR引物 (表2) 合成及测序均由生工生物工程 (上海) 股份有限公司完成。

表1 本研究相关菌株及质粒Table 1 Strains and plasmids used in this work

表2 本研究相关引物Table 2 Primers used in this work
1.1.3 培养基及培养条件
LB培养基 (g/L):胰蛋白胨10,酵母提取物5,NaCl 10 (固体平板加入1.5%琼脂粉),pH自然。
MP培养基 (g/L):胰蛋白胨3,酵母提取物5,甘露醇 25 (固体平板加入 1.5%琼脂粉),pH 6.0。
PQQ发酵培养基 (g/L):葡萄糖5,酵母粉2,(NH4)2SO40.5,KH2PO40.2,MgSO4·7H2O 0.5,pH 6.5。
大肠杆菌用LB培养基,37 ℃、220 r/min振荡培养;氧化葡萄糖酸杆菌选用 MP培养基,30 ℃、220 r/min振荡培养。
所有培养基或固体平板,根据实验需要加入相应的抗生素 (抗生素工作浓度 Amp 100 μg/mL,Cef 50 μg/mL,Kan 50 μg/mL)。
1.2 方法
1.2.1 分子生物学操作方法
基本分子生物学操作均参照《分子克隆实验指南 (第四版)》[31]进行。
1.2.2 敲除质粒pDGOX1081的构建
根据GenBank中公布G. oxydans621H基因组 (NC_006677) 信息设计引物,以G. oxydansDSM2343基因组为模板,1081_HindⅢ_F/1081_Fus_R和 1081_Fus_F/1081_SalⅠ_R为引物,分别PCR扩增GOX1081上游约1 072 bp、下游约1 099 bp的同源臂基因片段。以PCR产物纯化试剂盒回收上下游同源臂为模板,1081_Hind Ⅲ_F/1081_SalⅠ_R为引物,重叠PCR将上下游片段融合并克隆于 pEASY-Blunt simple质粒,测序正确后,Hind Ⅲ和SalⅠ双酶切回收GOX1081上下游融合片段及pJKM质粒片段,T4 DNA酶连接线性同源臂及自杀质粒片段,构建敲除质粒pDGOX1081。
1.2.3 GOX1081基因敲除
敲除质粒 pDGOX1081通过热激法转化于E. coliS17-1感受态细胞。将阳性转化子E. coliS17-1/pDGOX1081和辅助菌E. coliHB101在LB培养基37 ℃下振荡培养至OD600为0.8,G. oxydansDSM2343在MP培养基30 ℃下振荡培养至OD600为0.6,三菌以1︰1︰1的比例混合,按三亲本杂交[32]的方法将敲除质粒 pDGOX1081 转化G. oxydansDSM2343。通过在含Cef和Kan (终浓度均为50 μg/mL) 的MP固体培养基上筛选获取一次重组菌。
挑取一次重组阳性菌单菌落,在无抗MP培养基中30 ℃培养过夜;取适量菌液,在含有10%蔗糖和50 μg/mL Cef抗生素的MP平板上划线,30 ℃培养3 d后长出单菌落,即为二次重组菌。选用1081_Seq_F/1081_Seq_R为引物,采用菌落PCR鉴定筛选GOX1081基因敲除的阳性重组菌,并命名为G. oxydansT1。
1.2.4 PQQ合成模块强化重组菌的构建
以G. oxydansDSM2343基因组为模板,Add_0169_F/pqq_Fuse0169_R、pqq_Fuse0169_F/0169_Fusepqq_R、0169_Fusepqq_F/tldD_Fuse0169_R及tldD_Fuse0169_F/Add_tldD_R为引物,PCR分别扩增第1个内源性启动子P0169、pqqABCDE基因簇、第2个内源启动子P0169和tldD基因片段,并用PCR产物纯化试剂盒回收相应基因片段。穿梭表达质粒pUCpr经限制性内切酶SalⅠ处理后经琼脂糖凝胶电泳并割胶回收pUCpr线性质粒片段。所有基因片段按全式金无缝定向克隆试剂盒要求操作,构建融合表达质粒 pUCpr-1。经测序正确后,pUCpr-1电穿孔转化G. oxydansT1感受态细胞。采用 GenePulser Bacteria Ⅱ预设程序(2.5 kV,200 Ω,25 μF) 进行电击转化,时间常数在 4.5–5 ms。电击后经 30 ℃、220 r/min预培养4–6 h,并涂布于含有 100 μg/mL Amp 及 50 μg/mL Cef抗生素的MP平板培养基上,30 ℃恒温培养箱中培养4 d,获取阳性重组菌G. oxydansT2。
1.2.5 生物量及PQQ检测
分光光度法测定培养液浊度OD600,并通过细胞干重DCW建立线性对应关系DCW=0.353 5×OD600+0.120 4,R2= 0.999 7计算生物量。
发酵培养液经离心、0.22 μm膜过滤等预处理后,采用课题组建立的HPLC测定PQQ含量[33]。HPLC检测条件:流动相为甲醇︰水 (含0.06 mol/L磷酸)=7︰3,流速0.5 mL/min,色谱柱ZORBAX Eclipse Plus C18,进样量 10 μL,柱温 30 ℃,检测波长254 nm,PQQ保留时间为6.8 min。通过标准曲线方程Y=77.677 7X–841.166 4,R2=0.999 1由峰面积计算PQQ浓度。
2 结果与分析
2.1 GOX1081基因敲除
G. oxydansDSM2343中,GOX1081基因编码丙酮酸脱羧酶 (Pyruvate decarboxylase),催化丙酮酸脱羧形成乙醛,进一步通过依赖于 NADP+的乙醛脱氢酶作用,产生乙酸。2013年,Peters等[34]证实G. oxydansDSM2343中副产物乙酸的代谢主要与GOX1081相关。
在GOX1081无痕敲除过程中,pJKM 含有RP4基因[35],能高效指导同源重组,使得pDGOX1081整合到宿主基因组。同时,pJKM携带有sacB基因,其编码分泌型蔗糖果聚糖酶(Levansucrase),催化蔗糖水解成葡萄糖和果糖,并且将果糖聚合成高分子量的果聚糖。高分子量果聚糖积累对细胞存在潜在的毒性作用,可造成细胞死亡,从而引入反向筛选压力。因此,在含10%的蔗糖平板上培养,可以获取二次同源交换重组菌,产生目标基因被敲除或者回复为野生型两种表型[36]。结果如图 1所示,在筛选的 23株突变菌株中,有7株产生阳性突变,即GOX1081基因被敲除,而16株回复为野生型,即通过pJKM介导的同源臂敲除,二次重组成功率约为30.43%。据文献报道[16],以sacB基因介导的无痕重组敲除效率较低,使得二次筛选工作繁琐,如pK18mobsacB和pK19mobsacB。而pJKM中,在sacB基因的上游插入Ptac杂合启动子,从而增强sacB基因的表达,提高宿主反向筛选压力,增加二次重组发生几率。
2.2 PQQ合成模块融合表达
通过全式金无缝定向克隆试剂盒,构建P0169启动子、pqqABCDE基因簇及tldD基因融合表达质粒pUCpr-1,并转化获取重组菌G. oxydansT2。广宿主表达质粒,如pBBR1MCS系列,以及tufB基因启动子,是氧化葡萄糖酸杆菌中常用的表达调控元件。pBBR1MCS系列属于组成型表达系统,蛋白表达量较低。本实验用pUCpr载体为实验室构建,具有 pUC19遗传特性和G. oxydansDSM2343内源质粒片段 Par-Rep蛋白基因。Rep蛋白是质粒复制蛋白,Par蛋白则与纺锤丝的动力机制有关,起着调控质粒复制的作用[25],因此,pUCpr为大肠杆菌及氧化葡萄糖酸杆菌的穿梭表达质粒,具有较高的表达量。P0169启动子大小104 bp,其中-35 (TTGGTA) 及-10 (TATAAC) 区域为E. coliσ70和枯草芽孢杆菌B. subtilisσ43识别位点,且其间隔序列为 19 bp,这与E. coli((17±1) bp) 和B. subtilis((18±1) bp) 非常相似(图2),说明P0169启动子在Gluconobacter中具有强的启动活性[37]。

图1 菌落PCR筛选GOX1081基因敲除Fig. 1 Screening for G. oxydans DSM2343 GOX1081 deletion mutants. M: 10 000 marker; C: control.

图2 P0169启动子序列Fig. 2 Schematic representation of the P0169 promoter sequence.
另外,经序列比对发现,G. oxydans中tldD基因与大肠杆菌中tldD有51%的同源性,实验证实,tldD基因与PQQ合成相关,功能类似于其他PQQ合成生物中的pqqF基因[25],可有效提升PQQ的合成[16]。
2.3 不同重组菌生物合成PQQ
对野生菌、重组菌G. oxydansT1及G. oxydansT2进行发酵培养,分别考察发酵过程中不同时间段的生物量和 PQQ产量,结果如图 3所示。GOX1081基因的敲除,切除了乙酸代谢途径[34],发酵48 h后,重组菌G. oxydansT1及G. oxydansT2的生物量达 (3.69±0.01) g/L 和 (3.58±0.01) g/L,较野生菌 ((2.58±0.02) g/L) 提高 43.02%和38.76%。G. oxydansT2中表达了PQQ合成模块的基因,其生物量较重组菌G. oxydansT1略有降低。以上结果说明副产物乙酸是影响氧化葡萄糖酸杆菌的生长的一个重要因素,与文献报道结果一致[34]。而对于PQQ的合成,发酵48 h后,野生菌产量为(0.148 5±0.001 2) mg/L,重组菌G. oxydansT1和 T2的产量为 (0.716 5±0.001 23) mg/L和(3.058 0±0.011 2) mg/L,结果显示,融合表达pqqABCDE及tldD基因后,可以有效提高氧化葡萄糖酸杆菌的PQQ产量,因此G. oxydansT2为较理想的PQQ生产菌株。
2.4 不同添加物对重组菌合成PQQ的影响
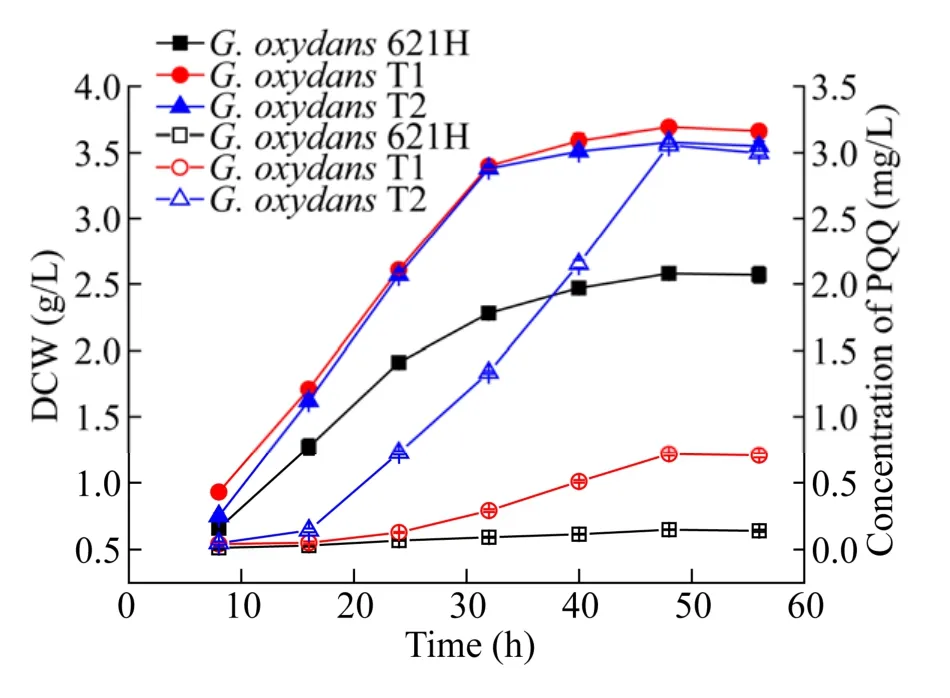
图3 野生菌、重组菌G. oxydans T1及T2生物量和PQQ产量Fig. 3 Biomass and PQQ production of wild strain (■, □),G. oxydans T1 (●, ○) and G. oxydans T2 (▲, ∆).
据文献证实,Glu和Tyr是PQQ合成的重要氨基酸,与pqqA表达肽段的保守氨基酸一致[16,25]。因此考察不同浓度 Glu和 Tyr的添加对重组菌G. oxydansT2合成PQQ的影响。取配制好的50 mL摇瓶 5个,按 1.0、2.0、3.0、4.0、5.0 g/L加入Glu;另取 5个摇瓶,按 1.0、2.0、3.0、4.0、5.0 g/L加入Tyr,在30 ℃、220 r/min振荡培养48 h后测定PQQ产量,结果见图4A。当Glu和Tyr的添加量都为4.0 g/L时,PQQ的合成量最大,随着添加的增加反而产量又下降,说明Glu和Tyr作为前体可以促进PQQ的合成[38],而过多浓度氨基酸的添加将影响发酵体系的 pH值和离子强度,从而影响PQQ的合成。在添加Glu和Tyr的基础上,进一步考察Fe2+对PQQ合成的影响,即在发酵培养基中分别添加1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L 和 9.0 mg/L FeSO4·7H2O,30 ℃、220 r/min振荡培养 48 h后测定 PQQ产量,结果如图 4B所示。FeSO4·7H2O 的添加与重组菌G. oxydansT2 合成PQQ的能力具有正相关性,当添加量为 5.0 mg/L时 PQQ合成最高,达(6.673 4±0.112 4) mg/L,而随后PQQ产量下降,说明 Fe2+对 PQQ的合成在一定范围内具有促进作用。
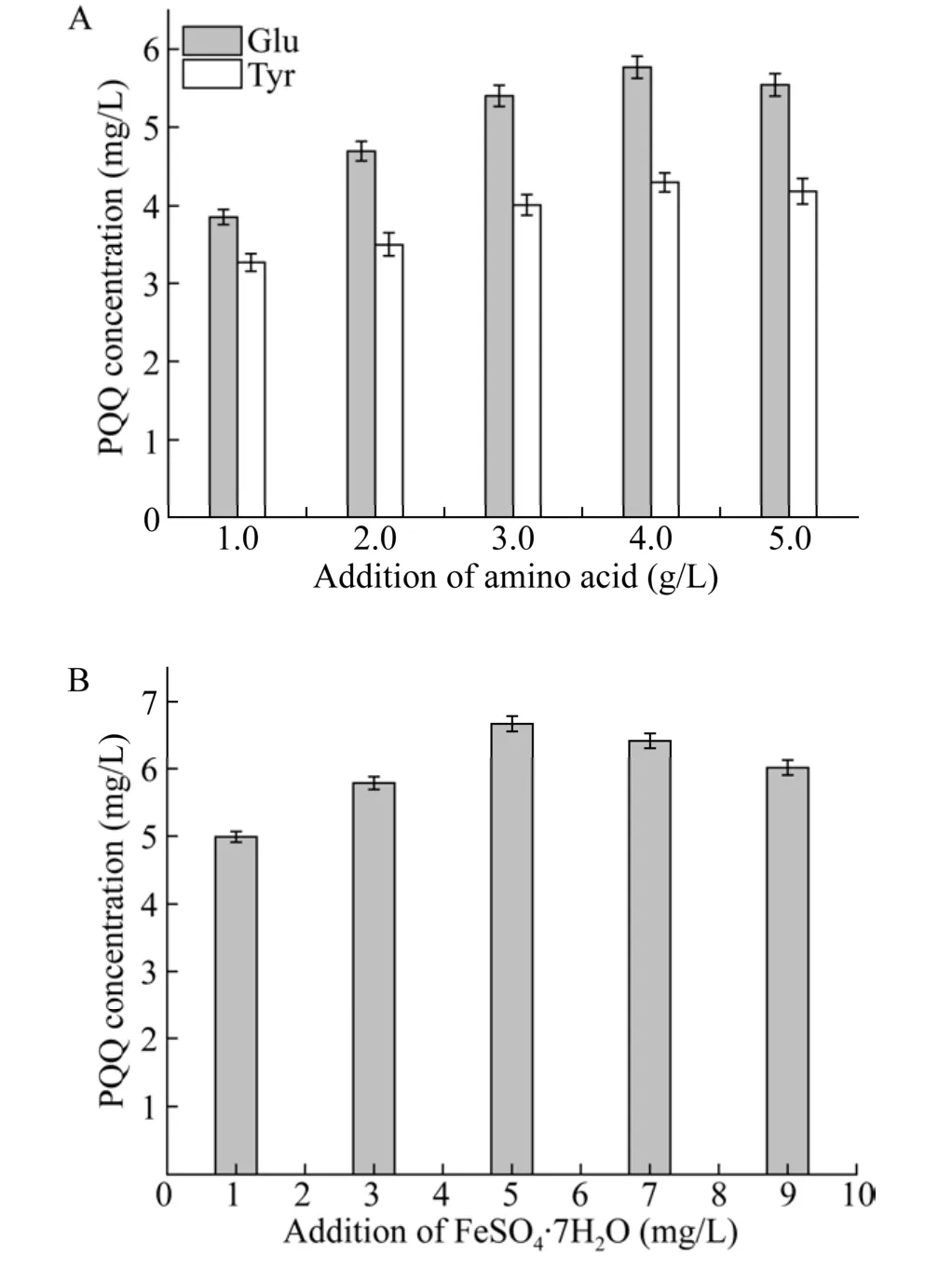
图4 不同浓度添加物 Glu、Tyr (A) 和 Fe2SO4·7H2O (B)对G. oxydans T2合成PQQ的影响Fig. 4 Effect of different additives on PQQ synthesis by G. oxydans T2. (A) Glu and Tyr. (B) Fe2SO4·7H2O.
综合以上结果可知,不同添加物对PQQ的合成具有不同程度的影响,为进一步明确不同添加物之间的显著特性和交互关系,对 Glu、Tyr和FeSO4·7H2O设计L9(34) 正交实验,分别考察A:Glu添加量 (3.5 g/L,4.0 g/L,4.5 g/L)、B:Tyr添加量 (3.5 g/L,4.0 g/L,4.5 g/L) 和 C:FeSO4·7H2O(4.5 mg/L,5.0 mg/L,5.5 mg/L) 的条件下G. oxydansT2合成PQQ产量。由表3结果可知,从极差R值的大小可以看出各因素的主要次序是:A (Glu)>B (Tyr)>C (FeSO4·7H2O),其中 Glu 和 Tyr是影响PQQ产量的主要因素,而 FeSO4·7H2O的影响较小;最佳因素水平为A2B3C1,即当Glu添加量为4.0 g/L、Tyr添加量为 4.5 g/L、FeSO4·7H2O 添加量为4.5 mg/L时,重组菌G. oxydansT2的PQQ产量可达 18.392 8 mg/L。从方差分析表来看(表4),A (Glu) 因素在培养基一致的条件下起最显著作用,B (Tyr) 作用次之,而 C (FeSO4·7H2O) 在考察范围内对PQQ的合成影响不大。说明PQQ的合成与Glu和Tyr有关,与PQQ缩合假说一致[25]。

表3 不同添加物正交实验结果Table 3 Orthogonal experiment results of different additives

表4 方差分析表Table 4 The analysis of ANOVA
2.5 G. oxydans T2合成PQQ发酵条件优化
2.5.1 碳源的选择
碳源对于氧化葡萄糖酸杆菌而言显得比较重要,主要是氧化葡萄糖酸杆菌含有丰富的膜结合蛋白,能高效氧化多种底物,并分泌到发酵液中。比如以葡萄糖为底物,可以产生葡萄糖酸、2-酮基-D-葡萄糖酸和 5-酮基-D-葡萄糖酸,使得发酵液 pH迅速下降[39],为此选择合适的碳源就至关重要。本实验选用果糖、蔗糖、木糖、山梨醇、甘露醇、甲醇、乙醇及甘油作为唯一碳源,添加量为0.5%,葡萄糖作为对比,其他无机盐和前体添加物一致,30 ℃、220 r/min振荡培养48 h,发酵结束后测定重组菌G. oxydansT2的生物量及PQQ产量,结果如图5A所示。当以甲醇为唯一碳源时,其细胞干物质和 PQQ产量为最高,分别是(4.897 6±0.223 4) g/L 和 (29.765 7±0.687 7) mg/L,较葡萄糖对照组分别提高了 37.41%和 61.83%。据文献报道[25],在G. oxydans621H中的甲醇脱氢酶以PQQ为辅助因子,同时甲醇又提供良好的能量来源。另外,G. oxydans621H中还含有山梨醇脱氢酶、甘露醇脱氢酶、葡萄糖脱氢酶,因此山梨醇、甘露醇及葡萄糖作为碳源时,重组菌G. oxydansT2也能较好地生长。相比之下,以果糖、蔗糖及木糖为碳源时,生长欠佳,推测该菌中相关代谢基因活性不高。因此,甲醇可以作为较理想的碳源用于合成PQQ。
以甲醇作为唯一碳源,考察不同浓度的甲醇(2.0%、2.5%、3.0%、3.5%、4.0%) 对菌体的生长及PQQ合成的影响,结果见图5B,甲醇浓度在2.0%–3.5%范围内,G. oxydansT2菌体量和PQQ产量均逐步提升,以 3.5%的添加量为最高,分别为(5.665 4±0.351 2) g/L 和 (34.001 2±0.732 4) mg/L,而当甲醇浓度增加到4.0%时,菌体量和PQQ均有所下降,说明高浓度的底物对重组菌具有一定的抑制作用,导致合成PQQ的酶活性下降。
2.5.2 发酵条件
在优化了前体添加物和碳源的基础上,继续考察接种量 (2%、4%、6%、8%、10%)、起始pH(5.5、6.0、6.5、7.0、7.5) 和培养温度 (26 ℃、28 ℃、30 ℃、32 ℃、34 ℃) 对重组菌G. oxydansT2 合成PQQ的影响,结果见图6。接种量对PQQ的合成影响较大,当接种量为 6%时,PQQ合成量最大,可达 (45.785 6±1.176 9) mg/L;而pH对PQQ合成的影响相对小一点,以pH 6.5为最佳,PQQ产量达 (48.789 4±1.223 1) mg/L;温度对重组菌G. oxydansT2合成PQQ有一定的影响,当培养温度为 28 ℃时,PQQ合成量最大,可达(51.324 1±0.899 7) mg/L,说明温度对菌株内酶的活性具有重要影响,进而影响PQQ的合成,最终PQQ产量是出发菌株的345.62倍。
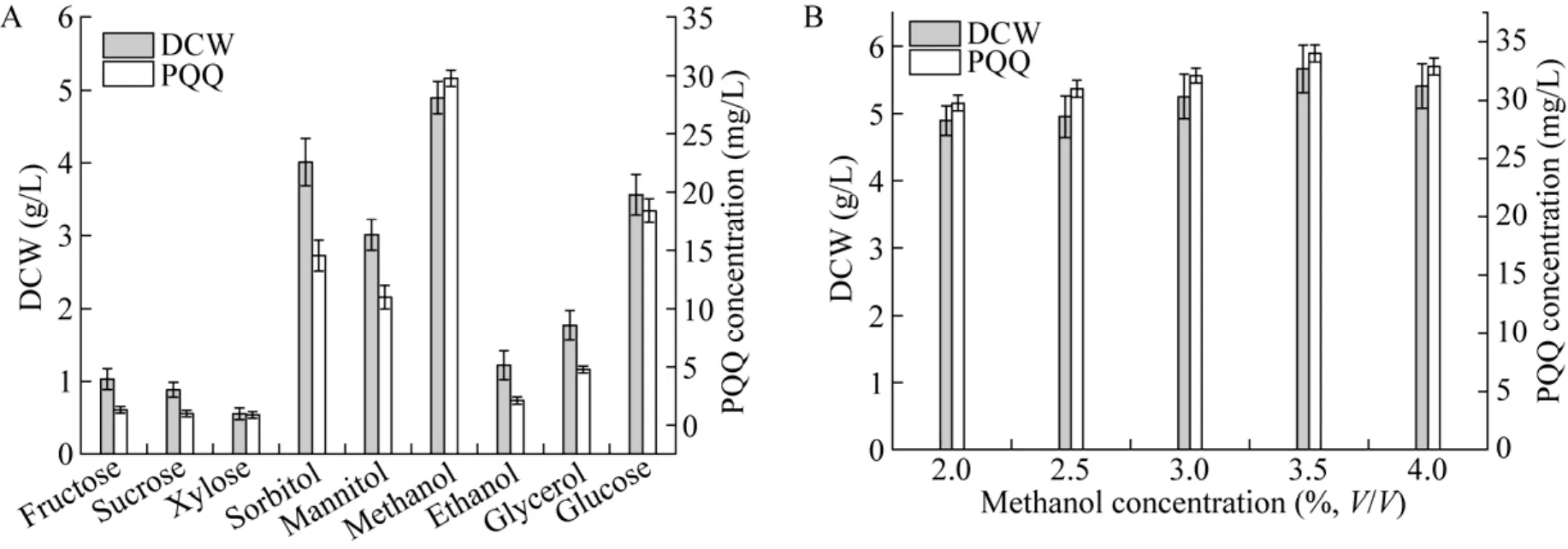
图5 不同碳源 (A) 和不同甲醇浓度 (B) 对菌体生长及合成PQQ的影响Fig. 5 Effect of different carbon resources (A) and methanol concentration (B) on cell growth and PQQ synthesis.
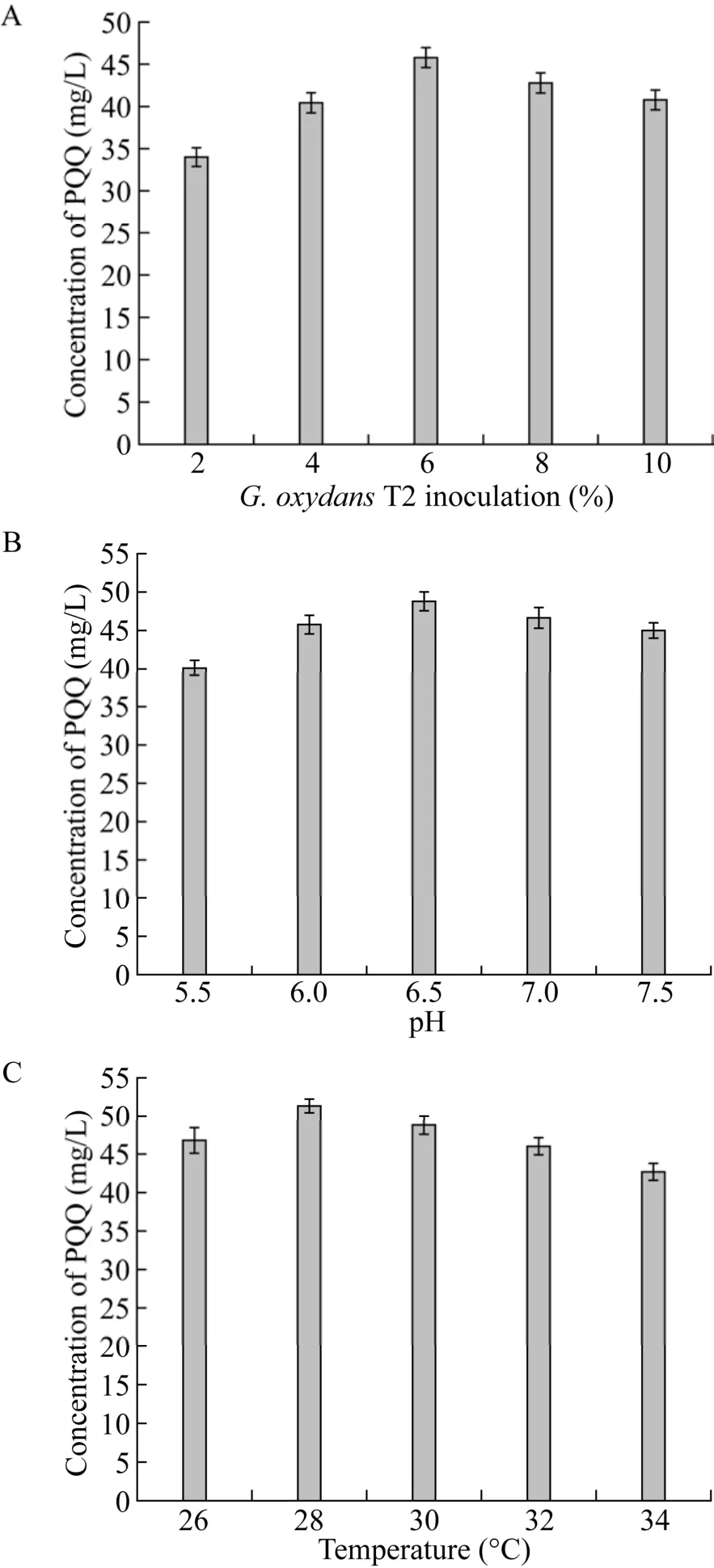
图6 不同接种量 (A)、 不同起始pH (B) 和不同培养温度 (C) 对G. oxydans T2合成PQQ的影响Fig. 6 Effect of different inoculum (A), initial pH (B)and temperature (C) on PQQ production by G. oxydans T2.
3 讨论
氧化葡萄糖酸杆菌是典型的工业应用微生物,本研究以氧化葡萄糖酸杆菌作为研究对象,通过基因工程手段,无痕敲除表达丙酮酸脱羧酶GOX1081基因,有效提高生物量 43.02%,同时PQQ产量提高 382.49%。说明在G. oxydansDSM2343中,经丙酮酸脱羧酶途径产生乙酸对G. oxydans的生长具有影响[34],同时也是碳流竞争影响PQQ合成的原因。在此基础上,为进一步提升PQQ的合成,本研究采用强化PQQ合成模块的策略在内源性强启动子 P0169下,融合表达pqqABCDE基因簇和与之合成相关的tldD基因[39],构建重组菌G. oxydansT2。摇瓶发酵结果表明,在内源性启动子下,PQQ合成模块的表达得到强化,同时也说明菌体生物量和PQQ基因拷贝数是影响PQQ合成的关键因素。2016年,Wang等[40]利用广宿主质粒pBBR1MCS-2、pqqA启动子、tufB启动子以及tldD基因在G. oxydansWSH-003中研究单个结构基因的表达对PQQ合成的影响,发现单个基因的作用pqqB>pqqA>pqqD>pqqC>pqqE,这也为G. oxydans合成PQQ提供了一定的借鉴。
目前,大量的代谢工程研究表明[41],当目标产物合成途径表达加强时,产物与底物之间的不匹配往往也是影响最终产量的因素。本研究对重组菌培养基添加物进行优化结果证实了这个结论,当增加底物 Glu和 Tyr时能较大程度地提升PQQ产量。进一步对碳源、接种量、起始pH、培养温度等培养条件进行优化,最终重组菌G. oxydansT2的PQQ产量为 (51.324 1±0.899 7) mg/L,是出发菌株的345.62倍。目前,微生物合成PQQ的产量在100–200 mg/L左右,如Methylovorussp.和K. pneumoniae[11,13-14,40]。氧化葡萄糖酸杆菌具有大量依赖于PQQ的膜结合脱氢酶,内源性合成PQQ一直是氧化葡萄糖酸杆菌高效催化氧化的瓶颈,因此,还有大量的工作可做,来提高氧化葡萄糖酸杆菌合成PQQ的能力。本研究利用代谢工程手段有效提高了G. oxydansDSM2343合成PQQ的能力,后期可进一步对补料发酵条件进行考察,建立 PQQ的分批补料发酵工艺,为 PQQ的工业化生产做铺垫。
——一道江苏高考题的奥秘解读和拓展

