呼伦贝尔沙地樟子松根内真菌群落结构与功能群特征
魏晓帅 郭米山 高广磊,2,† 任悦 丁国栋,2 张英
呼伦贝尔沙地樟子松根内真菌群落结构与功能群特征
魏晓帅1郭米山1高广磊1,2,†任悦1丁国栋1,2张英1
1.北京林业大学水土保持学院, 水土保持国家林业与草原局重点实验室, 北京 100083; 2.宁夏盐池毛乌素沙地生态系统国家定位观测研究站, 吴忠 751500; †通信作者, E-mail: gaoguanglei@bjfu.edu.cn
为揭示呼伦贝尔沙地樟子松根内真菌群落结构和功能群特征, 以呼伦贝尔沙地樟子松天然林和不同林龄人工林为研究对象, 采用野外调查和分子生物学相结合的方法, 鉴定并分析沙地樟子松根内真菌群落结构和功能群特征。在呼伦贝尔沙地樟子松根尖样品中共获得 520 个真菌 OTUs, 隶属于 5 门 87 科 197 属, 其中担子菌门()和子囊菌门()的相对丰度较高, 分别为 54.98%和 39.27%。天然林优势菌属为双子担子菌属()、红菇属()和, 人工林优势菌属为乳牛肝菌属()、和口蘑属(), 其余菌属的相对丰度随林龄的变化波动较大。沙地樟子松人工林根内真菌多样性指数随林龄增长均呈降低趋势, 成熟林根内真菌多样性指数显著低于沙地樟子松近熟林、中龄林和天然林(<0.05)。沙地樟子松天然林与人工林根内真菌群落结构变异性较小。其中, 天然林与成熟林根内真菌群落结构差异较大, 与近熟林根内真菌群落结构最接近。共生营养型真菌比例随林龄增长而逐渐增大, 腐生营养型和病理营养型真菌比例随林龄增长逐渐减小; 天然林与近熟林共生营养型真菌的占比较为接近, 腐生营养型真菌在天然林中占比较大。沙地樟子松根内真菌群落结构复杂, 物种丰富多样, 外生菌根真菌和未定义腐生菌为主要功能类群, 部分真菌在不同林分的生态策略存在差异。
根内真菌; 沙地樟子松; 呼伦贝尔沙地; 多样性; 群落结构; 生态功能群
沙地樟子松(var.)耐寒, 耐旱, 耐贫瘠[1], 是我国北方农田防护林和防风固沙林的重要树种。20 世纪 50 年代, 科尔沁沙区率先引种栽植大量沙地樟子松苗木, 之后沙地樟子松被大规模引种, 推广至我国北方荒漠化地区。但是, 自 20 世纪 90 年代起, 科尔沁沙地樟子松人工林出现叶枝枯黄、长势衰退和病虫害爆发等问题[2]。此后, 各地引种栽植的沙地樟子松人工林均出现不同程度的衰退现象。沙地樟子松人工林衰退已成为制约我国北方风沙区生态环境建设和农林牧业发展的重大问题。国内外学者以沙地樟子松人工林衰退为核心, 围绕土壤水分、养分、温度和光照等进行研究, 取得一定的成果[3–5], 但沙地樟子松人工林的衰退问题依然没有得到有效的解决。
土壤真菌是土壤系统中重要的微生物类群, 不仅参与凋落物分解, 促进土壤有机质积累和转化[6], 驱动和调控生态系统物质能量循环[7], 而且促进植物吸收水分和养分, 减轻干旱、盐分和重金属等胁迫因素的危害[8–10], 对增强植物适应性和抗逆性具有重要意义[10]。沙地樟子松根内真菌群落组成复杂, 多样性丰富, 是典型的菌根依赖型乔木树种[11]。因此, 土壤真菌可能是对沙地樟子松衰退具有重要影响的生物因素[12–13]。已有部分学者致力于沙地樟子松根内真菌研究, 但大多聚焦于沙地樟子松根内真菌群落组成或特定菌种对于沙地樟子松生长和生理过程的影响[14–16], 对根内真菌功能群特征的研究较为薄弱。
呼伦贝尔沙地不仅是沙地樟子松的天然分布区, 还是沙地樟子松的重要造林区。呼伦贝尔沙地樟子松天然林和人工林面积广大, 长势良好, 研究其根内真菌群落结构和功能群特征对深入理解土壤真菌与沙地樟子松衰退之间的关系具有重要意义。本文以呼伦贝尔沙地樟子松天然林和人工林为研究对象, 对比分析沙地樟子松天然林和人工林根内真菌群落结构和功能群特征, 以期为破解沙地樟子松衰退问题提供参考借鉴。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古自治区东北部呼伦贝尔沙地(N47°36′—49°13′, E118°58′—120°32′), 属于中温带半湿润大陆性季风气候区, 年均气温为–0.3~0℃, 年平均降水量为 280~359mm, 年均蒸发量为 1400~ 1900mm, 年均日照小时数为 2558.6。研究区内主要土壤类型为风沙土, 养分含量较低, 乔木植被主要为沙地樟子松、山杨()、白桦()、蒙古栎()、兴安落叶松()以及山杨等。灌草植被主要为羊草()、针茅()、小叶锦鸡儿()以及黄柳()等。
1.2 样品采集与处理
2017 年 7 月, 在呼伦贝尔红花尔基国家森林公园和海拉尔区国家森林公园分别采集沙地樟子松天然林和人工林细根样品和土壤样品, 采样位置见图 1。研究区内各样地具有相同的土地利用历史, 在种植樟子松后均没有任何经营与管理措施。天然林与人工林相距约 100km, 人工林各个样地之间距离2~9km 不等。在各样地内分别布设 50m×50m 的实验样方, 通过生长锥确定树木年龄, 将其划分为中林龄(HBh)、近熟林(HBn)和成熟林(HBm)[1]。林分每木检尺后, 在每个样地内分别选取间距 8m 以上的 5 棵樟子松标准木作为采样对象。使用铁锹移除林木基部半径 1m 以内的地表灌草植被和枯落物。土壤样品采集深度为 0~20cm。小心掘取根样, 挖至根末级, 挑除其他植物混杂的根系, 将沙地樟子松细根样品装入塑封袋内, 细根样品带有少许新鲜土壤用以保鲜, 挖取的干土和鲜土分开封装并标号, 最后将装有根样和鲜土的塑封袋放入 4℃便携恒温箱内保存。样地的详细情况见表1。
1.3 土壤理化性质测定
将土壤样品风干, 过 0.15mm 筛, 进行理化性质分析。采用环刀烘干称重法测定土壤孔隙度(SP)和土壤含水量(SWC), 采用 pH 分析仪测定土壤的pH, 采用重铬酸钾稀释热法测定土壤有机碳(SOC), 采用全自动化学分析仪(Smartchem 200, 意大利)测定土壤全氮(TN)和全磷(TP)含量。采用碳酸氢钠浸取、钼锑抗比色法测定速效磷; 用醋酸铵浸取后, 用火焰光度计测定速效钾[17]。
1.4 根内真菌分子生物学鉴定
细根样品带回实验室, 转入–80℃冰箱保存, 用蒸馏水小心地冲掉细根样品上的沙土和杂物, 挑出菌根, 剪成 10cm 左右的小段, 置于培养皿中进一步清洗干净。将每个样地中 5 棵树菌根末级根剪下后, 充分混合, 再随机分成 5 份, 作为 5 个重复组样品。选取 PowerSoil® DNA Kit (MOBIO 公司,美国)试剂盒对菌根根尖样品进行 DNA 提取, 利用 1%琼脂糖凝胶电泳检测抽提的基因组 DNA。用真菌通用引物 ITS1 和 ITS2 进行菌根 rDNA ITS 区段 PCR扩增。将 PCR 产物混合后, 用 2%琼脂糖凝胶电泳检测, 使用 AxyPrepDNA 凝胶回收试剂盒(AXYGEN公司, 美国)切胶回收 PCR 产物, 用 Tris-HCl 缓冲液洗脱后, 使用 2%琼脂糖凝胶电泳检测。合格的 PCR产物用于 Illumina Miseq 上机测序。
由北京奥维森生物科技有限公司完成 PCR 产物测序工作, 结果用相似性大于 97%的 OTU 单元展示。在美国国立生物技术信息中心(NCBI)网站, 利用 BLAST 分析, 对 OTU 代表序列进行比对, 并在界、门、纲、目、科、属、种各个水平上注释其群落的物种信息。若对比相似率≥97%, 则可以鉴定到种水平; 若相似率介于 90%~97%之间, 则可以鉴定到属水平[18]。
1.5 数据分析方法
采用 R-3.5.1 中 Vegan 模块, 计算沙地樟子松林根内真菌 Simpson、Shannon 和 Pielou 等多样性指数。Sorenson 相似性系数(Cs)和 Jaccad 相似性系数(Cj)采用公式 Cj=/(+–)和 Cs=2/(+)(其中为样地 1 和样地 2 的共有物种数,为样地 1 的物种数,为样地 2 的物种数)计算得到。采用 SPSS 20.0 进行单因素方差和相关性分析, 置信水平为 0.05。采用 OriginPro 2018 进行相对丰度堆积图和热点图绘制, 并分析不同样地之间根内真菌群落的差异性。利用 Canoco for Windows 4.5 进行根内真菌群落结构和土壤理化性质的 RDA 分析及 PCA 图的绘制。利用 Gephi-0.9.2 进行沙地樟子松根内真菌生态功能群网络互作图绘制。在 FUNGuild 数据库解析沙地樟子松根内真菌的生态功能类别[19], 置信水平仅选取可能(probable)和很可能(highly probable)的OTUs 及其类别。将复合营养型和复合功能群真菌全部归为其他营养型(Other trophic mode)和其他真菌(Other fungi)。为避免扩大功能类别的指定, 删除序列数小于 3 的 OTUs[18,20]。
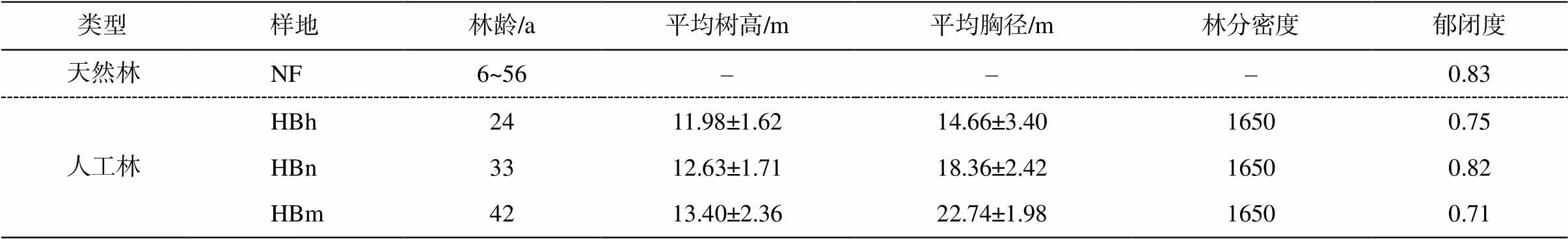
表1 样地基本情况
说明: HBh表示中龄林, HBn表示近熟林, HBm表示成熟林, NF表示天然林。
2 结果与分析
2.1 沙地樟子松根内真菌群落组成
从呼伦贝尔沙地樟子松根尖样品中共获得 982个真菌 OTUs, 将不能鉴定到科水平的 OTU 剔除后, 获得 520 个 OTUs, 隶属于 5 门 15 纲 48 目 87 科 197属。在门水平上, 担子菌门()的真菌相对丰度最高(54.98%), 其次是子囊菌门()(39.27%), 结合菌门()相对丰度较低(2.59%), 而球囊菌门()和壶菌门()相对丰度不足0.1% (图2)。
从图 3 可以看出, 在属水平上, 乳牛肝菌属()在不同林龄沙地樟子松人工林中占比最大, 在中龄林、近熟林和成熟林中占比分别为 26.17%, 38.28%和 58.46%, 而在天然林中的占比相对较小(5.42%); 口蘑属()、和被孢霉属()的占比随着林龄的增长而逐渐减小。天然林中占比最大的物种为双子担子菌属()(33.54%), 而它在人工林中占比较小, 在中龄林、近熟林和成熟林中占比分别为2.59%, 2.1%和 1.05%。
2.2 沙地樟子松根内真菌多样性
研究区沙地樟子松根内真菌的 Shannon, Simp-son 和 Pielou 指数见表 2。随着林龄增长, 沙地樟子松人工林根内真菌多样性指数均呈现逐渐降低趋势, 成熟林根内真菌多样性指数显著低于沙地樟子松近熟林、中龄林和天然林(<0.05)。沙地樟子松天然林根内真菌 Shannon 指数最高, 成熟林根内真菌 Simpson 指数大于天然林, 天然林根内真菌Pielou 指数最大, 分布最均匀。
2.3 沙地樟子松根内真菌群落组成差异与相似性
沙地樟子松天然林和人工林根内真菌群落组成的主成分分析结果如图 4 所示。PC1 贡献率为 14.3%, PC2 贡献率为 13.2%, 成熟林样本比较集中, 其余林分的样点都有不同程度的分散与交错, 中龄林与成熟林以及近熟林与天然林样点之间的相对距离较短, 有较强的相似性, 天然林与人工林之间存在交错, 且距离较近, 表明沙地樟子松天然林与人工林根内真菌群落组成的变异性较小。
沙地樟子松天然林与不同林龄人工林根内真菌群落组成的相似性如表 3 所示。近熟林与天然林最相似, 其 Jaccad 和 Sorenson 相似性指数最大, 分别为 0.85 和 0.92。中龄林与天然林的相似性指数次之, 且与近熟林和天然林相似性指数的差异不大。成熟林与天然林的 Jaccad 和 Sorenson 相似性指数最小, 仅为 0.77 和 0.87, 说明成熟林与天然林根内真菌差异较大。
沙地樟子松天然林与人工林根内真菌 Top20 属中有 9 个共有属(表 4), 在各林龄中的比例分别为天然林 61.63%, 中龄林 79.16%, 近熟林 77.19%, 成熟林 78.13%。共有属在天然林中占比较少, 但在各个林龄人工林之间的占比相差不大, 表明天然林与人工林根内真菌群落结构存在差异, 人工林各林龄之间根内真菌群落组成相似。
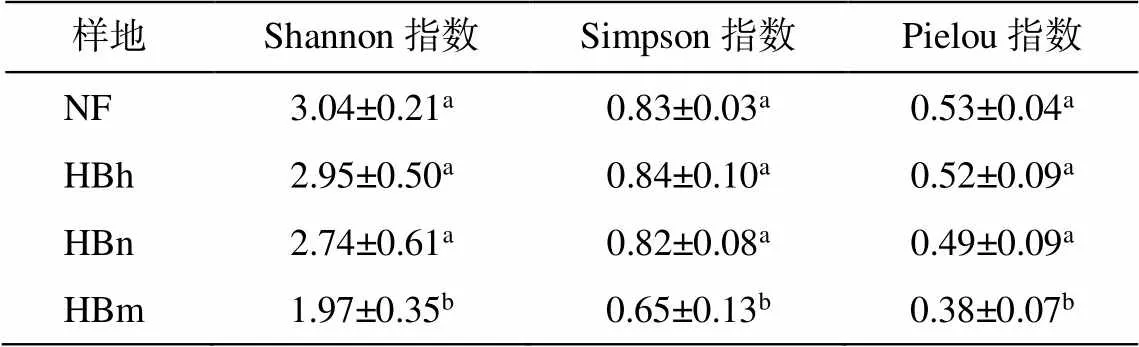
表2 呼伦贝尔沙地樟子松根内真菌多样性分析
注: 不同小写字母表示不同林组之间差异显著(<0.05), 下同。
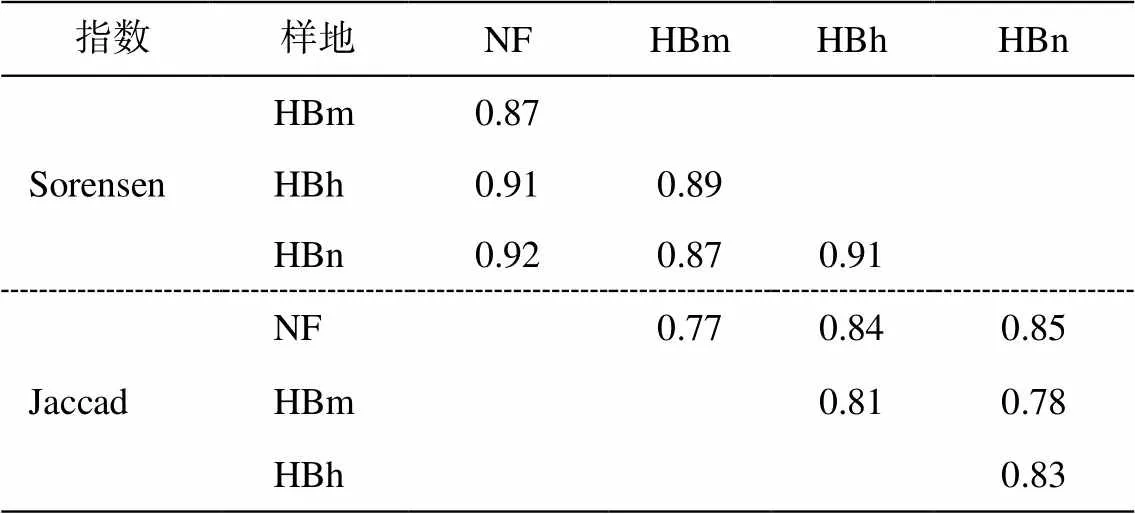
表3 沙地樟子松根内真菌物种组成相似性分析
2.4 沙地樟子松根内真菌生态功能群
基于 FUNGuild 数据库解析, 除去未鉴定类群和复合型类群, 呼伦贝尔沙地樟子松根尖样品中根内真菌可分为 3 种营养模式和 10 个生态功能群(表5)。随着林龄的增长, 共生营养型真菌的占比逐渐增大, 腐生营养型和病理营养型真菌的占比逐渐减小。天然林与近熟林共生营养型真菌的占比较为接近, 腐生营养型真菌在天然林中占比较大。外生菌根真菌为主要生态功能群, 随着林龄的增长在各林龄中的占比逐渐增大, 在天然林与近熟林中的占比最接近。随着林龄的增长, 内生真菌、木质腐生真菌、土壤腐生真菌和粪腐生真菌在各林龄中的占比逐渐减小。未定义腐生菌在天然林中的占比明显大于人工林, 植物病原菌和动物病原菌在沙地樟子松人工林中的占比均高于天然林, 在成熟林中占比最高。
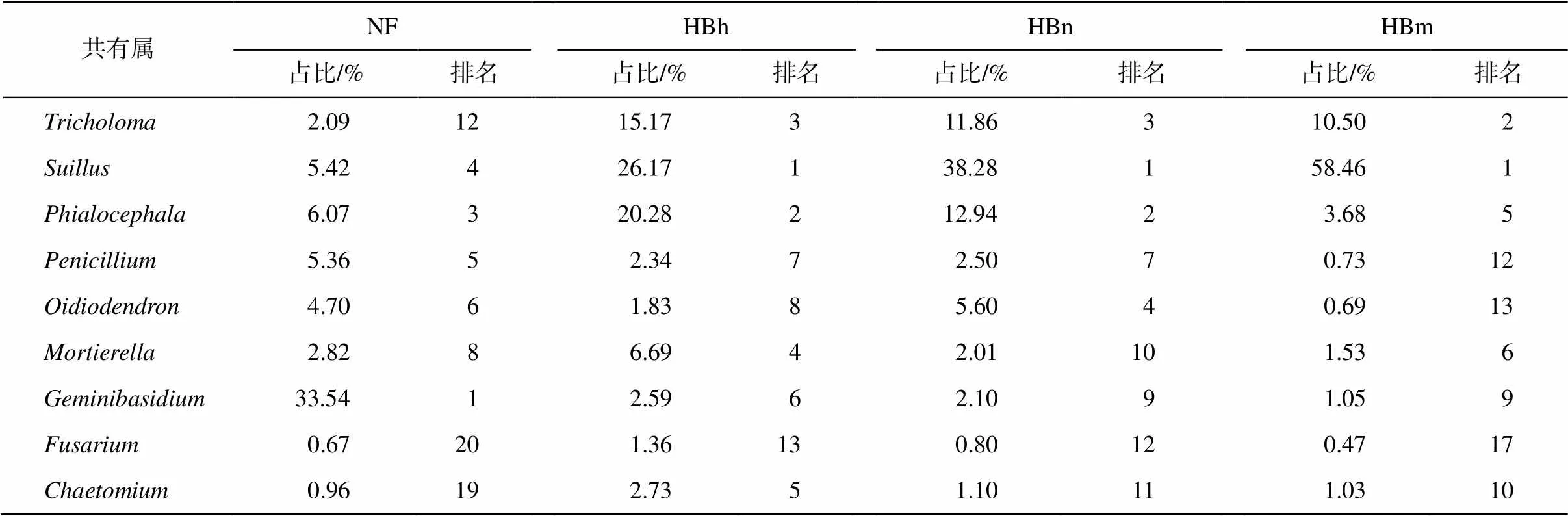
表4 呼伦贝尔沙地樟子松根内真菌Top 20属中共有属在各样地的占比
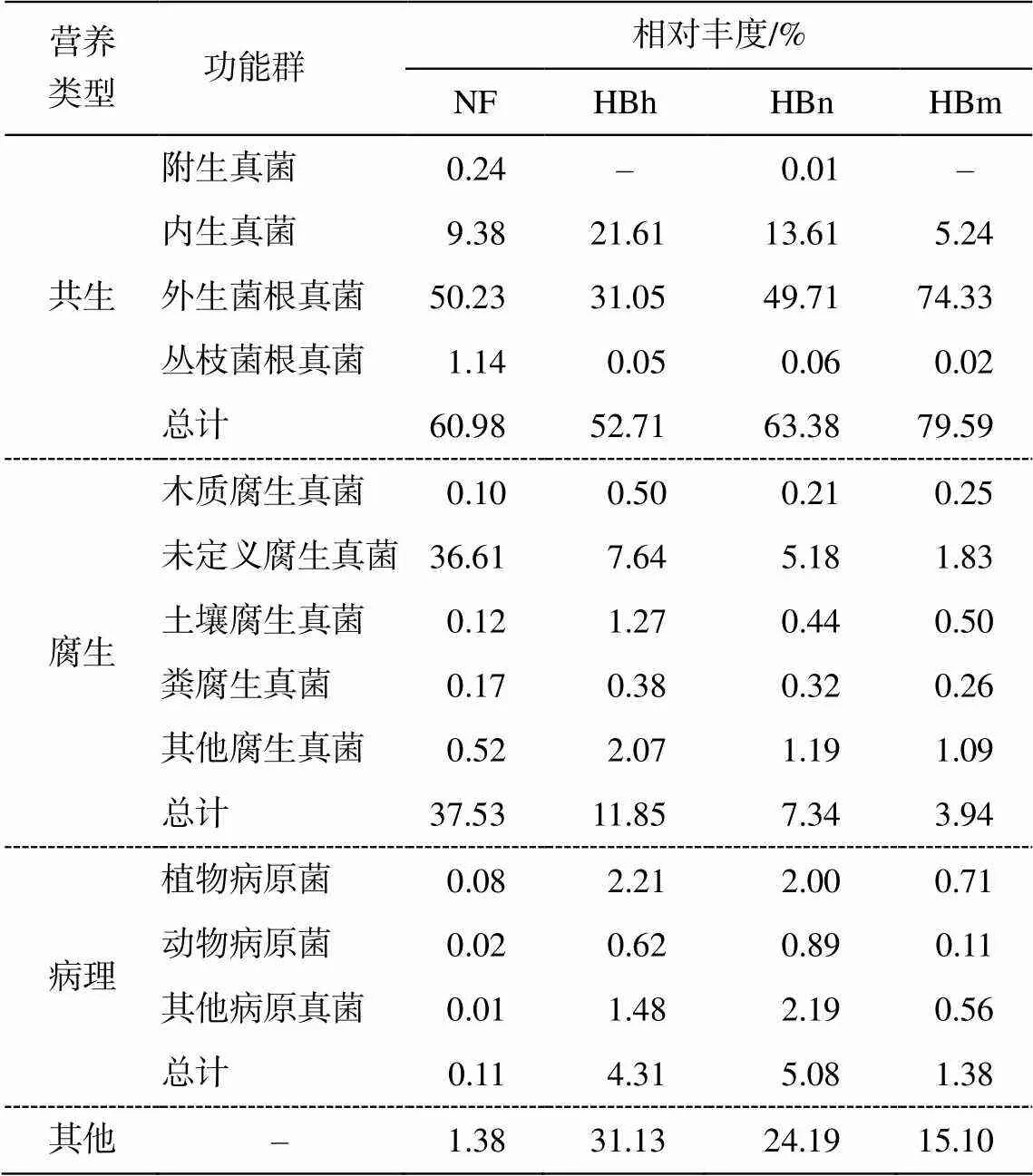
表5 呼伦贝尔沙地樟子松根内真菌功能分类与相对丰度
呼伦贝尔沙地樟子松林根尖样品中根内真菌相对丰度与生态功能群共存网络图(图 5)显示, 沙地樟子松天然林与人工林共有功能群有 20 个, 其中具有代表性的 7 个功能群如下: 1)外生菌根真菌群, 分类单元有乳牛肝菌属、红菇属()以及等; 2)未定义腐生菌群, 分类单元有、毛霉属()和双子担子菌属; 3)杜鹃菌根真菌群, 分类单元有、和; 4)外生菌根真菌–寄生菌群, 分类单元有口蘑属、、色钉菇属() 和等; 5)动物病原菌-未定义腐生菌群, 分类单元有棒状孢菌属()、和; 6)内生真菌群, 分类单元有、、和; 7)粪腐生-植物腐生-木腐生菌群, 分类单元有和。
独有功能群在各个样地中有所不同。在沙地樟子松天然林样本独有功能群中, 有外生菌根–未定义腐生–木腐生功能群中的; 叶片腐生–植物病原–未定义腐生–木腐生功能群中的和丝膜菌属()以及动物病原–植物病原–木腐生菌功能群中的。在沙地樟子松中龄林样本独有功能群中, 有真菌寄生–木腐生功能群中的和内生真菌–植物病原–木腐生功能群中的。在沙地樟子松近熟林样本独有功能群中, 有粪腐生–内生真菌–植物病原–未定义腐生功能群中的、动物病原–粪腐生–内生真菌–植物腐生–土壤腐生–木材腐生功能群中的以及真菌寄生功能群中的。在沙地樟子松成熟林样本独有功能群中, 有内生真菌–植物病原–未定义腐生功能群中的。
2.5 土壤理化性质对根内真菌多样性和营养型的影响
沙地樟子松根围土壤的理化性质如表6所示。天然林中土壤全氮含量、土壤含水量和速效钾含量显著低于人工林(<0.05)。土壤全氮含量、土壤含水量和速效钾含量在近熟林中最高, 分别为 0.7g/kg, 7.83%和 152.32mg/kg, 天然林最低, 为 0.14g/kg, 3.50%和 52.01mg/kg。天然林和成熟林土壤全磷含量显著低于中龄林和近熟林(<0.05), 中龄林和近熟林中最高, 为 0.23g/kg, 天然林中最低, 为0.05g/kg。但是, 有机质含量在天然林中最高, 并且显著高于人工林(<0.05), 为 6.50g/kg, 成熟林中最低, 为 1.52g/kg, 有机质含量随着林龄增长逐渐减小。研究样地内土壤均为弱酸性, 天然林 pH 值最高, 为 6.49, 人工林 pH 值随着林龄增长而增大。土壤含水量、全氮、速效磷和速效钾的含量均在近熟林中最高, 表明土壤养分含量随林龄增长而先上升后下降。
根系周围土壤理化性质与根内真菌多样性指数和根内真菌营养型相对丰度的相关性见表 7。根内真菌多样性与土壤理化性质均不存在显著相关性(>0.05), 腐生营养型真菌相对丰度与土壤有机质含量之间极显著正相关(<0.05), 病理营养型真菌相对丰度与土壤 pH 之间显著负相关(<0.05), 与土壤全磷含量之间显著正相关(<0.05)。不同样地根内真菌群落结构与环境因子的冗余分析(RDA)以及Top20 共有属与环境因子的冗余分析(RDA)结果显示, 天然林样本点受土壤理化因子的影响较小, 人工林样本点受土壤理化因子的影响较大(图 6(a)), 不同真菌属与土壤因子之间的相关性强弱不等(图6(b))。
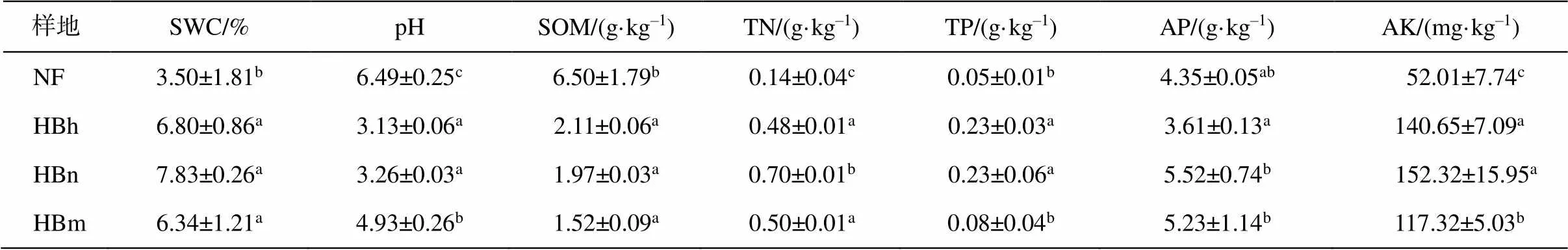
表6 沙地樟子松林土壤理化性质
注: pH为土壤pH值, SOM为土壤有机质含量, AP为土壤速效磷含量, AK为土壤速效钾含量。
3 讨论
3.1 呼伦贝尔沙地樟子松根内真菌群落结构
从呼伦贝尔沙地樟子松林天然林和人工林根内样品中共获得 520 个真菌 OTUs, 隶属 5 门 87 科 197属, 担子菌门和子囊菌门是构成沙地樟子松根内真菌的主要类群, 约占总数的 94%, 与华北落叶松()和白桦()等外生菌根依赖型树种的根内真菌群落组成[21,22]相似。子囊菌门和担子菌门是土壤中主要分解群落[23-24], 子囊菌门大多数为腐生菌, 可以分解难降解性有机质[25]; 担子菌门腐生或寄生, 在潮湿的土壤中分解木质纤维素[26]。沙地樟子松根内真菌群落结构随林龄增长出现动态变化, 这种根内真菌的自然演替现象在对山毛榉()和枫林()的研究中也有[27], 原因可能是沙地樟子松林中的土壤和植被等环境因素随林龄的增长逐渐发生改变, 最终造成真菌群落组成和结构的差异[19-28]。
呼伦贝尔沙地樟子松根内真菌群落类群丰富多样, 为典型的外生菌根真菌依赖型树种, 因此外生菌根真菌在天然林和人工林根内真菌中均占主导地位。天然林中相对丰度最高的是双子担子菌属, 其丰度与土壤含水量负相关。这是因为该菌具有较强的耐热和耐旱性[29], 能较好地适应天然林比人工林水分更匮乏的现象。人工林中乳牛肝菌属相对丰度最大, 其次为菌属。乳牛肝菌属是对针叶树种具有较高侵染特异性的外生菌根真菌之一, 是针叶树种重要的根际益生菌, 能够促进根系对磷元素和水分的吸收[30], 但在 RDA 分析结果中, 该菌属与土壤全磷含量之间没有表现出较强的相关性, 原因可能是外生菌根真菌与植物根部建立共生关系, 其受根部的影响大于土壤等非生物因素的影响[31]。菌属为深色有隔内生真菌, 常常定殖于植物根部, 与土壤全磷含量有较强的相关性, 可以促进植物对磷元素的吸收[32], 在中龄林中相对丰度最大, 在近熟林、天然林和成熟林中相对丰度依次减小。沙地樟子松根内真菌优势属在各个林分中的种类和占比不同, 可能是由于不同真菌的定植策略和资源需求各不相同, 并且植物在不同生长阶段对不同功能性真菌也存在不同程度的偏好。沙地樟子松林土壤营养物质贫乏[33], 中龄林和近熟林生长阶段需要吸收更多的营养物质来维持自身的生长需求, 因此其根系分泌物可能会吸引更多有利于植物吸收营养的真菌定植[34]。土壤理化因子与沙地樟子松根内真菌群落的多样性之间无显著相关性(>0.05), 成熟林根内真菌多样性指数显著低于沙地樟子松近熟林、中龄林和天然林(<0.05)。多样性产生差异的原因很多, 不同物种对周围环境具有不同的适合度, 选择过程导致不同物种间个体数量比例的差异[35], 进而影响生物多样性的分布格局。由于天然林的林龄结构复杂, 根内真菌趋于多样化, 真菌分布更为均匀, 菌群结构具有较高的稳定性, 并且抵御外界真菌侵染的能力更强。
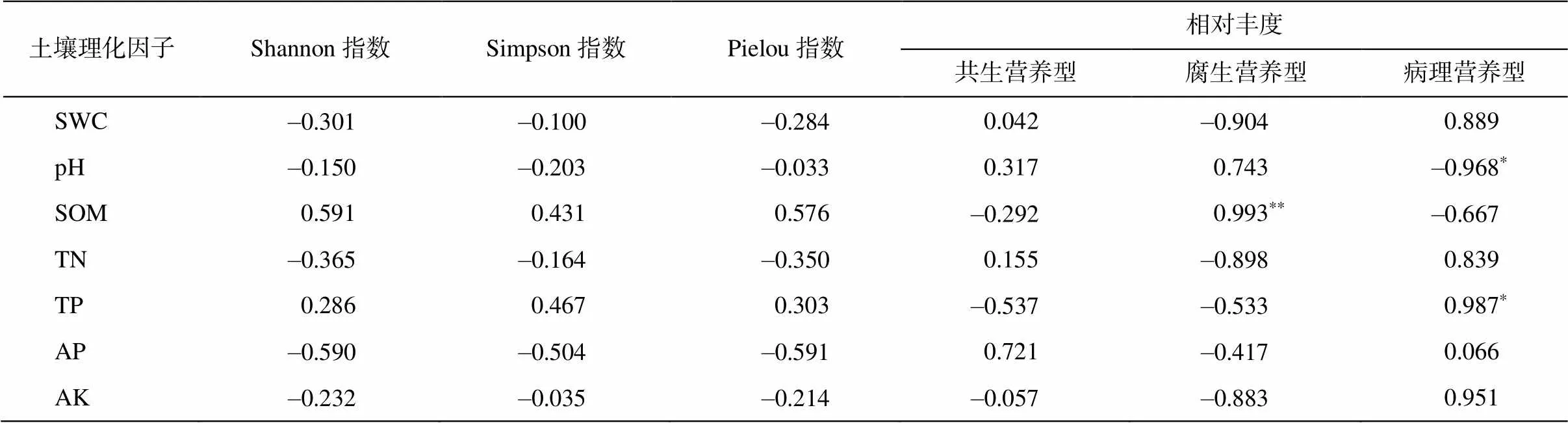
表7 沙地樟子松根内真菌多样性和营养型相对丰度与土壤理化性质的相关性
注: *表示相关性显著, **表示相关性极显著。
3.2 呼伦贝尔沙地樟子松根内真菌功能群特征
呼伦贝尔沙地樟子松根内真菌的营养模式主要分为病理营养型、腐生营养型和共生营养型 3 种, 共生营养型在沙地樟子松根内真菌中占据主导地位, 其次为腐生营养型。同种营养型的真菌在天然林及人工林各林龄之间出现不同的富集现象。其中, 腐生营养型真菌相对丰度与土壤有机质含量之间极显著正相关(<0.05)。土壤有机质是腐生营养型真菌主要养分来源[36], 受地表枯落物、根系分泌物及根系分解的影响[32], 沙地樟子松人工林土壤有机质含量随着林龄增长而逐渐减少, 腐生营养型真菌的相对丰度也随之减小, 同时共生营养型真菌随植物根部生长竞争优势逐渐增强[37]。有研究表明, 不同林龄结构下土壤真菌类群因植物根系和凋落物含量的不同而出现动态变化[19,38]。因此, 共生营养型真菌类群和腐生营养型真菌类群在沙地樟子松根内真菌中的占比极有可能受到植物根系和凋落物含量的共同影响[39]。病理营养型真菌相对丰度与土壤全磷含量显著正相关(<0.05), 与 pH 呈显著负相关(<0.05), 原因可能是磷元素参与病理营养型真菌多种生理过程和信号传导[40–41]对病理营养型真菌生长和繁殖至关重要, 并且病原真菌在低 pH 环境下更容易存活[42]。因此, 沙地樟子松根内真菌功能群结构的改变受到土壤 pH、有机质含量、土壤磷元素和植物生长情况等因素的共同影响, 但其相互关系需进一步研究。部分内生真菌会因环境不同表现出不同的生态策略[43], 甚至会出现多种生态策略共存的现象, 如外生菌根真菌群、外生菌根真菌–寄生菌群与粪腐生–植物腐生–木腐生功能群中的以及杜鹃菌根真菌群与外生菌根真菌–寄生菌功能群中的等, 这些真菌就表现出不同的生态策略。其中和在天然林中以外生菌根真菌的形式存在, 在人工林中却以植物病原菌的形式存在。则恰恰相反, 在天然林中以植物病原菌的形式存在, 但在人工林中以外生菌根真菌的形式存在。这个结果支持有些具复杂生活史的病原菌在不同宿主中常表现为不同的生态状态的观点[44]。同时, 我们在FUNGuild 解析结果中发现, 有些真菌在天然林中表现出较多的生态策略, 比如双子担子菌属在天然林中以内生真菌寄生菌、外生菌根真菌和粪腐生–木腐生菌群形式存在, 但在人工林中只以未定义腐生菌的形式存在, 这表明沙地樟子松天然林中真菌群落的生境较为复杂, 迫使真菌向其他营养型转变。随着林龄增长, 沙地樟子松人工林根内真菌功能群趋于单一化, 多样性逐渐减小, 也许是造成其衰退的原因之一。通过对沙地樟子松根内真菌群落结构与功能群特征的研究, 有助于深入理解沙地樟子松人工林衰退的微生物机制, 可以为森林抚育与经营提供理论依据。
4 结论
本文以呼伦贝尔沙地樟子松天然林和不同林龄人工林为研究对象, 采用野外调查和分子生物学相结合的方法, 通过对沙地樟子松根内真菌群落结构和功能群特征的鉴定分析,得到以下结论。
1)在呼伦贝尔沙地樟子松根尖样品中共获得520 个真菌 OTUs, 隶属 5 门 15 纲 48 目 87 科 197属。担子菌门和子囊菌门是构成沙地樟子松根内真菌的主要类群, 沙地樟子松天然林根内真菌优势属为双子担子菌属, 人工林为乳牛肝菌属、口蘑属和菌属。
2)呼伦贝尔沙地樟子松成熟林根内真菌多样性指数显著低于沙地樟子松近熟林、中龄林和天然林(<0.05)。与人工林相比, 天然林根内真菌趋于多样化, 真菌分布更均匀, 菌群结构具有较高的稳定性, 抵御外界真菌侵染的能力更强。
3) 呼伦贝尔沙地樟子松根内真菌的营养模式主要分为病理营养型、腐生营养型和共生营养型 3 种, 共生营养型在沙地樟子松根内真菌中占据主导地位, 其次为腐生营养型。天然林根内真菌群落的生境较为复杂, 真菌营养型存在转变现象, 且部分真菌在天然林中表现出较多样化的生态策略。
[1] 任悦, 高广磊, 张英, 等. 沙地樟子松人工林叶片–枯落物–土壤有机碳含量特征. 北京林业大学学报, 2018, 40(7): 36–44
[2] 宋立宁, 朱教君, 郑晓. 基于沙地樟子松人工林衰退机制的营林方案. 生态学杂志, 2017, 36(11): 257–264
[3] 刘新平, 何玉惠, 魏水莲, 等. 科尔沁沙地樟子松(var.a)生长对降水和温度的响应. 中国沙漠, 2016, 36(1): 57–63
[4] 代青格乐, 赵国平, 王新星, 等. 林分密度对毛乌素沙地樟子松人工林林分结构和林下植被的影响. 水土保持通报, 2015, 35(6): 86–91
[5] 曾泽群, 雷泽勇, 魏晓婷. 基于水分变化的沙地樟子松人工林土壤分层特征. 干旱区资源与环境, 2017, 31(12): 161–165
[6] Hagenbo A, Kyaschenko J, Clemmensen K E, et al. Fungal community shifts underpin declining mycelial production and turnover across achronosequence. Journal of Ecology, 2018, 106(2): 490–501
[7] 朱教君, 康宏樟, 许美玲, 等. 外生菌根真菌对科尔沁沙地樟子松人工林衰退的影响. 应用生态学报, 2007, 18(12): 2693–2698
[8] 宋旭红, 谭均, 李隆云, 等. Illumina 高通量测序揭示黄连根腐根际土壤真菌群落组成及多样性. 中草药, 2018, 49(22): 5396–5403
[9] 孙茜, 薛子可, 解琳琳, 等. 沙冬青及其伴生植物深色有隔内生真菌物种多样性. 植物生态学报, 2017, 41(7): 729–737
[10] 王文娟, 李景文, 王中斌, 等. 胡杨根际土壤真菌群落代谢特征及其土壤影响因子研究. 西北植物学报, 2017, 37(7): 1429–1437
[11] 郭米山, 高广磊, 丁国栋, 等. 呼伦贝尔沙地樟子松外生菌根真菌多样性. 菌物学报, 2018, 37(9): 1133–1142
[12] Collins C G, Carey C J, Aronson E L, et al. Direct and indirect effects of native range expansion on soil microbial community structure and function. Journal of Ecology, 2016, 104(5): 1271–1283
[13] 胡玉金, 高春梅, 刘杏忠, 等. 保护地黄瓜根内和土壤中丛枝菌根真菌和深色有隔内生真菌多样性研究. 菌物学报, 2017, 36(2): 164–176
[14] Cevallos S, Herrera P, Sanchez-Rodriguez A, et al. Untangling factors that drive community composition of root associated fungal endophytes of neotropical epiphytic orchids. Fungal Ecology, 2018, 34: 67–75
[15] 尹大川, 祁金玉, 宋瑞清. 复合接种褐环乳牛肝菌与绿木霉对樟子松根际土壤生物活性年际变化的影响. 生态学杂志, 2018, 37(9): 91–95
[16] 邓勋, 宋小双, 尹大川, 等. 深色有隔内生真菌与褐环乳牛肝菌双接种对樟子松生长及抗立枯病的影响. 中国森林病虫, 2017, 36(1): 21–25
[17] 鲍士旦. 土壤农化分析(第三版). 北京: 中国农业出版社, 2000
[18] Nguyen N H, Song Z, Bates S T, et al. FUNGuild: an open annotation tool for parsing fungal community datasets by ecological guild. Fungal Ecology, 2016, 20: 241–248
[19] Lucasborja M E. Unravelling the importance of forest age stand and forest structure driving microbiological soil properties, enzymatic activities and soil nutrients content in Mediterranean Spanish black pine (Ar. ssp.) Forest. Science of the Total Environment, 2016, 562: 145–154
[20] 郑欢, 张芝元, 韩燕峰, 等. 刺槐内生真菌群落组成及其生态功能结构分析. 菌物学报, 2018, 37(2): 256–263
[21] 杨岳, 闫伟, 魏杰. 黑里河和贺兰山自然保护区华北落叶松根区土壤中外生菌根真菌群落. 菌物学报, 2019, 38(1): 48–63
[22] 耿增超. 秦岭辛家山林区红桦外生菌根真菌多样性. 菌物学报, 2017, 36(7): 851–860
[23] Ma A Z, Zhuang X L, Wu J M, et al. Ascomycota members dominate fungal communities during straw residue decomposition in arable soil. PLOS ONE, 2013, 8(6): e661466
[24] Yille D J, Ralph J, Lu F C, et al. Evidence for cleavage of lignin by a brown rot basidiomycete. Environmental Microbiology, 2008, 10(7): 1844–1849
[25] Paungfoo-Lonhienne C, Yeoh Y K, Kasinadhuni N R P, et al. Nitrogen fertilizer dose alters fungal com-munities in sugarcane soil and rhizosphere. Scientific Reports, 2015, 5: 8678
[26] Tang Y S, Wang L, Jia J W, et al. Response of soil microbial community in Jiuduansha Wetland to diffe-rent successional stages and its implications for soil microbial respiration and carbon turnover. Soil Bilo-logy and Biochemistry, 2011, 43(1): 638–646
[27] Burke D, Lopez-Gutierrez J, Smemo K, et al. Vege-tation and soil environment influence the spatial dis-tribution of root-associated fungi in a mature beech-maple forest. Applied and Environmental Microbio-logy, 2009, 75(24): 7639–7648
[28] 李毳, 马转转, 乔沙沙, 等. 原位微宇宙法研究温带森林土壤真菌群落构建的驱动机制. 生态环境学报, 2018, 27(5): 811–817
[29] Nguyen H D T, Nickerson N L, Seifert K A. Basidioa-scus and Geminibasidium: a new lineage of heat-resistant and xerotolerant basidiomycetes. Mycologia, 2013, 105(5): 1231–1250
[30] Qi J, Song R, University N F, et al. Effects of Combined Inoculation withandon the Roots ofvar.in Northwest Liaoning Province. Scientia Silvae Sinicae, 2018, 54(5): 62–69
[31] Koyama A, Steinweg J M, Haddix M L, et al. Soil bacterial community responses to altered precipitation and temperature regimes in an old field grassland are mediated by plants. FEMS Microbiology Ecology, 2018, 94(1): 1–15
[32] Jumpponen A, Mattson K G, Trappe J M. Mycorrhizal functioning of Phialocephala fortinii withon glacier forefront soil: interactions with soil nitrogen and organic matter. Mycorrhiza, 1998, 7(5): 261–265
[33] 任悦, 高广磊, 丁国栋, 等. 沙地樟子松人工林叶片–枯落物–土壤氮磷化学计量特征. 应用生态学报, 2019, 30(3): 743–750
[34] 李娇, 蒋先敏, 尹华军, 等. 不同林龄云杉人工林的根系分泌物与土壤微生物. 应用生态学报, 2014, 25(2): 325–332
[35] Vellend M. Conceptual synthesis in community eco-logy. Quarterly Review of Biology, 2010, 85(2): 183–206
[36] Ulm F, Gouveia C, Dias T, et al. N fertilization in a Mediterranean ecosystem alters N and P turnover in soil, roots and the ectomycorrhizal community. Soil Biology and Biochemistry, 2017, 113: 60–70
[37] Bodeker I T, Lindahl B D, Olson A, et al. Mycorrhizal and saprotrophic fungal guilds compete for the same organic substrates but affect decomposition diffe-rently. Functional Ecology, 2016, 30(12): 1–12
[38] Millberg H, Boberg J, Stenlid J. Changes in fungal community of Scots pine () needles along a latitudinal gradient in Sweden. Fungal Eco-logy, 2015, 17: 126–139
[39] Kyaschenko J, Clemmensen K E, Hagenbo A, et al. Shift in fungal communities and associated enzyme activities along an age gradient of managedstands. The ISME Journal, 2017, 11(4): 863–874
[40] Mackay J E, Macdonald L M, Smernik R J, et al. Organic amendments as phosphorus fertilisers: che-mical analyses, biological processes and plant pup-take. Soil Biology and Biochemistry, 2017, 107: 50–59
[41] Schappe T, Albornoz F E, Turner B L, et al. The role of soil chemistry and plant neighbourhoods in struc-turing fungal communities in three Panamanian rain-forests. Journal of Ecology, 2017, 105(3): 569–579
[42] Niwa R, Kumei T, Nomura Y, et al. Increase in soil pH due to Ca-rich organic matter application causes suppression of the clubroot disease of crucifers. Soil Biology & Biochemistry, 2007, 39(3): 778–785
[43] Márquez S S, Bills G F, Herrero N, et al. Non-systemic fungal endophytes of grasses. Fungal Eco-logy, 2012, 5(3): 289–297
[44] Arnold A E, Lutzoni F. Diversity and host range of foliar fungal endophytes: are tropical leaves biodiver-sity hotspots?. Ecology, 2007, 88(3): 541–549
Community Structure and Functional Groups of Fungi in the Roots Associated withvar.in the Hulunbuir Sandy Land
WEI Xiaoshuai1, GUO Mishan1, GAO Guanglei1,2,†, REN Yue1, DING Guodong1,2, ZHANG Ying1
1. School of Soil and Water Conservation, Key Laboratory of State Forestry and Grassland Administration on Soil and Water Conservation, Beijing Forestry University, Beijing 100083; 2. Yanchi Ecology Research Station of the Mu Us Desert, Wuzhong 751500; † Corresponding author, E-mail: gaoguanglei@bjfu.edu.cn
To reveal the fungal community structure and functional groups in the roots associated withs, natural forest and different-aged plantations were analyzed using field investigation and molecular biotechnology in the Hulunbuir Sandy Land. 520 fungal OTUs were obtained from root tip samples of, and belonged to 197 genera, 87 families, 5 phyla.andhad higher relative abundances, accounted for 54.98% and 39.27% respectively. The dominant bacteria in natural forest were,and, whereas the dominant bacteria in plantation were,and. Further, the relative abundance of other bacteria fluctuated with the stand age. Thediversity index of fungi in the roots ofplantation decreased gradually with the increasing of stand age. Among the different stands, the fungal diversity in the roots of mature forest was significantly lower than that in near-mature and middle-aged plantations as well as natural forest (<0.05). Although the fungal community composition associated withnatural forest and plantations had stable variability, and near-mature forest is the closest to natural forest, natural forest and mature plantation obviously differed in the composition of fungal community. The proportion of symbiotic trophic fungi increased with the increasing of stand age. Conversely, the saprophytic and pathological trophic fungi decreased with the aging forest. The proportion of symbiotic trophic fungi in natural forest was similar with near-mature plantation, however saprophytic trophic fungi was the dominant type in natural forest. In the Hulunbuir Sandy Land, the fungal community in the root ofhas complex structure and diverse species. The main functional groups are ectomycorrhizal and undefined saprophytic fungi. Some fungi show different ecological strategies in different stands.
root fungi;var.; Hulunbuir Sandy Land; diversity; community structure; functional groups
10.13209/j.0479-8023.2020.040
国家重点研发计划(2018YFC0507101, 2016YFC0500802)、国家自然科学基金(31600583)和中央高校基本科研业务费专项资金(2017PT03)资助
2019–05–15;
2019–11–09

