桑葚果园中酿酒酵母的分离鉴定及特性研究
章之柱,尹金彦,孟洋,陈莉,卢红梅
(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025)
桑葚是桑科植物桑树的果穗,其口味香甜微酸,营养丰富,富含花青素、硒、VC、多糖、白藜芦醇等功效成分,具有十分重要的开发利用价值[1-2]。桑葚除了鲜食外,还可加工成果汁、果酒、果脯、酸奶和果醋等多种特色食品[3]。
将桑葚发酵制备成果酒,不仅能增加桑果的附加值,还能解决桑果的季节性过剩、不易储存等问题[4]。目前,桑葚酒的酿造通常是选用活性干酵母,缺乏专用的酵母。在酿造过程中,酵母菌通过代谢过程去影响桑葚酒的理化性质、风味、口感,进而决定桑葚酒的品质,因此,桑葚果酒酿造酵母的筛选具有十分重要的意义。曹倩雯等[5]从市售桑葚自然发酵后醪液中分离得到 42 株酵母,筛选出 1 株发酵性能良好、风味优良的酿酒酵母 JNB-14;颜雪辉[6]从桑葚鲜果、桑叶等原料纯化得到99株酵母菌,经过多级筛选得到能耐受14%的酒精和280 g/L糖,最高产酒精为10.6%,适合桑葚酒发酵的菌株SH1。酵母菌主要分布在偏酸性、含糖高环境中,特别是水果、蔬菜、及果园的土壤中[7],本实验从某桑葚果园土壤、桑叶、桑果中分离酵母菌,通过富集培养、纯化、TTC显色培养、酒精发酵等实验筛选出适宜酿造桑葚果酒的酵母菌,并对其进行相关特性研究,以期为其在桑葚果酒中的应用提供参考。
1 材料与方法
1.1 材料与试剂
桑葚、桑葚叶、土壤,均采集于贵州开阳某桑葚种植基地。活性干酵母BV818,安琪酵母股份公司;活性干酵母SELECTYS LA BAYANUS(SLB),烟台帝伯仕自酿机有限公司。
葡萄糖、酵母粉、蛋白胨、琼脂、wallerstein laboratory nutrient agar(WL)培养基、TTC培养基等生化试剂,上海博微生物科技有限公司;焦亚硫酸钠,烟台帝伯仕自酿机有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
YXQ-LS-5DS11立式压力蒸汽灭菌器、SN-CJ-IF洁净工作台,上海博讯实业有限公司医疗设备厂;SPX-250B智能型生化培养箱,上海琅玕实验设备有限公司;722S可见分光光度计,上海菁华科技仪器有限公司。
1.3 实验方法
1.3.1 酵母菌的分离、纯化
样品处理:取5 g土样于无菌试剂瓶,用无菌蒸馏水制成不同质量浓度梯度土壤悬液。取5 g研细桑叶于无菌试剂瓶,用无菌蒸馏水制成不同浓度梯度桑叶悬液。将桑果破碎,取5 mL浆液于无菌试剂瓶,用无菌蒸馏水制成不同浓度梯度桑果浆液[8]。
增殖培养:取0.2 mL不同浓度梯度的桑果浆液、土壤悬液以及桑叶悬液,均匀涂布于酵母浸出胨肽葡萄糖培养基(yeast extract peptone dextrose medium,YPD),28 ℃恒温生化培养箱中培养72 h。
分离纯化:挑选能够在YPD上长出来的菌落,初步为酵母菌。在YPD上涂布划线培养,进一步分离纯化酵母菌,28 ℃恒温生化培养箱中72 h。通过观察菌落的形态和颜色,进行酵母菌株的初步筛选。对所得的酵母菌进行编号和保藏。
1.3.2 酵母菌初筛
TTC显色实验:将纯化菌接入TTC上层培养基,28 ℃培养48 h,再在其上覆盖一层TTC上层培养基,将其28 ℃培养3 h,观察菌落颜色[9]。产酒精能力越强,菌落红色越深。选取深紫色菌株进行产气实验。
产气实验:将颜色深的菌株制成菌悬液,以 5%的接种量接种至带有杜氏小管的试管中,YPD液体培养基静置培养,每隔 2 h观察杜氏小管内气体的含量,并记录。淘汰产气少或不产气的菌株,选出发酵快、产气多的菌株进行复筛。
1.3.3 酵母菌复筛
产酒降糖能力筛选:将初筛得到的菌制成菌悬液,按5%的接种量接种到YPD液体培养基,28 ℃培养8 d,参照GB 5009.225—2016《酒中乙醇测定》、GB 5009.7—2016《食品中还原糖测定》测发酵液酒精度和还原糖含量。选取产酒高残糖低的菌进行下一步筛选。
WL培养分类:将初筛得到的菌接株接种在WL平板,28 ℃倒置培养8 d,观察菌落形态与颜色,参考文献[10],进行初步分类鉴定。
1.3.4 产酒酵母菌的分子生物学鉴定
分子生物学鉴定:将获得的目的菌株纯化送四川擎科梓熙生物技术有限公司测序。以NL1(5′-GCATATCAATAAGCGGAGGAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)为引物测定酵母菌26S rDNA 的D1/D2可变区序列。
系统发育树的构建:用基本局部比对搜索工具(basic local alignment search tool,BLAST)将测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中与已知酵母菌的26S rDNA基因序列进行同源性分析,并用MEGA5.10软件的邻接法(Neighbor-Joining),构建系统发育树,具体确定菌株的种属。
1.3.5 酵母菌发酵特性研究
菌种活化。将分离得到的菌株接种于YPD液体培养基中,28 ℃培养24 h,得到酵母菌悬液。
生长曲线测定。取菌悬液,按5%的接种量接种于含有无菌YPD液态培养基锥形瓶中,并放置在28 ℃、150 r/min的恒温振荡器内培养。做3个平行,以YPD液体培养基为空白,每隔2 h取出培养液,测定培养液OD600值,绘制生长曲线[11]。
最适生长温度测定。按5%的接种量接种于含有无菌YPD液态培养基锥形瓶中,150 r/min的恒温振荡器内培养。培养温度分别设置为26、28、30、32、34、37 ℃。做3个平行,以YPD液体培养基为空白,培养30 h取出培养液,测定培养液OD600值,记录数据。
适宜生长pH的测定。取菌悬液,按5%接种量分别接入pH 2.5、3.5、4.5、5.5和6.5的YPD培养基中,最适温度培养30 h,测定培养液OD600值,确定其适宜pH值。
SO2耐受性能测定。取菌悬液,按5%的接种量接种于无菌YPD液态培养基锥形瓶中,加入除菌的焦亚硫酸钾调节培养基中SO2浓度,使其终浓度分别为50、100、200、400、600、800 mg/L,最适温度下培养30 h。做3个平行,以YPD液体培养基为空白,测定培养液OD600值,记录数据。分析所选酵母菌对SO2的耐受性[12]。
乙醇耐受性能测定。取菌悬液,按5%的接种量分别接种于添加无水乙醇体积分数为6%、8%、10%、12%、14%的无菌YPD液态培养基锥形瓶中,在最适温度下培养30 h。做3个平行,以YPD液体培养基为空白,测定培养液OD600值。
1.3.6 酿酒酵母酿造桑葚果酒挥发性风味物质分析
桑葚果酒的酿造。将新鲜桑葚榨汁过滤,用蔗糖调糖度为22 °Brix,75 ℃巴氏杀菌15 min加入质量浓度为80 mg/L的偏重亚硫酸钾,5%接种量在最适生长温度恒温发酵7 d[4-5]。同时,用安琪酿酒酵母BV818和帝伯仕SLB作对比。利用顶空固相微萃取-气质联用方法分析桑葚酒的风味成分。固相微萃取:取5 mL样品置于20 mL顶空瓶中,加入2-辛醇作内标,将老化后的50/30 μmCAR/PDMS/DVB萃取头插入样品瓶顶空部分,于45 ℃吸附30 min,吸附后的萃取头取出后插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器采集数据。GC条件:色谱柱为DB-WAX, 30 m×0.25 mm×0.25 μm,柱温:起始温度 40 ℃,保持 3 min,然后以 5 ℃/min 升至100 ℃,再以 10 ℃/min 升至 230 ℃,保持 6 min;载气氦气;流速0.8 mL/min;进样口温度250 ℃。MS 条件:电离方式为EI+,电子能量 70 eV,接口温度 250 ℃,离子源温度 200 ℃,检测器电压1 000 V。通过计算机检索与NIST 14 Library相匹配,选择较高匹配度的检索结果确认检测物成分。各化合物的相对含量根据内标物2-辛醇利用归一化法进行计算得到。
1.3.7 数据处理与分析
所得数据通过Office 2007,SigmaPlot 14.0、Design-Expert、SPSS 22.0等软件进行处理,作图。
2 结果与分析
2.1 酵母菌的分离纯化及初筛
经过增值培养,分离纯化,从桑叶、桑果、土壤中中共筛选得到74株疑似酵母菌株,编号为Y1~Y74。
74株纯化的菌株进行TTC显色反应,其中11株呈深红色,22株呈红色,22株显浅红色,其余不变色。将11株深红色菌进行产气实验,其结果见表1。由表1可知,菌株Y1、Y2、Y8、Y22、Y39、Y41产气时间较早,均在6 h内开始产气;菌株Y1、Y8、Y41、Y42产气较快,在培养了16 h后气体充满了杜式小管。综合起始产气时间、小管满气时间,选择菌株Y1、Y2、Y8、Y22、Y39、Y41、Y42进行复筛。
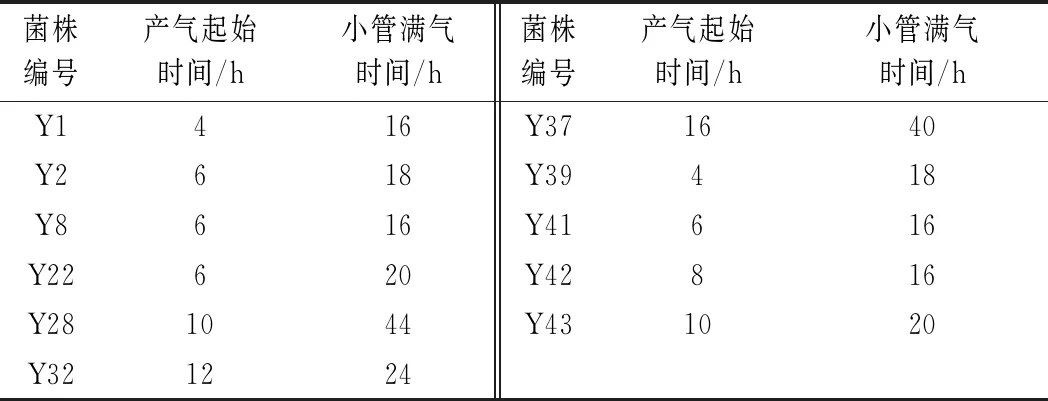
表1 产气实验结果Table 1 Result of product gas experiments
2.2 酵母菌的复筛结果
初筛得到的菌株YPD液体培养7 d后,测发酵液中乙醇和还原糖含量,由图1可知,菌株Y2、Y8、Y39产酒精能力很好,均超过10%vol,培养基利用率高,残余还原糖含量低,分别为1.3、 1.3、 1.4 g/L。将初筛选到的7株菌进行WL培养,菌株WL培养分类结果如表2所示。参照文献杨雪峰等[10]对菌落形态和颜色进行描述,将其分为5类。

图1 不同菌株产酒精能力和糖消耗能力Fig.1 Alcohol production capacity and sugar consumption capacity of different strains

表2 酵母菌株WL菌落形态描述Table 2 The description of yeast species on WL medium
酵母菌株的WL培养特征如图2所示。根据杨雪峰等[10]的研究,毕赤酵母呈白色带淡绿色、表面粗糙有褶皱、中央有火山状凸起,观察到菌株Y1外表粗糙、有明显褶皱、中间乳白色、四周灰绿色、有锥形突起,初步判定Y1为毕赤酵母;酿酒酵母的形态特征为奶油色带绿色、有球状突起、光滑不透明,菌株Y2表面光滑不透明、中间呈淡绿色、四周淡黄色,菌株Y41与Y42边缘为奶油状、中间翠绿色、有球状突起,初步判定Y2、Y41、Y42为酿酒酵母;假丝酵母的形态特征为表面光滑、中央乳白色、边缘绿色,菌株Y8、Y22和Y39菌落光滑、呈乳白色、边缘带有淡绿色或有菌丝,初步判定菌株Y8、Y22和Y39为假丝酵母。结合发酵特性,选择产酒能力好的菌株Y2进行鉴定。
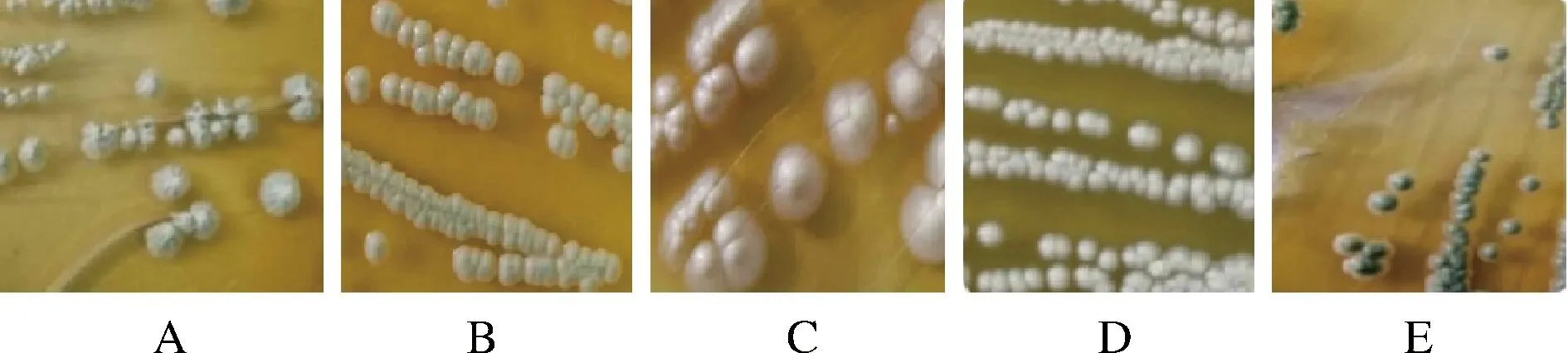
A-Y1;B-Y2;C-Y8、Y22;D-Y39;E-Y41、Y42图2 酵母菌株在WL培养基上的菌落特征Fig.2 Colony morphotypes of yeast species on WL medium
2.3 酵母菌的分子生物学鉴定结果
菌株Y2 26S rDNA D1/D2区的扩增产物条带如图3-a所示。目的条带清晰无杂带,片段大小在500 bp左右。将测序所得的酵母菌Y2的 26S rDNA D1/D2序列输入NCBI进行BLAST同源比对。结果显示,菌株Y2与酿酒酵母SaccharomycescerevisiaeA57同源性最高,达到100%。将菌株Y2 与NCBI数据库中已知酵母进行序列比对,并构建系统发育树(图3-b)。从系统发育树来看,菌株Y2与酿酒酵母的亲缘关系最近。结合其形态学特点,该菌为酿酒酵母Saccharomycescerevisiae。

a-电泳图;b-系统发育树图3 菌株26S rDNA D1/D2序列扩增产物琼脂糖凝胶电泳图和Neighbor-Joining法绘制的系统发育树Fig.3 Agarose gel electrophoretogram of Y2 strain 26S rDNA D1/D2 sequences amplifying product and the phylogenetic tree by Neighbor-Joining
2.4 产酒酵母菌的发酵特性
2.4.1 菌株Y2的生长曲线测定
以时间为横坐标,菌液OD600为纵坐标,绘制菌株Y2生长曲线(图4)。由图4可知,在0~2 h内,菌体数量增长缓慢,为延迟期;在2~10 h内,菌液OD600值迅速增加,为对数期;而10~40 h增长变得缓慢,为稳定期;40 h后菌液OD600值几乎保持稳定不变,达到最大值,菌株Y2生长停滞,进入衰亡期。

图4 菌株Y2的生长曲线Fig.4 Growth curve of strain Y2
2.4.2 pH和温度对菌株Y2生长的影响
发酵过程中,酵母菌需要在一个适宜的条件下才能获得最佳生长,提高生产效率。pH、温度、乙醇、糖度、SO2等都影响菌的生长。由图5-a可知,培养基中pH从2.5增大到3.5时,菌液OD600随pH增大而上升;而当pH>3.5后,出现下降趋势。在pH为3.5时,菌液OD600达到最大值,菌株Y2生长得最好,说明其最适pH为3.5。同时,可以看出,当pH<3.5时,pH对菌株生长影响较大;相比之下在3.5~6.5时,pH变化对菌生长影响较小。温度对酵母菌Y2生长的影响如图5-b所示,随着培养温度的增加,菌液的OD600值呈现先增加后下降的趋势,当培养温度为28 ℃ 时,菌液OD600值达到最大;继续升高培养温度,菌液OD600值随培养温度的升高而逐渐减小,故28 ℃为菌株Y2最适生长温度。
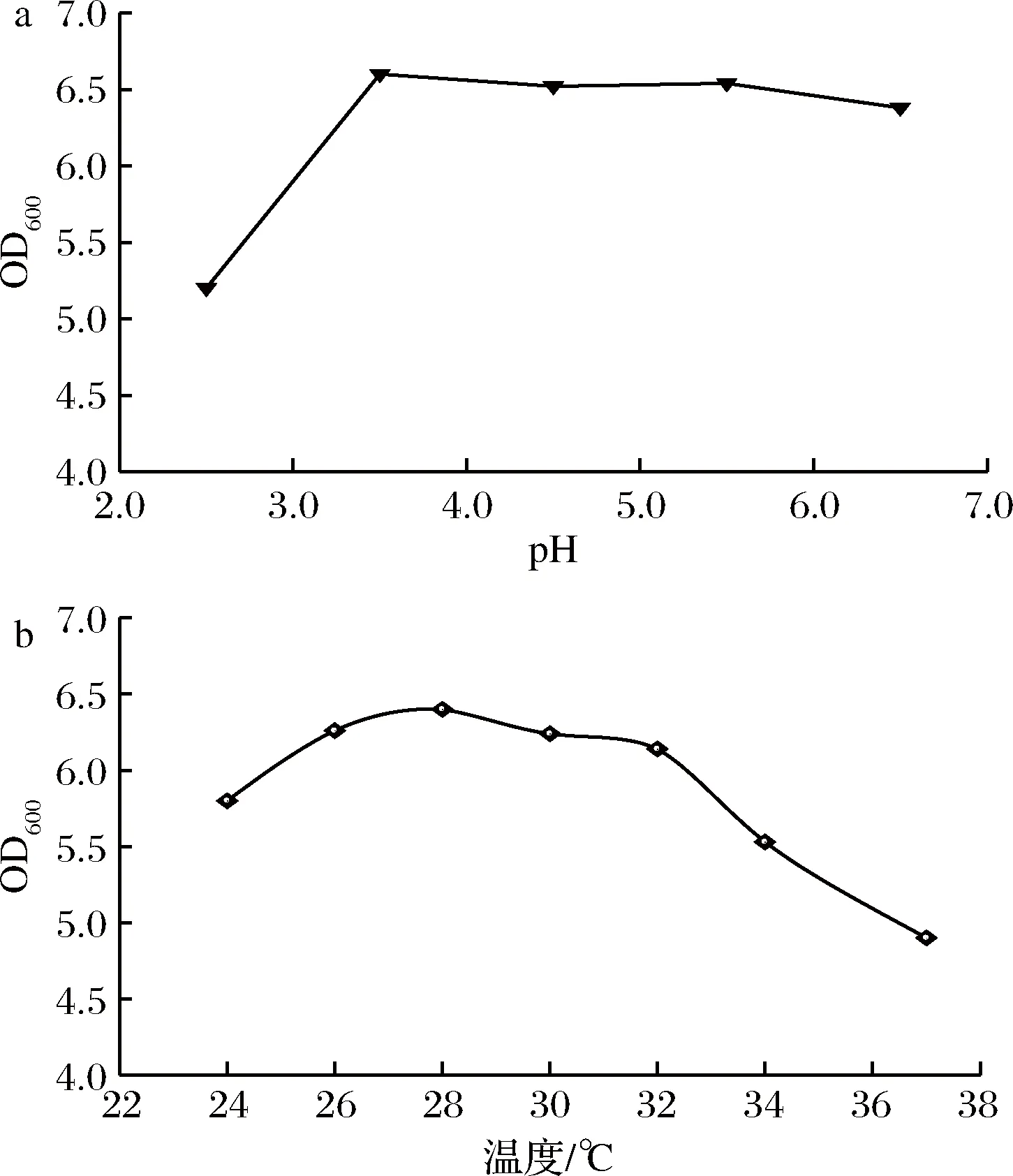
a-pH; b-温度图5 pH和温度对菌株Y2生长的影响Fig.5 Effects of pH and temperature on the growth of strain Y2
2.4.3 菌株Y2耐受性研究
根据行业标准NY/T1508—2017《绿色食品 果酒》中规定果酒的酒精度为7%vol~18%vol。果酒的发酵菌株需要对酒精度具有较高的耐受性,才能够生产出符合标准的产品。菌株Y2乙醇耐受性如图6-a所示。随着乙醇体积分数增大,菌液OD600逐渐减小。当乙醇体积分数为6%、8%、10%时,菌株Y2仍然能够较好生长,达到一定OD600;而乙醇体积分数为12%、14%,菌株被明显抑制。说明菌株Y2最高能耐受约12%的乙醇。
果酒生产中常常添加SO2来抑制杂菌的生长和繁殖,保证主要生产菌株的发酵优势[13]。NY/T1508—2017规定的果酒中SO2最高添加量为400 mg/L。菌株Y2在不同质量浓度SO2条件下的生长情况如图6-b所示。由图6可知,随着SO2质量浓度增大,菌液OD600逐渐减小。说明SO2质量浓度越大,对菌株Y2的抑制作用越强。当SO2质量浓度为800 mg/L时,菌株Y2仍然可以生长,表明菌株Y2具有较强的耐SO2能力。
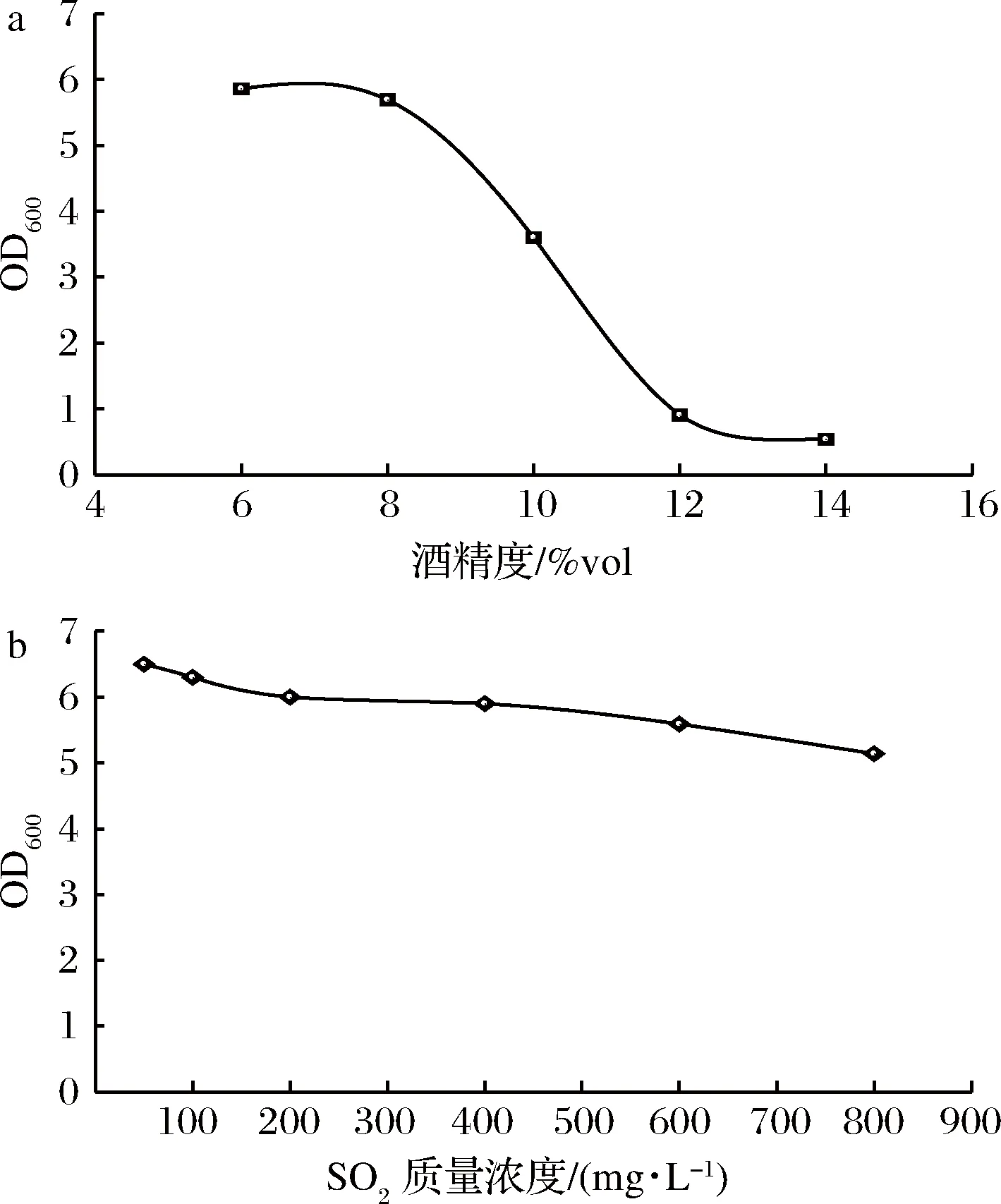
a-酒精度;b-SO2图6 菌株Y2对酒精度和SO2的耐受性Fig.6 Ethanol and SO2 tolerances of strain Y2
2.4.4 菌株发酵桑葚酒挥发性风味物质分析
挥发性风味物质是评价果酒品质的重要指标[4]。采用顶空固相微萃取-气质联用方法对3株酵母发酵的桑葚酒进行风味物质检测和分析,比较菌株Y2与酿酒酵母SLB、BV818的差异。不同菌株发酵桑葚酒风味物质相对含量如表3所示。
由表3可知,3株酵母发酵的桑葚酒中共检出79种挥发性风味物质,包括酯类26种、醇类17种、酸类11种、酮类9种、醛类8种、其他8种。菌株Y2发酵桑葚酒中检测出风味物质56种,BV818为52种,SLB为 53种,三者共有风味物质32种,占总风味组分的40.51%。
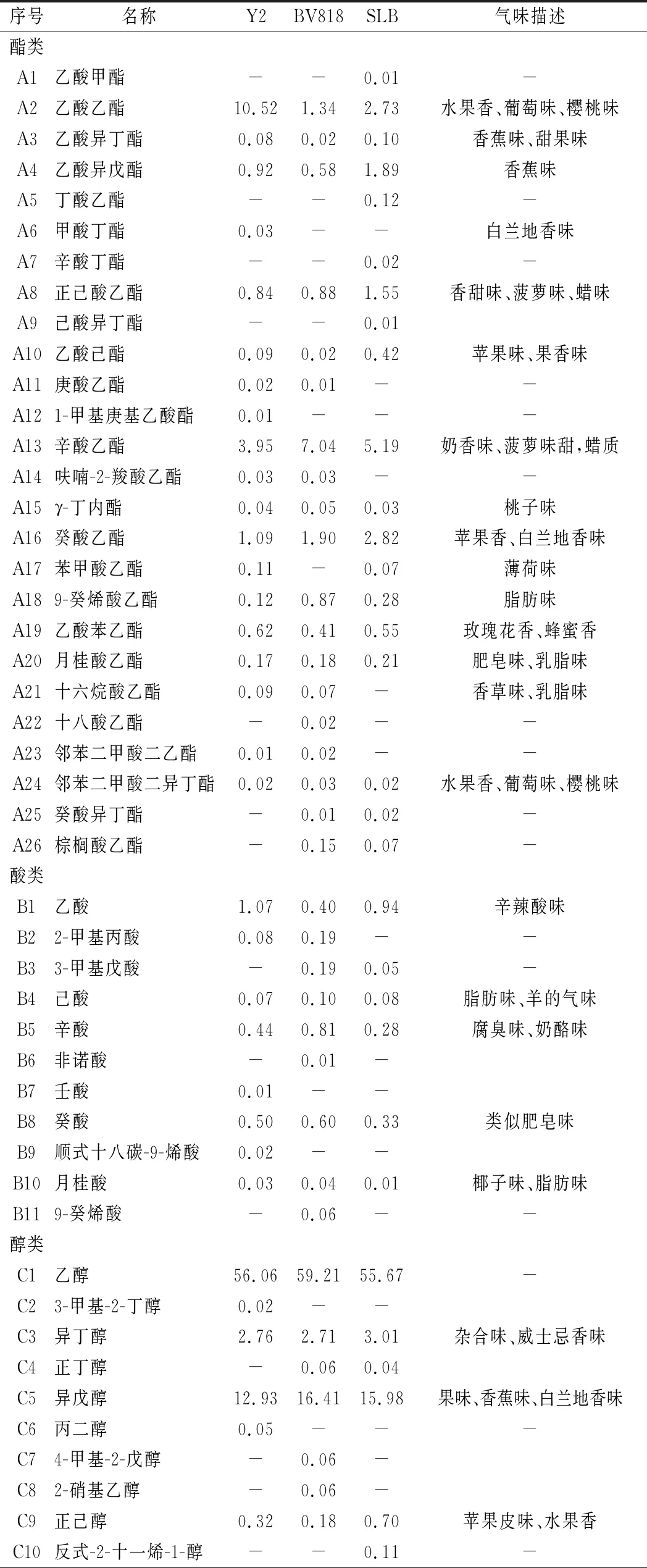
表3 不同菌株发酵桑葚酒挥发性风味物质相对含量 单位:%
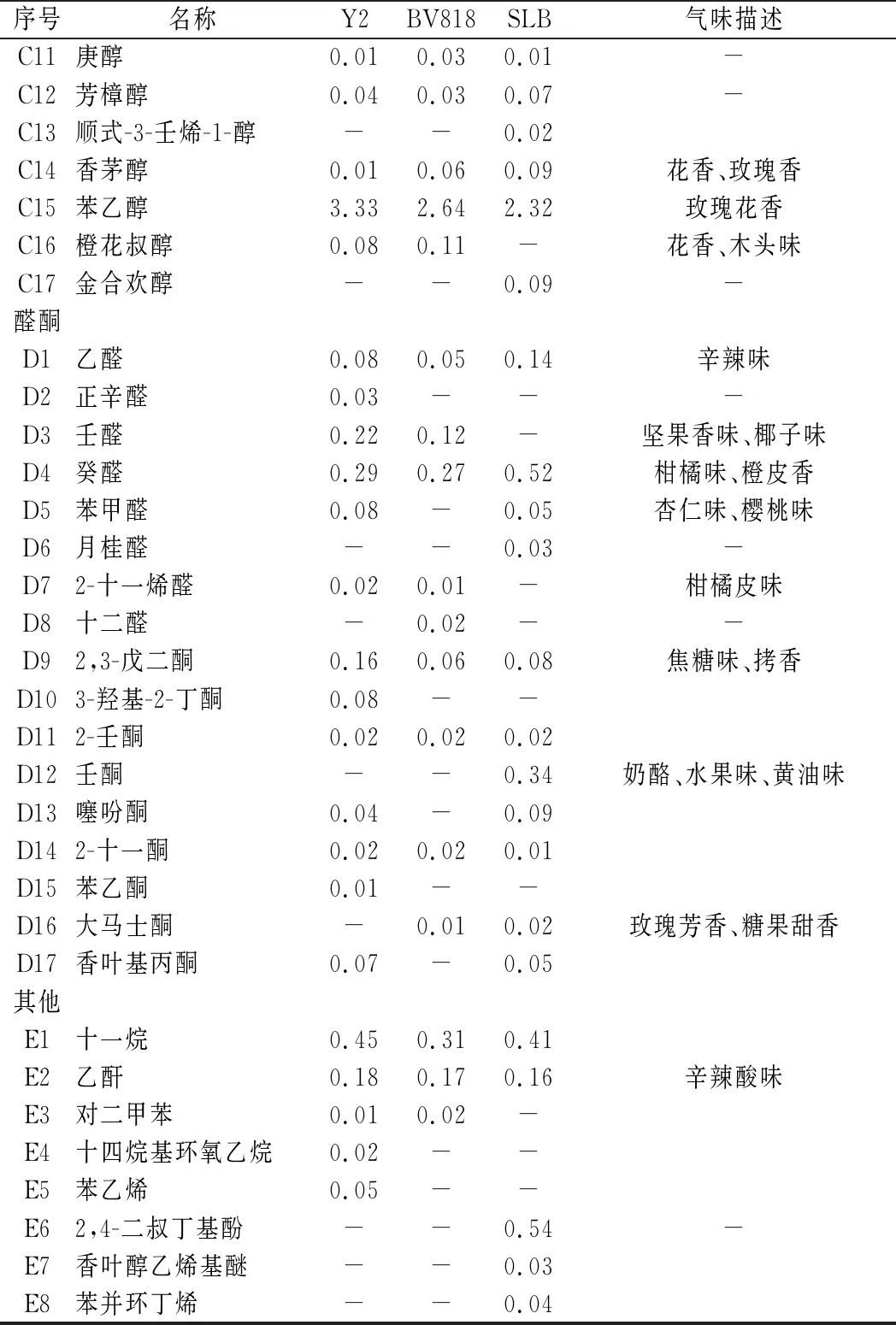
续表3
将3株酵母发酵的桑葚酒风味物质用SPSS 22.0 进行主成分分析。由表4可知,主成分1的贡献率为57.656%,主成分2贡献率为42.344%,能代表风味物质特征。
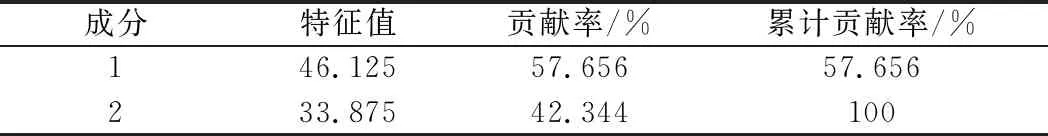
表4 主成分的特征值和贡献率Table 4 Eigenvalues of principal components and their contribution to total variance
不同菌株酿造桑葚酒挥发性风味物质主成分分析如图7所示。由图7-a可知,第1主成分主要与乙酸异戊酯(A4)、乙酸己酯(A10)、辛酸丁酯(A7)、己酸异丁酯(A9)等酯类成显著正相关,与月桂酸(B10)、橙花叔醇(C16)、对二甲苯(E3)等成显著负相关;第2主成分主要与乙酸苯乙酯(A19)、乙酸(B1)、苯甲醛(D5)等成显著正相关,与辛酸乙酯(A13)、正丁醇(C4)、异戊醇(C5)等成显著负相关。从图7-b不同菌株发酵桑葚酒得分图可知菌株Y2、BV818发酵桑葚酒与第1主成分有很高的负相关,菌株SLB发酵桑葚酒与第1主成分有很高的正相关;而菌株Y2发酵桑葚酒与第2主成分呈很高的正相关,菌株SLB、BV818发酵桑葚酒与第2主成分呈负相关。3株菌分布在不同的象限,反映出3种菌株发酵桑葚酒风味的差异与特点。
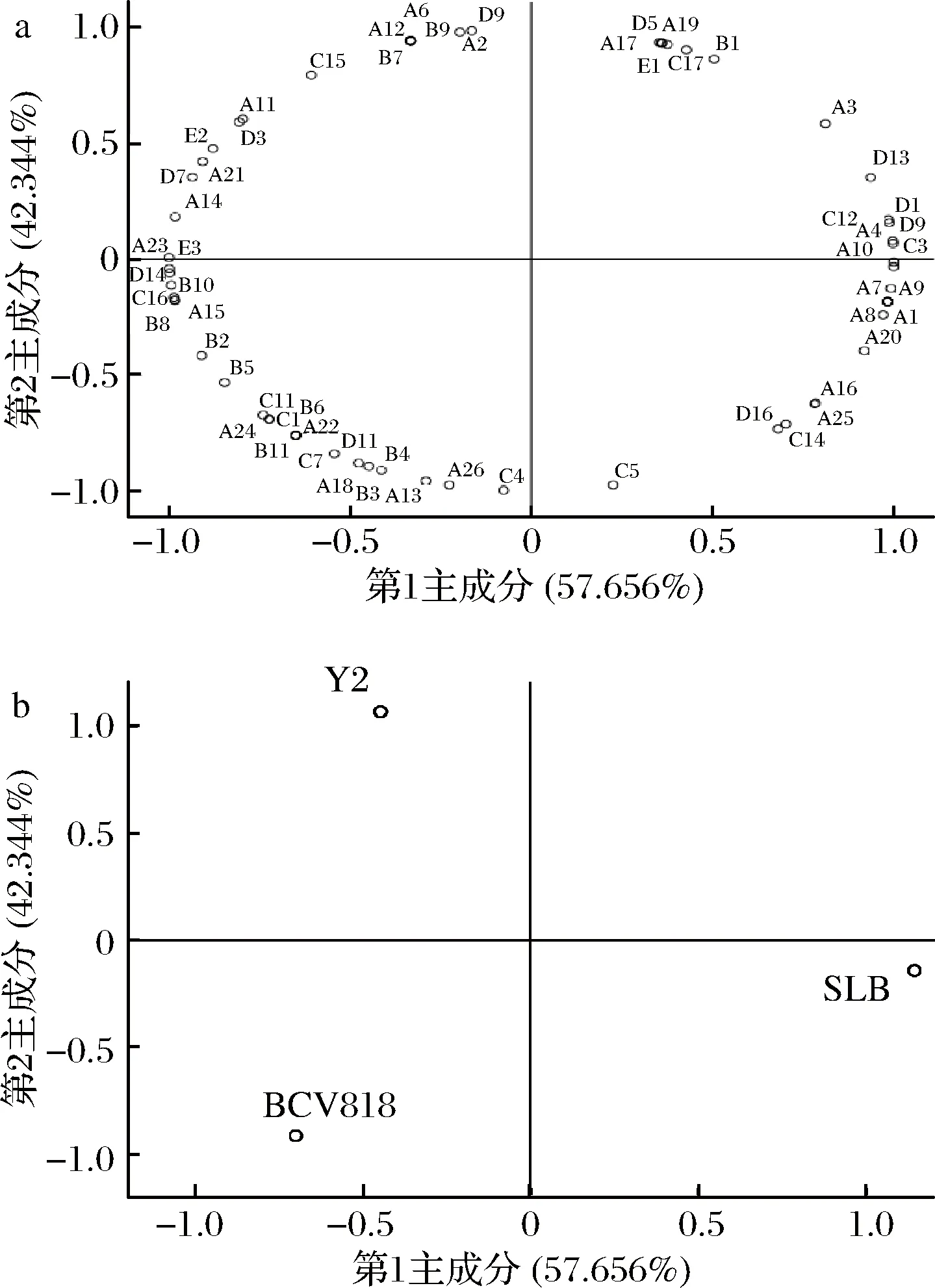
a-载荷图;b-得分图图7 桑葚酒挥发性风味物质主成分分析图Fig.7 PCA of the flavor components in mulberry wine
不同酵母发酵的桑葚酒中各类风味物质含量如图8所示。3种桑葚酒中各类风味物质相对含量从高到底依次为醇类、酯类、酸类、酮醛类、其他。酯类、醇类、酸类、醛类、酮类等风味物质的含量和比例赋予了果酒独具特色的香气和风格。

图8 不同酵母发酵桑葚酒各类风味物质相对含量Fig.8 Relative contents of various flavor substances in mulberry wine fermented by different yeasts
菌株Y2、SLB、BV818发酵桑葚酒中醇类物质含量分别为75.60%、78.11%、81.55%,是桑葚酒中的主要香气成分。不同菌株发酵桑葚酒中醇类物质含量较高的物质均为乙醇、异戊醇、异丁醇、苯乙醇。异戊醇赋予桑葚酒浓郁的果香、花香、略带辛辣的白兰地酒香味;异丁醇具有杂醇味、威士忌香味;苯乙醇则具有玫瑰花香,它们使得桑葚酒风味浓郁优雅、层次丰富[14]。
菌株Y2、SLB、BV818发酵桑葚酒中酯类物质含量分别为18.74%、16.11%、13.61%,酯类物质来自于发酵过程中醇类和酰基辅酶A的缩合反应,通常赋予果酒新鲜的水果香味[15]。3株酵母发酵的桑葚酒中酯类的种类和含量差异显著。菌株Y2中乙酸乙酯含量最高,其次是辛酸乙酯、癸酸乙酯;BV818和SLB中含量最高的则是辛酸乙酯、其次是癸酸乙酯、乙酸乙酯。乙酸乙酯和癸酸乙酯具有令人愉快的果香味,乙酸乙酯带有樱桃味、葡萄味,癸酸乙酯则具有草莓味[16]。辛酸乙酯赋予桑葚酒奶香、甜香、腊味。桑葚酒风味不仅受单一的酯类物质含量影响,还与各种酯类的累加效应有关[17]。3种酵母发酵桑葚酒产生不同种类和含量的酯类物质,使得3种桑葚酒酒体果香各异,风格突出。
菌株Y2、SLB、BV818发酵桑葚酒中酸类物质含量分别为2.21%、1.69%、2.39%。酸类物质在果酒中常常起到平衡、协调其他香味的作用。3种桑葚酒中酸类物质含量较高的成分是乙酸、辛酸和癸酸。菌株Y2、SLB发酵的桑葚酒中含量最高酸类物质的是乙酸,BV818则是辛酸。乙酸在果酒中呈辛辣味、辛酸和癸酸分别带有脂肪味、肥皂味[18]。酸类含量少时,桑葚酒清淡味短,而含量过高时则酒体粗糙浓烈,适宜的酸含量对桑葚酒主体风味很重要[19]。
菌株Y2、SLB、BV818发酵桑葚酒中醛酮及其他类风味物质含量很低,均<1%,但对桑葚酒风味也有一定的贡献。乙醛、癸醛、2,3-戊二酮、乙酐、2-壬酮等为菌株Y2、SLB、BV818发酵桑葚酒中共有的物质,正辛醛、苯甲醛、苯乙酮、苯乙烯为菌株Y2产生的特有风味物质。其中2,3-戊二酮带有焦糖味、烤香味;乙醛、乙酐具有辛辣味;苯甲醛则带有杏仁味、坚果香[20]。
3 结论
理想的桑葚酒酵母,需要良好的发酵性能,较强的耐受能力,协调丰富的产香性能。本研究从桑葚基地土壤、桑叶、桑果中分离筛选出74株酵母。通过发酵性能和耐受性筛选得到1株酵母菌株Y2。经WL培养及26S rDNA序列分析,鉴定其为酿酒酵母Saccharomycescerevisiae。
菌株Y2最适培养温度为28 ℃,最适pH为 3.5,在体积分数12%乙醇和质量浓度800 mg/L SO2条件下仍然可以保持良好的生长。摇床培养32 h到达最大生长浓度,40 h后开始进入衰亡期。
菌株Y2发酵桑葚酒挥发性风味物质与商业酿酒酵母BV818、SLB相比各具特色,经主成分分析发现3种桑葚酒分布在不同区域,风格各异。菌株Y2发酵桑葚酒风味物质种类比BV818、SLB分别多4种、3种。从相对含量来讲,菌株Y2发酵桑葚酒醇类物质分别比BV818、SLB低2.51%、5.95%;而酯类物质比BV818、SLB高2.63%、5.13%;酸类物质比BV818高0.52%、比SLB低0.18%。与BV818、SLB 2株商业酿酒酵母相比,菌株Y2产醇能力相近,产酯能力较优,产酸能力适中。酯类物质多带有水果、花香,且阈值较低,相互作用能产生特殊风味,菌株Y2发酵桑葚酒风味也更加优良,香气更加馥郁。
在本实验基础上,后续研究将进行桑葚酒发酵条件优化与探索,为桑葚酒产品开发奠定理论基础,进而促进桑葚酒品质的提升及品类的丰富。

