过表达pls基因结合前体流加提高小白链霉菌ε-聚赖氨酸产量
汪泽,王开方,胡扬帆,毛忠贵,陈旭升*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是于1977年在小白链霉菌(Streptomycesalbulus)培养液中发现的一种同型氨基酸聚合物,其分子结构是由25~35个L-赖氨酸单体通过ε-氨基和α-羧基脱水缩合而成[1]。因其能在pH 6~8环境中有效抑制G+/G-细菌、酵母菌和霉菌生长,甚至对一些耐热性芽孢杆菌和病毒也有明显抑制作用[2-3],故展现出广泛的抑菌活性,被作为防腐剂应用于食品、化妆品、纺织、皮革和造纸等领域[4-5]。另外,作为多阳离子生物聚合物,ε-PL还被用作药物载体、芯片包被材料等[6-7]。因此,ε-PL是一种具有较大市场需求和经济价值的新型生物发酵产品。
提高ε-PL发酵水平以降低其生产成本是推动ε-PL 在上述领域被广泛应用的重要前提。因此,获得1株发酵产量高、工业属性强的ε-PL生产菌是过去40多年来的研究重点。HIRAKI等[8]于1998年借助物理/化学诱变结合S-2-氨基乙基-L-半胱氨酸和甘氨酸双重抗性筛选,通过20多年的反复选育获得1株ε-PL高产突变菌株S.albulus11011A,其摇瓶产量达到2.11 g/L,较出发菌提高了10倍。通过进一步发酵工艺的优化,实现192 h连续发酵ε-PL产量达到48.3 g/L[9]。本研究团队,自2000年开始,综合利用物理/化学诱变、基因组重排[10]、核糖体工程和抗性筛选[11]等策略,选育获得一系列ε-PL高产菌株,其中S.albulusGS114摇瓶产量达到3.0 g/L(较出发菌株提高了近10倍),5 L发酵罐产量达到53.5 g/L(192 h)[12]。尽管传统诱变选育实现了生产菌ε-PL合成能力的大幅度提高,但选育时间长、工作量繁重和不确定性因素多,成为进一步提高生产菌ε-PL合成能力的瓶颈。随着基因工程和组学技术的发展,利用代谢工程手段改造ε-PL生产菌成为一种有效的方法[13-15]。
已有的研究资料显示,ε-PL生物合成是以L-赖氨酸作为前体、ATP作为辅因子,在ε-PL合成酶(Pls)催化下形成ε-PL[16]。那么,通过在S.albulus中过表达pls是否能够提高ε-PL产量?令人遗憾的是,目前国内外还未见相关报道。本研究首先构建pls过表达菌株S.albulusM-Z18/pIB139-pls,再通过外源添加L-赖氨酸和ATP强化前体和能量辅因子供给,以尝试提高S.albulusM-Z18的ε-PL合成能力。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本实验所使用的菌株及质粒如表1所示。目的基因扩增引物及qRT-PCR验证引物如表2所示。

表2 本研究中使用的引物序列Table 2 Primer sequences used in this study
1.1.2 酶与试剂
菌株构建酶和试剂盒:限制性内切酶、质粒提取试剂盒、片段纯化试剂盒、感受态制备试剂盒,TaKaRa;一步克隆试剂盒、Phanta酶,南京诺唯赞生物科技有限公司。
qRT-PCR相关试剂盒:B511321 Trizol 总RNA抽提试剂盒、UNlQ-10柱式Trizol总RNA抽提试剂盒,上海生工;GeneRuler DNA Ladder Mix、Maxima Reverse Transcriptase,Thermo Scientific。
1.1.3 培养基
固体培养基及种子培养基分别选用BTN和M3G培养基[17];摇瓶、分批、补料分批发酵培养基(RSM培养基)(g/L):葡萄糖 60,酵母粉 10,(NH4)2SO410,MgSO4·7H2O 0.8, FeSO4·7H2O 0.05,KH2PO44,pH 6.8;LB培养基(g/L):胰蛋白胨 10,酵母粉 5,NaCl 5,pH 7.0;MS培养基(g/L):甘露醇 20,黄豆粉 20,琼脂 20,pH自然。灭菌后加入MgCl2至终浓度10 mmol/L;YT培养基(2×)(g/L):胰蛋白胨 16,酵母粉 10,NaCl 5,pH 7.0; TAE缓冲液(50×)(g/L):Tris 242,EDTA 18.612,冰醋酸 57.1 mL,pH 8.3。
1.1.4 仪器与设备
AB204-N分析天平,瑞士梅特勒公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;GNP-9160隔水式恒温培养箱,上海光都仪器设备有限公司;HYL-C组合式摇床,太仓市强乐设备有限公司;3K15高速冷冻离心机,德国西格玛公司;UV-2100分光光度计,优尼科仪器有限公司;GI100T高压蒸汽灭菌器,致微仪器有限公司;C1000 Touch PCR仪、Gel Doc EZ 凝胶成像仪,BIO-RAD;DYCP-31DN 电泳仪,北京市六一仪器厂。
1.2 实验方法
1.2.1 培养方法
种子培养:挑取2~3环孢子接种至种子培养基,30 ℃、200 r/min培养20 h左右。
摇瓶发酵:将培养20 h左右的种子液按照8%(体积分数)接种量接入RSM培养基,30 ℃、200 r/min培养约24 h后(pH值下降至4.0左右),加入预调pH为4.0的L-赖氨酸和ATP母液至终浓度分别为5 g/L和1.0 mmol/L,继续发酵至96 h结束。
发酵罐发酵:在5 L发酵罐中装入3.5 L RSM培养基,发酵开始前将初始pH调至6.8,接种后pH自然下降,当pH降至pH 3.6~4.0时,加入预调pH 4.0 的L-赖氨酸和ATP母液,并一直维持L-赖氨酸质量浓度为5.0 g/L、ATP浓度为1.0 mmol/L至发酵结束。同时,利用氨水将pH值控制在3.6~4.0直至发酵结束,其他参数按许永杰等[18]的方式控制。
上述培养基中均加入安普霉素至终质量浓度50 μg/mL。
1.2.2 感受态细胞制备
参照TaKaRa大肠杆菌感受态制备试剂盒说明书。
1.2.3 接合转移及重组子的鉴定
从-80 ℃冰箱中取出保藏含过表达载体的E.coliET12567/pIB139甘油管,划线分离后,30 ℃过夜培养。挑取单菌落接种到含5 mL LB液体培养基(安普霉素50 μg/mL,氯霉素和卡那霉素25 μg/mL)的试管中,37 ℃、200 r/min过夜培养。以1%(体积分数)接种量转接新鲜的含相同抗生素的LB试管,相同条件培养至OD600达到0.4左右,冰浴5 min后离心弃上清,菌体沉淀用预冷的不含抗生素的LB培养基洗涤2次后,重悬于0.5 mL 2×YT培养基中,置于冰上备用。S.albulusM-Z18孢子制备:取生长8 d的平板,将整个平板上的孢子全部刮到10 mL无菌水中,玻璃珠充分打散后用脱脂棉过滤制备成孢子悬浮液。取250 mL孢子悬浮液加入到250 mL 2×YT的培养基中并混合均匀,50 ℃热激10 min后,于37 ℃摇床,200 r/min预萌发2.5 h(或孢子刚刚萌发出芽管)。将上述的0.5 mL大肠杆菌和0.5 mL预萌发的孢子混合在一起,离心浓缩至100 μL涂布MS培养基,30 ℃倒置培养18 h。随后,覆盖安普霉素和萘啶酮酸,终浓度分别为50和25 μg/mL。相同条件,继续培养3~4 d,挑取结合子转接到含50 μg/mL安普霉素的BTN平板(可适当加入萘啶酮酸以防有大肠杆菌污染)。5~8 d后,提取基因组做菌落PCR:挑取结合子孢子至种子培养基培养18~20 h,取4 mL种子液,离心去上清,按照TaKaRa提基因组试剂盒提取基因组,以pIB139通用引物(表2)做PCR验证:95 ℃预变性5 min,95 ℃变性30 s,退火15 s,退火温度52 ℃(pls扩增时温度为72 ℃),72 ℃延伸2.06 min,循环次数为35次,72 ℃延伸10 min,4 ℃维持。
1.2.4 分析方法
菌体干重(dry cell weight,DCW)测定:10 mL发酵液在5 000 r/min离心15 min,沉淀倒入干燥并称重的滤纸上用去离子水洗涤2次后,105 ℃烘干至恒重,称重并计算菌体量。上清液用于ε-PL等含量的测定。
ε-PL浓度测定:使用甲基橙法,具体参考ITZHAKI[19]测定方法。
葡萄糖浓度测定:使用生物传感分析仪。样品稀释100倍,25 μL进样量进行测定,生物传感分析仪示数即为发酵液中葡萄糖浓度。
1.2.5 qRT-PCR
首先按照UNIQ-10柱式Trizol总RNA抽提试剂盒(B511321)操作步骤提取RNA,核酸电泳检查RNA提取质量,每个样品做3次重复。其次,按照800 ng RNA进行反转录得到cDNA,具体反应条件按照WANG等[20]方法进行,将得到的cDNA于-20 ℃保存。最后,将cDNA样品稀释10倍作为PCR反应模板进行PCR反应:2× SybrGreen qPCR Master Mix 10 μL,引物FPpls-qTF(10 μmol/L) 0.4 μL,引物Ppls-qTR (10 μmol/L) 0.4 μL,cDNA 2 μL,用ddH2O补足体系至20 μL。PCR条件按照WANG等[21]方法进行。
2 结果与分析
2.1 pls基因克隆与过表达菌株构建
以S.albulusM-Z18基因组为模板,以引物pls-F/R进行PCR扩增,得到大小为4 069 bp的pls基因,如图1-a所示。将扩增得到的线性DNA片段pls回收纯化后与线性化pIB139(经NdeI和EcoR I酶切)进行一步克隆组装,并转化至感受态E.coilDH5α进行质粒扩增。提取得到的质粒双酶切(图1b)和测序验证后,获得正确重组质粒pIB139-pls。最后,将质粒pIB139-pls转化入感受态E.coilET12567,并与预萌发的S.albulusM-Z18孢子混合涂布于MS平板进行接合转移。混合培养18 h后,分别覆盖终质量浓度50 mg/L的安普霉素和25 mg/L的萘啶酮酸,继续培养2~3 d。将长出的结合子在含50 μg/mL安普霉素的BTN平板上进行松弛培养2代,再以pIB139通用引物M13(47)-F和M13(48-R)(表2)对松弛培养后的菌落进行菌落PCR验证,得到理论大小正确的条带(图1-c),获得重组过表达菌株S.albulusM-Z18/pIB139-pls。
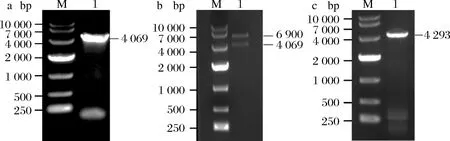
a-pls基因的PCR扩增电泳图;b-重组质粒双酶切鉴定;c-结合子菌落PCR鉴定结果图1 pls分子验证电泳图Fig.1 Electropherogram of pls verification
2.2 过表达pls基因对S. albulus发酵生产ε-PL的影响
将原始菌株S.albulusM-Z18、含空载质粒菌株S.albulusM-Z18/pIB139和过表达菌株S.albulusM-Z18/pIB139-pls进行摇瓶发酵。发酵结果显示,S.albulusM-Z18/pIB139的ε-PL产量为(1.50±0.30) g/L与原始菌株S.albulusM-Z18产量(1.4~1.6 g/L)没有明显区别,而S.albulusM-Z18/pIB139-pls的ε-PL产量为(2.74±0.23) g/L,相较S.albulusM-Z18/pIB139和S.albulusM-Z18均提升了82.7%。进一步qRT-PCR检测显示,过表达菌株S.albulusM-Z18/pIB139-pls中的pls基因转录水平较原始菌株S.albulusM-Z18上调了16.8倍,说明过表达pls基因能显著提高ε-PL产量。
由于摇瓶发酵不能对pH值、溶氧、碳源浓度等发酵条件进行有效控制,因此,将实验环境改为5 L发酵罐补料分批发酵,结果如图2所示。S.albulusM-Z18/pIB139和S.albulusM-Z18/pIB139-pls保持相同的菌体生长趋势,均在96 h进入平稳期,并在132 h进入衰亡期。同样,ε-PL产量也保持相同的增长趋势。发酵144 h后,S.albulusM-Z18/pIB139和S.albulusM-Z18/pIB139-pls的ε-PL产量分别达到37.57 g/L和40.62 g/L,菌体量分别为47.66 g/L和51.24 g/L。S.albulusM-Z18/pIB139-pls的菌体干重和ε-PL产量较S.albulusM-Z18/pIB139分别提高了26.1%和26.9%,表明S.albulusM-Z18/pIB139-pls的ε-PL产量增加可能是由菌体量的增加引起的。与上述摇瓶发酵结果相比,S.albulusM-Z18/pIB139-pls的ε-PL产量并未因为pls基因转录水平提高而增加。

图2 S. albulus M-Z18/pIB139和S. albulusM-Z18/pIB139-pls在5 L发酵罐中补料分批发酵生产ε-PL结果Fig.2 Time profiles of S. albulus M-Z18/pIB139 and S. albulus M-Z18/pIB139-pls for ε-PL production in 5 L bio-fermenter by fed-batch fermentation
2.3 外源添加L-赖氨酸和ATP对过表达菌株S. albulus M-Z18/pIB139-pls合成ε-PL的影响
由2.2实验结果可知,pls过表达之后的S.albulusM-Z18尽管其基因转录上调了16.8倍,而在发酵过程中的产量却只有微小的提升,对此我们进行了几方面的猜想:pls基因转录大幅上调,而基因翻译过程可能收到某些因素的影响没有起到相应的效果;由于Pls是膜蛋白,需要结合到细胞膜表面才能进行正常的工作,那么细胞膜上是否有充足的装配位点?恒定条件下细胞合成ε-PL的胞内物质是一个稳定的代谢水平,其胞内合成的前体物质L-赖氨酸是否有足够的通量供其合成产物?我们通过考察第3个条件来初步判断出现这种情况的可能原因。
由表3可知,外源添加L-赖氨酸均能够提高空载菌和pls过表达菌的摇瓶产量。随着L-赖氨酸浓度的增加(1.0~7.0 g/L),2株菌的ε-PL产量同步增加,并同时在5.0 g/LL-赖氨酸添加浓度时,实现最大ε-PL产量,分别达到(2.41±0.28) g/L和(3.35±0.08) g/L,较未添加分别提高了60.7%和22.2%。CHEN等[22]报道,外源添加2 g/LL-赖氨酸能够提高S.albulusM-Z18摇瓶ε-PL产量5.2%,可知过表达pls能提高L-赖氨酸利用率和ε-PL产率。然而,外源添加ATP对S.albulusM-Z18/pIB139和S.albulusM-Z18/pIB139-pls摇瓶ε-PL产量的作用表现出显著差异。添加ATP(1.0~4.0 mmol/L)能够显著提高S.albulusM-Z18/pIB139的ε-PL产量,但随着ATP浓度增加,ε-PL产量提高幅度呈现下降趋势;添加1.0 mmol/L ATP能够将S.albulusM-Z18/pIB139-pls摇瓶ε-PL产量提高18.2%,当添加量超过1.0 mmol/L后,ε-PL产量却显著下降并且低于对照值,这表明相对高浓度的ATP对ε-PL的合成表现出一定的反馈抑制,我们推测是高浓度的ATP影响了糖酵解和氧化磷酸化进程,进而影响了菌体整体活力。当我们在最适L-赖氨酸添加量(5.0 g/L)基础上,继续考察添加ATP(1.0~4.0 mmol/L)对提高ε-PL产量的作用,发现复合添加L-赖氨酸和ATP对2株菌的ε-PL产量影响如同单独添加ATP,并在5.0 g/LL-赖氨酸+1.0 mmol/L ATP添加策略下,实现S.albulusM-Z18/pIB139-pls摇瓶ε-PL产量达到(3.99±0.72) g/L,较对照提高了45.6%,说明复合添加L-赖氨酸和ATP能够最大化发挥ε-PL合成酶的作用。

表3 外源添加L-赖氨酸和ATP对pls过表达菌株合成ε-PL的影响Table 3 Effects of exogenous addition of ATP and lysine on ε-PL production by pls overexpressed strain
2.4 基于L-赖氨酸+ATP复合流加的过表达菌株S. albulus M-Z18/pIB139-pls发酵生产ε-PL
为了更准确评估外源添加L-赖氨酸和ATP对过表达菌株S.albulusM-Z18/pIB139-pls发酵生产ε-PL的影响,我们将发酵过程放大到5 L发酵罐,发酵过程参数如图3所示。S.albulusM-Z18-pIB139和S.albulusM-Z18/pIB139-pls在分别流加5.0 g/LL-赖氨酸+1.0 mmol/L ATP后,菌体生长趋势和ε-PL产量增加趋势保持一致,并分别在120 h达到最大菌体量(42.43和52.40 g/L)以及在144 h达到最高ε-PL产量(39.22和45.09 g/L)。由此可以看出,过表达pls基因不仅能够提高ε-PL产量(增加15.0%)而且能够提高菌体量(增加23.5%)。与未流加5.0 g/LL-赖氨酸+浓度1.0 mmol/L ATP的发酵结果(图2)相比,复合流加L-赖氨酸和ATP将S.albulusM-Z18-pIB139的ε-PL产量提高了4.4%而菌体量降低了11.0%;将S.albulusM-Z18/pIB139-pls的ε-PL产量和菌体量提高了11.0%和2.3%,表明流加L-赖氨酸和ATP对对照菌株的ε-PL产量提升几乎没有贡献,反而会降低菌体量;而对过表达pls基因的工程菌的ε-PL产量和菌体量均有提升作用。综合来看,通过过表达pls基因和流加5.0 g/LL-赖氨酸+1.0 mmol/L ATP,可以将ε-PL产量从35.57 g/L提高到45.09 g/L,增加了20.8%;并将菌体量从47.66 g/L提高到52.40 g/L,增加了9.9%。从以上结果看,外源添加L-赖氨酸和ATP能部分提高pls过表达菌株的ε-PL产量,而对空载菌没有明显作用,这在一定程度上验证了由于前体物质缺乏导致pls过表达菌株产量提高不明显的猜想,而提高的程度没有达到转录水平的16.8倍,同样可以证明猜想1和2的可能性,这部分还需要进一步的实验证明。
在发酵过程中,空载菌和pls过表达菌株出现异于原始菌株的过程菌体量显著上升又逐渐下降的情况。过程菌体量上升可能是由于包含强启动子PermE*的pIB-139质粒整合到S.albulusM-Z18基因组上多个attB位点时造成了某些代谢通量的增强,XU等[15]使用pSET152(pIB139同源质粒)在S.albulusPD-1中过表达amtB基因时,空载菌和amtB过表达菌株发酵过程菌体量都出现一定程度的提高。有趣的是,2株工程菌在发酵120 h后菌体量又迅速下跌,可能的原因是此时发酵已进入衰亡期,大量的菌体老化,同时在50 mg/L安普霉素作用下迅速凋亡,新生菌体生成速度小于菌体老化死亡速度,造成菌体总量的下降。
3 结论
ε-PL在包括食品、化妆品和生物医药等领域具有广泛的应用前景,通过分子生物学手段改造生产菌,以进一步提高其发酵产量和降低生产成本具有重要意义。本研究通过过表达ε-PL合成酶基因pls构建过表达菌株S.albulusM-Z18/pIB139-pls,实现pls基因转录上调16.8倍,摇瓶ε-PL产量达到(2.74±0.23) g/L,在5 L发酵罐中实现ε-PL产量达到40.62 g/L(144 h)。为进一步提高过表达菌株的生产能力,通过优化L-赖氨酸和ATP外源添加浓度,最终建立S.albulusM-Z18/pIB139-pls在5 L发酵罐中同时流加5.0 g/LL-赖氨酸和1.0 mmol/L ATP的补料分批发酵方式,实现ε-PL产量达到45.09 g/L(144 h),较对照菌株S.albulusM-Z18/pIB139提高了20.8%。可见,采用过表达pls基因并结合补充前体L-赖氨酸和能量辅因子ATP是一种有效提高ε-PL发酵水平的策略。

