CMKLR-1等细胞因子在不同程度糖尿病视网膜病变患者中的表达变化
张 颖,吉向军,李淑霞,葛淑芝,李华君
糖尿病视网膜病变(diabetic retinopathy, DR)是一种常见的糖尿病微血管并发症,发病率在多种糖尿病微血管病变中占较大比重[1],严重者甚至会导致失明[2]。根据病变表现DR又被分为增生性与非增生性,判断标准为是否出现新生血管[3]。关于DR的发病机制,目前国内外尚无定论[4],但有研究发现,DR的发病与炎症因子及脂肪代谢紊乱有密切关系[5]。增生性DR患者血清及玻璃体中白细胞介素-1β(IL-1β)表达水平明显高于健康人群[6]。趋化因子样受体-1(CMKLR-1)是趋化素(Chemerin)的内源性配体[7],当其与配体结合后将促进细胞中钙离子释放,进而调控核因子-κB(NF-κB)及细胞外调节蛋白激酶1等信号传导通路,在心血管疾病、代谢性疾病及炎症性疾病等多种疾病的发病中发挥重要作用[8]。CMKLR-1主要存在于血管平滑肌细胞、上皮细胞、内皮细胞、破骨细胞、白细胞及脂肪细胞中,与白细胞介素-1相互作用,而出现炎症级联反应不断放大的恶性循环。CMKLR-1可以对小鼠平滑肌细胞发挥抑制增殖作用[9]。亦有研究指出,通过饮食控制及加强运动会影响Chemerin和CMKLR-1在糖尿病大鼠肝细胞中的表达,而影响糖脂质代谢[10]。本研究对我院就诊的DR患者CMKLR-1、Chemerin、IL-1β、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、NF-κB因子进行检测,探讨这些因子在不同程度DR患者中的表达。
1 对象及方法
1.1对象及分组 选取2017年5月—2018年5月我院就诊的DR患者120例,据病变程度均分为非增生组(非增生性DR患者)及增生组(增生性DR患者)。纳入标准:①2型糖尿病;②符合国际糖尿病性视网膜病变诊断标准及世界卫生组织1999年提出的糖尿病诊断标准[11];③年龄40~72岁;④对本研究知情同意。排除标准:①患严重肝肾功能不全、炎症性疾病者;②先天性免疫功能缺陷者,近2个月内应用免疫抑制剂者;③妊娠期及哺乳期妇女;④有白内障、青光眼等眼部疾病者。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医院伦理委员会同意进行。
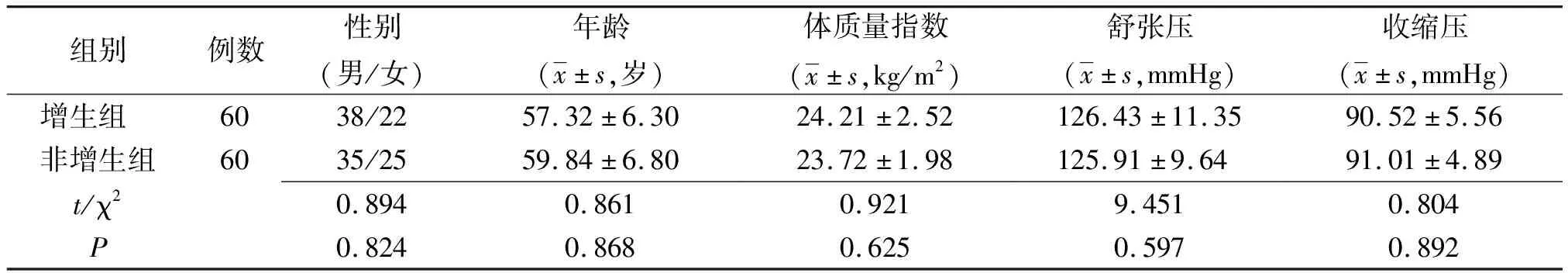
表1 不同程度糖尿病视网膜病变两组患者一般资料比较
1.2研究方法 观察两组患者空腹血糖(FPG)、糖化血红蛋白(HbA1c)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三酯(TG)和病程差异,以及两组CMKLR-1、Chemerin、IL-1β、TNF-α、IL-6、NF-κB水平变化情况。
1.3检测方法
1.3.1血糖血脂检测:取所有患者入组日晨空腹肘静脉血5 ml,应用全自动生化分析仪检测血清FPG、HbA1c、HDL-C、LDL-C、TC、TG水平。
1.3.2细胞因子检测:取所有患者入组日晨空腹肘静脉血5 ml,1500 r/min离心15 min取血清,采用酶联免疫吸附法检测CMKLR-1、Chemerin、IL-1β、TNF-α、IL-6水平,试剂盒购自美国Sigma公司,所有操作按试剂盒说明进行。
2 结果
2.1两组血糖、血脂、病程比较 两组FPG、HbA1c、HDL-C、TC、TG比较差异无统计学意义(P>0.05);增生组LDL-C水平明显高于非增生组,病程明显长于非增生组,差异均有统计学意义(P<0.05)。见表2。

表2 不同程度糖尿病视网膜病变两组患者血糖、血脂、病程比较
2.2两组炎性因子比较 增生组IL-1β、IL-6、TNF-α、NF-κB水平高于非增生组,差异有统计学意义(P<0.05)。见表3。

表3 不同程度糖尿病视网膜病变两组患者炎性因子水平比较
2.3两组Chemerin、CMKLR-1水平比较 增生组Chemerin、CMKLR-1水平均高于非增生组,差异均有统计学意义(P<0.05)。见表4。

表4 不同程度糖尿病视网膜病变两组患者Chemerin、CMKLR-1水平比较
3 讨论
有研究发现,DR的发病与糖尿病患者的血糖控制及病情发展进程相关,且与炎症因子及脂肪代谢紊乱有密切关系[12]。当视网膜长期处于低氧状态,将会引起相关因子表达上调,导致血管内皮生长因子在内的多种因子过表达,刺激内皮细胞分裂,且会造成轻微炎性反应。而新生的血管极为脆弱,容易纤维化、出血、破裂而影响视网膜,导致患者视力严重下降[13]。目前有研究发现,增生性DR患者血清及玻璃体中IL-1β表达水平明显高于健康人群[14]。当机体处于糖尿病状态下,IL-1β会趋化中性颗粒细胞及单核细胞,从而刺激上皮细胞在视网膜中迁移,导致血管新生[15]。此外,IL-1β水平还会随着患者血糖的升高而上调,并通过NF-κB信号传导通路上调IL-6表达,刺激视网膜中的毛细血管增生。IL-1β对具有抗炎和抗血管生成作用的白细胞介素-4及褪黑激素会产生抑制作用,这就加剧了DR患者的炎性反应。
CMKLR-1是Chemerin的内源性配体,有研究发现其水平会在发生微血管病变患者中升高,对小鼠平滑肌细胞发挥抑制增殖作用[16]。CMKLR-1主要存在于血管平滑肌细胞、上皮细胞、内皮细胞、破骨细胞、白细胞及脂肪细胞中,在早期出现炎性反应时,被浸润的局部炎性细胞脱颗粒释放出包括弹性蛋白酶在内的多种蛋白酶,在这一过程中,Chemerin被激活,从而聚集带有CMKLR-1的抗原递呈细胞及炎症、免疫细胞[17]。而Chemerin的分泌及合成会被具有促炎作用的TNF-α和IL-1β促进,同时TNF-α及IL-1β的分泌又会被Chemerin促进,这就出现了炎症级联反应不断放大的恶性循环[18]。
本研究发现,两组FPG、HbA1c、HDL-C、TC、TG比较差异无统计学意义;增生组LDL-C水平明显高于非增生组,病程明显长于非增生组,差异均有统计学意义。增生组IL-1β、IL-6、TNF-α、NF-κB及Chemerin、CMKLR-1水平均高于非增生组,差异均有统计学意义。提示CMKLR-1、Chemerin、IL-1β、IL-6、TNF-α、NF-κB细胞因子在DR中异常表达,且随DR程度的加重表达水平逐渐升高,CMKLR-1等细胞因子可能在DR患者病情变化中起重要作用。

