先天性心脏病患儿体外循环下心脏术后发生急性肾损伤的影响因素及预后分析
李小英,李向利,于晓倩,李 娅,常方丽
先天性心脏病(congenital heart disease, CHD)是胚胎发育时期由于多种原因引起的心脏结构、血管形态及功能发育异常的一类疾病,是导致婴幼儿死亡的最主要原因。流行病学数据显示,CHD患病率约占活产婴儿的1%,我国每年新增CHD患儿约15~20万例[1]。鞠叶兰等[2]对85 523例新生儿检测发现,1131例合并CHD,发病率为13.22‰。对于轻度CHD畸形患儿可自愈,无需特殊治疗,但严重CHD患儿常需手术治疗。近年来,体外循环(cardiopulmonary bypass, CPB)快速发展,其有助于提高心内直视手术的安全性。文献报道,CHD患儿行CPB时可导致多种并发症发生,且以肾、肺损伤较常见[3]。急性肾损伤(acute kidney injury, AKI)是CPB术后CHD患儿常见的严重并发症,具有较高的发病率及病死率。CHD患儿CPB术后AKI发生率为5%~30%[4]。严重AKI患儿缺乏有效的针对性治疗措施,可影响患儿生存率。因此,在AKI发生前,通过患儿临床资料评估AKI发生的影响因素及风险,进而采取预防措施,对降低其发生率、改善患儿预后有重要意义。既往研究表明,CPB时间、患儿年龄及体质量、术中深低温停循环等均可影响CPB术后AKI发生率,但尚缺乏统一定论[5]。高血糖、低蛋白血症、高乳酸血症影响成人心脏术后AKI患者预后,但尚未见在CHD患儿中的相关报道。本研究回顾性分析我院行CPB下心脏手术的560例CHD患儿的临床资料,探讨术后AKI发生的影响因素,并随访分析AKI患儿预后的危险因素。
1 对象与方法
1.1研究对象 选取2013年10月—2017年10月我院行CPB下心脏手术治疗的CHD患儿560例,男335例,女225例;年龄6~60(20.0±6.0)个月;体质量8.1~16.2(12.3±3.5)kg。
1.2纳入及排除标准 纳入标准:①符合CHD诊断标准[6],其中房间隔缺损150例,室间隔缺损136例,瓣膜畸形102例,动脉导管未闭79例,肺动脉狭窄43例,大动脉转位38例,法洛四联症12例;②年龄0.5~8岁;③首次手术治疗患儿。排除标准:①术前血肌酐>110 μmol/L或患慢性肾脏疾病;②行手术治疗时未采用CPB;③同期行其他部位手术患儿;④术后48 h内死亡患儿。
1.3AKI判断标准及分组 术后发生AKI标准:术后48 h内患儿血肌酐升高≥26.5 μmol/L或≥基线水平1.5倍或尿量<0.5 ml/(kg·h)持续6 h以上[7]。依据术后48 h是否发生AKI,560例CHD患儿分为AKI组100例和非AKI组460例。
1.4方法
1.4.1手术方法:患儿均采用标准麻醉方案、手术方案及CPB方法,术后均转入重症监护病房(intensive care unit,ICU)。手术正中开胸,CPB下修补畸形。间断性灌注心肌保护液(4︰1含血高钾停跳液或全晶体Custodial液)。CPB采用平流滚轴泵灌注,灌注流量、血红蛋白维持水平等依据文献[8]。若超滤至血红蛋白>100 g/L,应用正性肌力药物。
1.4.2临床资料收集:收集两组一般资料,心肺病史(心力衰竭或肺炎等),术前先天性心脏病手术风险评估共识(the risk adjustment for congenital heart sugery-1, RACHS-1)评分(1~5分)[9]、左室射血分数(LVEF),术中资料(血糖、血红蛋白、乳酸值、主动脉阻断时间、CPB时间、是否深低温停循环等),术后指标[AKI分级、机械通气时间、低血压、术后48 h内正性肌力药物分值(inotropic score, IS)、红细胞输注情况]等。AKI分级标准[8]:术后48 h内血肌酐最高值是术前基础水平的1.5~2倍为1级;术后48 h内血肌酐最高值是术前基础水平的2~3倍为2级;术后48 h内血肌酐最高值≥术前基础水平的3倍为3级。IS=多巴胺+巴酚丁胺+米力农×15+肾上腺素×100+去甲肾上腺素×100+异丙肾上腺素×100[8]。
1.4.3随访:术后对AKI组进行随访,每2个月随访1次,末次随访时间为2018年10月31日。观察AKI组死亡情况,记录患儿CPB下心脏术后美国纽约心脏病学会(NYHA)心功能分级、是否行肾脏替代治疗(renal replacement therapy, RRT)、住院时间、ICU入住时间等。
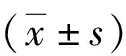
2 结果
2.12组一般资料比较 AKI组年龄小于非AKI组,有肺炎或心力衰竭史比率、术前血肌酐、术中血糖、术后低血压比率均高于非AKI组,主动脉阻断时间、CPB时间均长于非AKI组,差异均有统计学意义(P<0.05或P<0.01)。见表1。
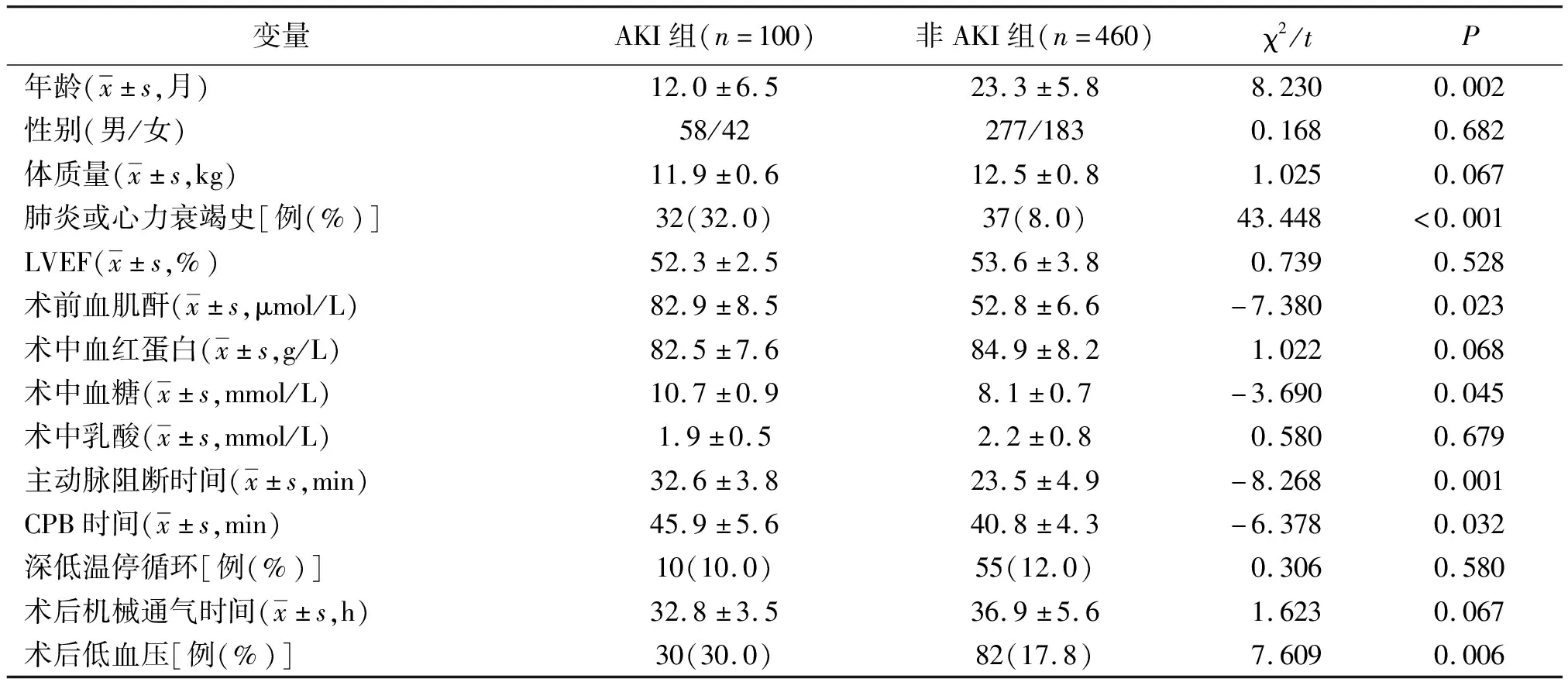
表1 体外循环下心脏术后是否发生AKI的先天性心脏病患儿2组一般资料比较
2.2AKI发生的多因素Logistic回归分析 以单因素分析差异有统计学意义的因素(年龄、合并肺炎或心力衰竭史、术前血肌酐、术中血糖、主动脉阻断时间、CPB时间、术后低血压)为自变量,以是否发生AKI为因变量行多因素Logistic回归分析,分析结果发现年龄<12个月、有肺炎或心力衰竭史、术前血肌酐>70 μmol/L、主动脉阻断时间>30 min、CPB时间>45 min是CHD患儿CPB下心脏术后AKI发生的危险因素(P<0.05或P<0.01)。见表2、3。
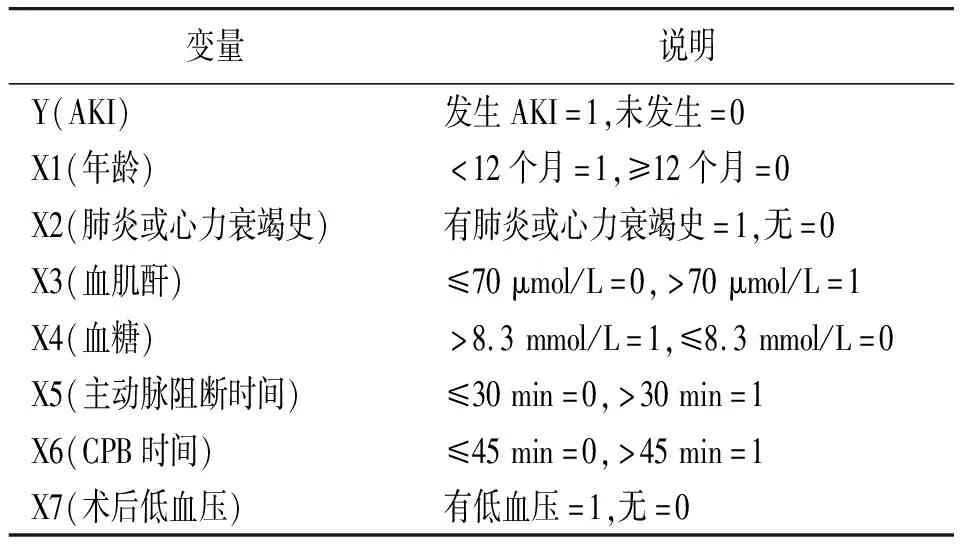
表2 先天性心脏病患儿体外循环下心脏术后AKI发生的多因素Logistic回归分析赋值说明
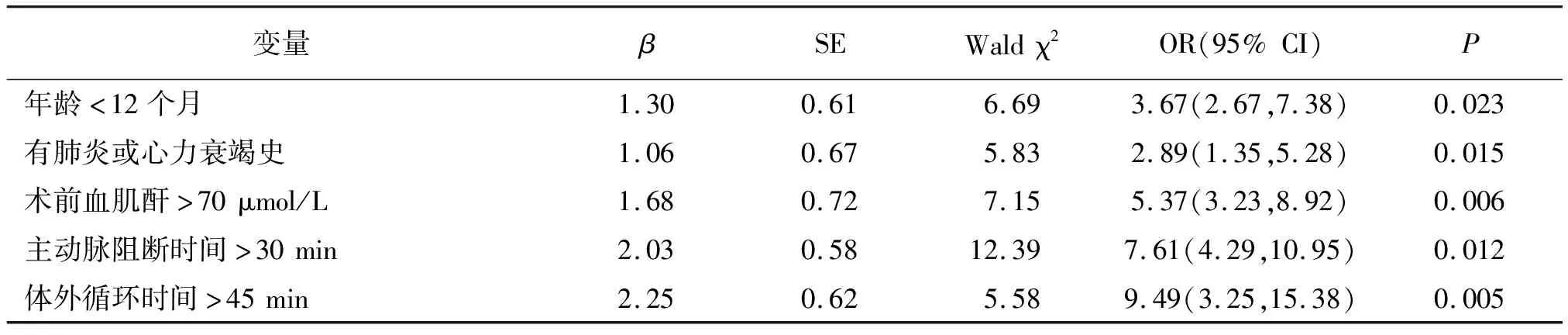
表3 先天性心脏病患儿体外循环下心脏术后急性肾损伤发生的多因素Logistic回归分析
2.3随访结果 AKI组随访结束时共死亡18例,病死率18.0%,死因分别为低心排综合征7例,多器官功能障碍5例,感染性休克及心脏骤停各3例。
2.4AKI组死亡患儿与存活患儿一般资料比较 AKI组死亡患儿术后NYHA心功能分级Ⅲ~Ⅳ级比率、AKI分级3级比率、RACHS-1评分4~5分比率、术后行RRT比率均高于存活患儿,术前血肌酐、术中血糖、术后红细胞输注量、术后IS高于存活患儿,主动脉阻断时间、CPB时间长于存活患儿,差异均有统计学意义(P<0.05或P<0.01)。见表4。
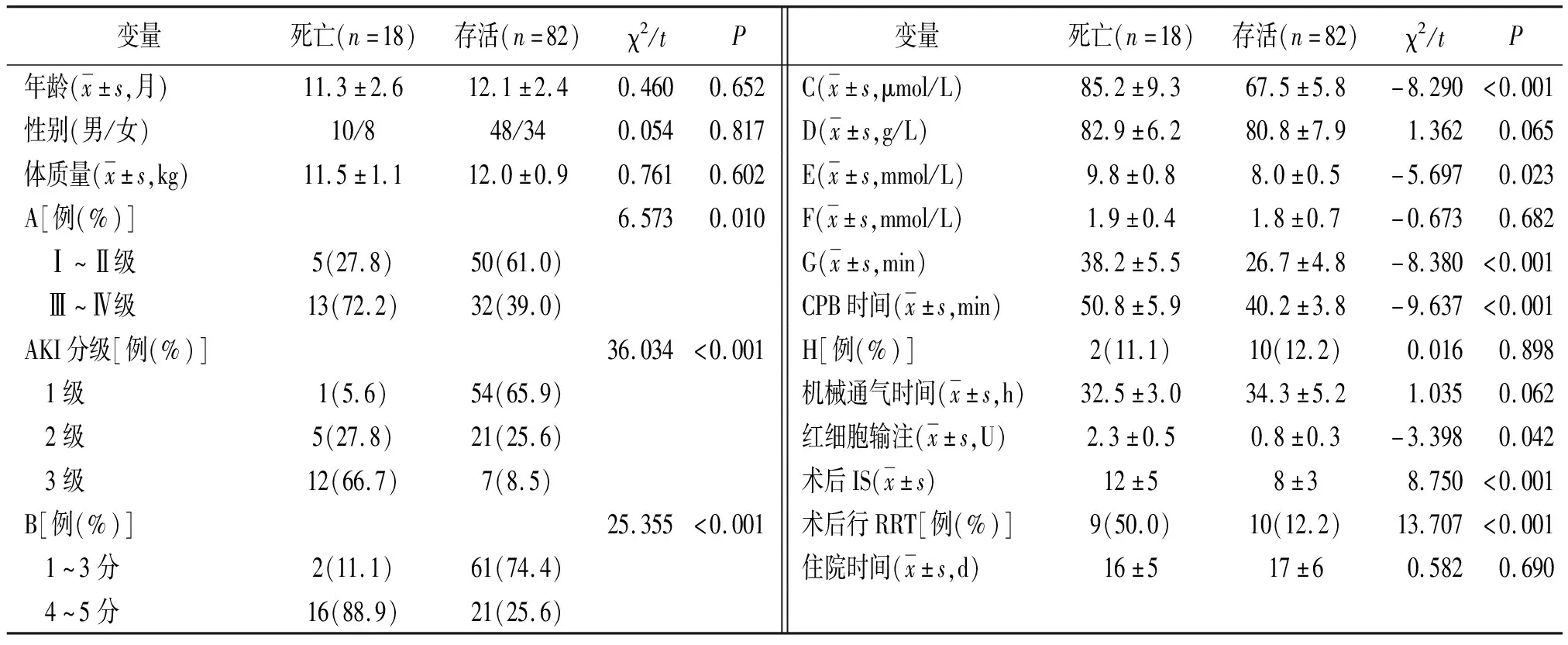
表4 先天性心脏病体外循环下心脏术后发生AKI死亡患儿与存活患儿一般资料比较
2.5AKI组患儿预后影响因素 以术后NYHA心功能分级(Ⅰ~Ⅱ级=0,Ⅲ~Ⅳ级=1)、AKI分级(1~2级=0,3级=1)、RACHS-1评分(1~3分=0,4~5分=1)、术中血糖(≤8.3 mmol/L=0,>8.3 mmol/L=1)等为自变量,以末次随访患儿生存状态(生存=0,死亡=1)为因变量进行多因素Cox回归分析,结果发现术后NYHA心功能分级Ⅲ~Ⅳ级(HR=1.50,95% CI:2.36,7.59,P=0.015)、术中血糖>8.3 mmol/L(HR=1.27,95% CI:1.26,5.89,P=0.008)是CHD CPB下心脏术后发生AKI患儿的预后危险因素。
3 讨论
CPB是通过心、肺转流使血流不经过心脏,同时维持机体全身血流灌注的方法,是CHD患儿行心内直视术的必备条件。AKI是CPB下心脏术后常见并发症之一,既往认为术后发生轻中度AKI患者预后尚可,但最新研究发现,AKI不仅增加患者短期病死率及慢性病发生率,而且对患者的远期生存率也有较大影响[10-12]。大样本回顾性分析显示,AKI是CHD患者预后的影响因素,可明显降低患者生存率,且随AKI严重程度的加重,对患者生存率的影响越明显[13]。AKI的发生与CPB下心脏术中肾脏缺血再灌注损伤、微小血栓形成及内毒素释放引起的全身炎性反应有关[14]。CHD患儿CPB下心脏手术后AKI的发生机制与成人不同,表现为术后即刻血肌酐明显升高。因此,探讨CHD患儿CPB下心脏术后AKI发生的影响因素,进而提前干预或预防,对降低术后AKI发生、改善患儿预后至关重要。
本研究表明,560例CHD患儿CPB下心脏手术后AKI发生率为17.9%,符合文献[15]报道。本研究发现,年龄<12个月、有肺炎或心力衰竭史、术前血肌酐>70 μmol/L、主动脉阻断时间>30 min、CPB时间>45 min是CHD患儿CPB下心脏术后AKI发生的危险因素。温昱鹏等[16]对150 例非发绀型CHD患儿CPB术后发生AKI的因素进行分析,结果发现年龄<1岁患儿发生AKI的风险是年龄≥1岁患儿的4.81倍,与本文结果一致。可能原因为年龄较小的患儿,肾脏发育不完善,肾功能相对较差,对应激刺激及缺血再灌注损伤的抵抗能力及代偿能力较差,一定程度上增加了AKI的发生风险[12]。
有肺炎或心力衰竭史是影响CPB下心脏术后AKI发生的重要因素。肺炎或心力衰竭可改变患儿血流动力学,较少肾脏血流灌注,进而致肾脏细胞外液不足及钠含量降低,影响肾小管及肾小球的过滤及重吸收,致肾脏缺血;肺炎或心力衰竭导致肾损伤时,肾功能降低,对药物毒性耐受性降低,加重AKI损伤。本研究表明,有肺炎或心力衰竭史患儿发生AKI的风险明显增加,与文献[17]结果一致。
主动脉阻断时间及CPB时间过长可增加AKI发生风险。CPB过程中,患儿长时间处于低灌注状态,非搏动性血流引起脉压差较小,导致血管阻力增加、肾脏血流不足。另外,CPB过程中,血液与人工材料的接触可激活中性粒细胞,释放大量炎性因子和氧自由基,导致肾脏炎症损伤和氧化损伤[18]。主动脉阻断可影响冠状动脉血流灌注,导致心肌缺血,主动脉阻断时间越久,心肌缺血越严重,继而导致低心排综合征,激活补体系统、单核细胞及内皮细胞导致AKI[17]。温昱鹏等[16]报道,主动脉阻断时间>30 min、CPB时间>40 min是CPB下心脏术后AKI发生的独立危险因素,与本研究结果相符。提示CPB过程中如何缩短主动脉阻断时间及CPB时间,对降低术后AKI发生率有重要意义。
血肌酐是评估肾功能常用指标,肾功能受损时其水平升高。孙华东等[19]研究表明,心脏术后AKI患者血肌酐明显升高,且术前血肌酐诊断AKI受试者工作特征曲线下面积为0.75。本研究表明,术前血肌酐>70 μmol/L是CHD患儿CPB下心脏术后AKI发生的危险因素。但因肾脏有一定储备能力,只有当肾功能严重受损时血肌酐才会明显升高,提示仅通过血肌酐水平难以敏感反映肾功能变化。
文献报道,CPB下心脏术后发生AKI患儿病死率为15%~30%[12]。本研究对100例发生AKI患儿进行随访,发现死亡18例,病死率18.0%,与既往文献[12]结果相符。AKI患儿预后与多种因素有关,如年龄、AKI分级及合并症等。NYHA心功能分级是评估患儿心力衰竭程度的常用指标。NYHA心功能分级Ⅲ~Ⅳ级患儿心力衰竭程度较严重,引起心肌重构、心肌收缩功能低下,导致低心排综合征。张博成等[20]对121例心力衰竭患者分析发现,随NYHA心功能分级的升高患者住院次数增加、住院时间延长,且合并贫血的程度越严重,病死率越高。本研究发现,AKI组死亡患儿CPB下心脏术后NYHA心功能分级Ⅲ~Ⅳ级比率明显高于存活患儿,Cox回归分析显示NYHA心功能分级Ⅲ~Ⅳ级是AKI患儿死亡的危险因素,与文献[20]结果相符。
心脏疾病与血糖关系密切。有学者监测心脏病患者术前血糖发现,48.4%的患者血糖异常[21]。围术期血糖波动>50 mg/dl可显著增加成人心脏术后AKI的发生风险,且是成人心脏病患者预后的独立危险因素[22-23]。目前,术中血糖对CHD患儿CPB下心脏术后预后评估作用尚存争议。Yates等[24]认为,术中血糖升高(>6.5 mmol/L)可降低心脏病患儿CPB后存活率。但有研究认为,CPB过程中血糖维持在4.4~6.1 mmol/L并未改善心脏病患儿预后[25]。本研究显示,术中血糖>8.3 mmol/L是CHD CPB下心脏术后发生AKI患儿的预后危险因素,与文献[8]报道相符。可能机制为:①血糖升高可激活Caspase-3信号传导通路,促进心肌凋亡;②高糖可上调核因子-κB表达,促进炎性反应,引起血流动力学不稳定;③渗透性利尿作用影响Frank-Starling机制,降低LVEF,影响心功能;④血糖升高可引起电解质紊乱及酸碱平衡失衡,引起代谢性酸中毒,加重组织损伤[26];⑤围术期血糖波动可激活血小板,致血液高凝状态,血栓形成。提示对CHD患儿应注意CPB下心脏术中血糖的控制,以改善预后。
综上所述,年龄(<12个月)、有肺炎或心力衰竭史、术前血肌酐升高(>70 μmol/L)、主动脉阻断时间延长(>30 min)、CPB时间延长(>45 min)可增加CHD患儿CPB下心脏术后发生AKI的风险,CPB下心脏术中血糖的严格控制有助于改善术后AKI患儿的生存状态。临床工作中,可对高危患儿进行针对性干预,以降低术后AKI的发生率。

